人氨基肽酶N在豬丁型冠狀病毒感染HEK293細胞中的作用
趙玉佳,陳 汭,宋代麗,張路文,肖 黛,李施倩,文翼平,伍 銳,趙 勤,杜森焱,顏其貴,文心田,曹三杰,2,3,黃小波,2,3*
(1.四川農業大學動物醫學院豬病研究中心,成都 611130;2.農業農村部獸用藥物與獸醫診斷技術四川科學觀測實驗站,成都 611130;3.四川農業大學國家級動物類實驗教學示范中心,成都 611130)
丁型冠狀病毒(deltacoronavirus)是新發現的冠狀病毒科(),丁型冠狀病毒屬()成員,可以感染哺乳動物和禽類。2009年,Woo等發現3種禽丁型冠狀病毒:夜鶯冠狀病毒HKU11、畫眉冠狀病毒HKU12和文鳥冠狀病毒HKU13。2012年,Woo等在豬和鳥群中鑒定出7種新型丁型冠狀病毒,對豬冠狀病毒HKU15-44和HKU15-155毒株13、和基因序列分析顯示其與亞洲豹貓冠狀病毒相似性高達99.8%,說明PDCoV在野生小型哺乳動物和豬之間可能存在跨種傳播。2014年,美國暴發豬丁型冠狀病毒(porcine deltacoronavirus,PDCoV)感染。隨后,韓國、加拿大、泰國、越南、日本和中國等國家也報道PDCoV引起的仔豬腹瀉性疾病。當前,已報道的PDCoV毒株全基因組序列相對保守,序列分析表明,PDCoV可能起源于麻雀丁型冠狀病毒(sparrow deltacoronavirus,SpCoV)。此外,美國報道的4種新型SpCoV與PDCoV親緣關系更為密切,表明PDCoV在豬和禽類之間也可能發生跨種傳播。
PDCoV是引起豬腸道疾病的主要病原,可感染各年齡階段的豬,感染仔豬出現嘔吐、腹瀉、脫水和死亡等臨床癥狀,影響全球養豬業的健康發展。人工接種PDCoV還可感染牛、雞和火雞等多種動物。體外試驗證實,病毒也可感染豬源細胞(LLC-PK、PK15、ST、IPEC和IPI-2I)、人源細胞(Huh7和Hela)、禽源細胞(LMH和DF-1)、牛源細胞(PBK和PBH)、猴源細胞(Vero-CCL81)和犬源細胞(MDCK)等多種細胞,顯示PDCoV具有廣泛的跨宿主傳播風險。
氨基肽酶N(aminopeptidase N,APN),又稱CD13,是一種膜結合的金屬蛋白酶,可與冠狀病毒S蛋白結合,介導病毒入侵宿主細胞。甲型冠狀病毒中,傳染性胃腸炎病毒(transmissible gastroenteritis virus,TGEV)、貓冠狀病毒(feline coronavirus,FCoV)、犬冠狀病毒(canine coronavirus,CCoV)和人冠狀病毒229E(human coronavirus 229E,HCoV-229E)被鑒定出以APN作為功能受體。此外,APN作為冠狀病毒受體具有種屬特異性。有研究表明,HCoV-229E以hAPN作為受體,而不能以豬APN(porcine APN,pAPN)作為受體。貓APN(feline APN,fAPN)可與TGEV、CCoV、HCoV-229E和FCoV結合。但是,APN在PDCoV入侵宿主細胞的過程中是否發揮受體功能存在爭議。Li等構建APN基因敲除細胞證明APN是PDCoV感染多種動物細胞的功能受體,病毒可通過S蛋白的S1結構域與APN的催化區域發生互作。Wang等也證明,pAPN在PDCoV入侵細胞中發揮受體功能。與之相反,部分研究結果卻證明,APN不是PDCoV的受體。也有研究顯示,APN雖不是PDCoV的關鍵受體,但其能影響PDCoV的早期感染和增殖過程。另外,Stoian等卻認為APN是PDCoV感染細胞的一個非必需細胞受體。
為驗證hAPN在PDCoV復制中的作用,本研究首先證實PDCoV可感染HEK293細胞,再進一步構建hAPN基因敲除細胞系和hAPN過表達質粒,驗證hAPN在PDCoV復制中的作用。通過同源建模和分子對接模擬PDCoV S 蛋白與hAPN蛋白的相互作用,為闡述PDCoV的細胞入侵機制和跨種傳播提供新的理論依據。
1 材料與方法
1.1 細胞、病毒和主要試劑
HEK293、HEK293T和ST細胞由本實驗室凍存;PDCoV四川分離株CHN-SC2015(GenBank收錄號:MK355396.1)由本實驗室分離、鑒定和保存。pCMV-SPORT6-ANPEP質粒由本實驗室構建保存;兔抗ACTB多克隆抗體(AC026),HRP-羊抗兔IgG(AS014),HRP-羊抗鼠IgG(AS003):武漢Abclonal公司;鼠抗ANPEP單克隆抗體(sc-166105):Santa Cruz公司;兔抗PDCoV N多克隆抗體由本實驗室制備保存。
1.2 PDCoV感染HEK293細胞
將PDCoV以MOI=0.1接種60 mm培養皿中的HEK293細胞,37 ℃吸附1 h,PBS洗2遍,加維持液繼續培養。于0、12、24、36和48 h取樣,通過RT-qPCR和Western blot檢測PDCoV感染HEK293細胞后的病毒含量;將PDCoV感染HEK293細胞24 h后的細胞培養物凍融3次后,連續傳至4代,通過RT-PCR檢測PDCoV在HEK293細胞上的增殖情況,TCID檢測不同代次的病毒滴度。
1.3 hAPN基因敲除細胞系的構建與鑒定
參考hAPN基因(NC_000015)序列,利用網絡在線工具(http://chopchop.cbu.uib.no/)設計一對sgRNA(表1)。合成的sgRNA經退火處理,連接到B Ⅰ酶切的線性化載體lenti CRISPR v2,構建同時表達Cas9和sgRNA的慢病毒轉移質粒。用Lipofectamine 3000將質粒按重組質粒∶psPAX2∶pMD2.G=5∶3∶2的比例共轉染至HEK293T細胞中,48 h后收上清。待T25細胞瓶中HEK293細胞長至50%時,感染慢病毒,36 h后,用含1 μg·mL嘌呤霉素(puromycin)的完全培養基進行抗性篩選;有限稀釋法挑選hAPN基因敲除細胞系,將其命名為hAPN。通過測序、RT-qPCR和Western blot鑒定hAPN在HEK293細胞上的敲除情況。
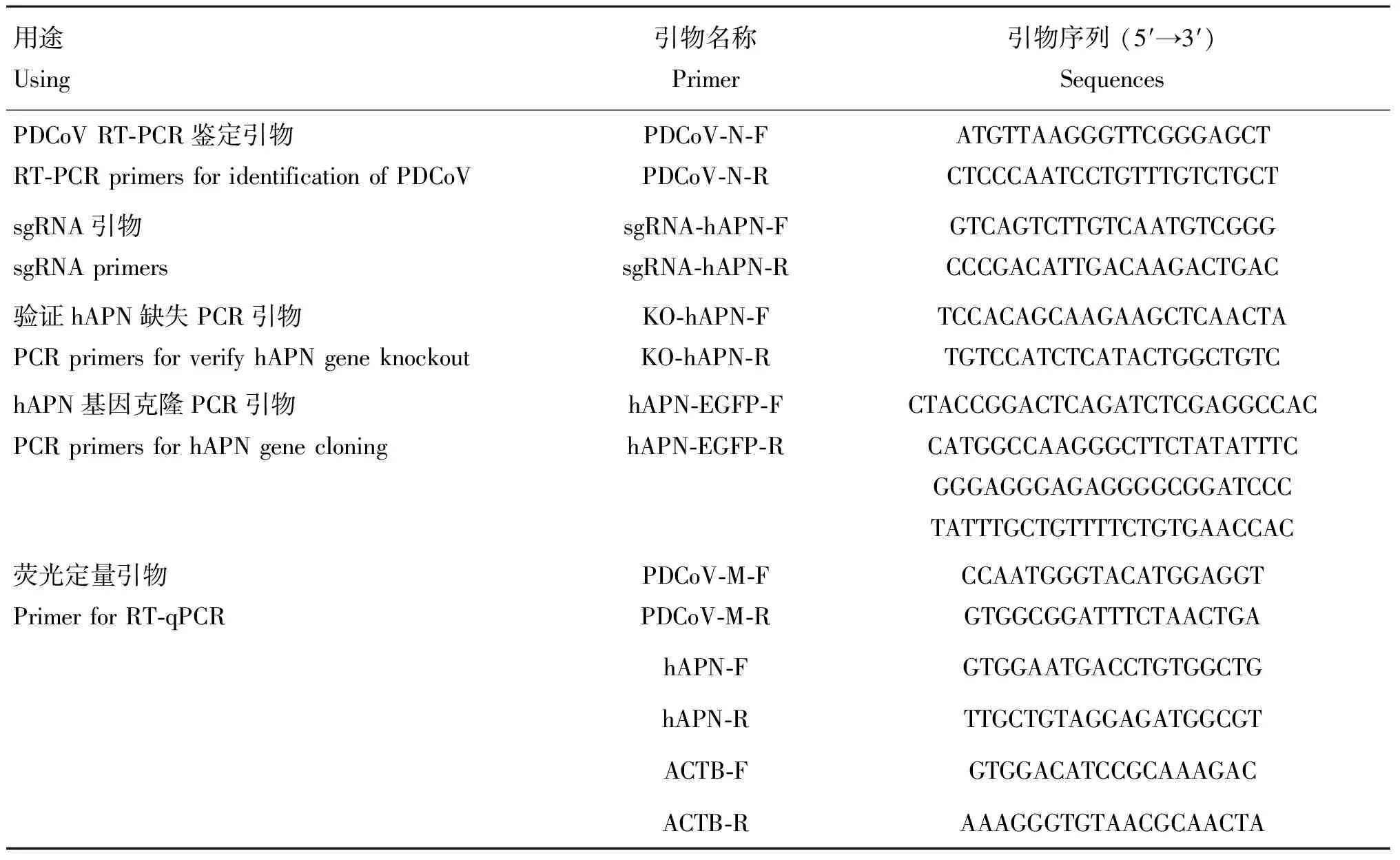
表1 相關引物序列
1.4 細胞活性鑒定
按照10·孔的細胞數將野生型細胞(hAPN)和敲除細胞(hAPN)接種96孔細胞板,24 h后,避光條件下,每孔加入10 μL CCK-8試劑,37 ℃孵育1 h,測定450 nm的吸光度。計算細胞存活率,細胞存活率=[(As-Ab)/(Ac-Ab)]×100%,As:試驗孔(hAPN細胞孔);Ac:對照孔(hAPN細胞孔);Ab:空白孔(培養基)。
1.5 敲除hAPN對PDCoV復制的影響
待60 mm細胞培養皿中hAPN和hAPN長滿單層后,PBS洗2遍,將PDCoV以MOI=0.1的劑量感染細胞,37 ℃孵育1 h,棄病毒液,每孔加入4 mL維持液,于24 h收集細胞懸液和蛋白,細胞懸液用RT-qPCR檢測基因轉錄水平;蛋白樣品用Western blot檢測N蛋白表達水平。
1.6 過表達hAPN對PDCoV復制的影響
針對hAPN基因的CDs區設計引物,經PCR擴增后連接到載體pIRES2-EGFP,構建hAPN過表達真核載體(命名為pIRES2-EGFP-hAPN)。待HEK293細胞長至50%時,用Lipofectamine 3000分別轉染4 μg質粒pIRES2-EGFP和pIRES2-EGFP-hAPN至HEK293細胞;轉染24 h后,觀察綠色熒光蛋白表達情況;收集細胞和細胞蛋白,分別用RT-qPCR和Western blot檢測hAPN表達。以MOI為0.1的PDCoV感染轉染pIRES2-EGFP-hAPN的HEK293細胞,同時設轉染pIRES2-EGFP空載的HEK293細胞為對照,24 h后,收集細胞懸液和蛋白,細胞懸液通過RT-qPCR檢測基因轉錄水平;蛋白樣品通過Western blot檢測N蛋白表達水平。
1.7 同源建模與分子對接
hAPN蛋白(PDB ID:4FYQ)、PDCoV S蛋白(PDB ID:6B7 N)和HCoV-229E S(PDB ID:6U7H)的整體結構從蛋白質數據庫獲取(https://www.rcsb.org)。用SWISS-MODEL(https://swissmodel.expasy.org/)手動構建PDCoV S蛋白和HCoV-229E S蛋白的單體結構和受體結構域(receptor binding domain,RBD),用PyMOL對hAPN、PDCoV S和HCoV-229E S蛋白的三維結構進行可視化分析;用MEGA6、ESPrit 3.0(http://espript.ibcp.fr/ESPript/ESPript/index.php)和PyMOL的align功能對PDCoV和HCoV-229E S蛋白的RBD進行序列和結構比對。用分子對接方法模擬PDCoV S1蛋白與hAPN蛋白的相互作用。
1.8 TCID50測定
取100 μL病毒液,按照10倍梯度進行倍比稀釋,共稀釋7個梯度,每個稀釋度設置8個重復,同時設置空白對照。待96孔細胞板中的ST細胞長滿單層后,PBS洗2遍,加入100 μL稀釋好的病毒液,37 ℃孵育1.5 h,棄病毒液,加入150 μL含5 μg·mL胰酶的維持液,37 ℃繼續培養。每日觀察細胞病變,連續觀察4 d,按照Reed&Muench方法計算TCID。
1.9 統計學分析
2 結 果
2.1 PDCoV在HEK293細胞中的增殖情況
將PDCoV以MOI=0.1感染HEK293細胞,收取0、12、24、36和48 h的樣品,RT-qPCR檢測病毒含量。結果發現,病毒感染細胞12~36 h時,病毒快速增殖,36 h達到頂峰;36~48 h,出現下降趨勢(圖1A);此外,在0~24 h,病毒N蛋白表達水平也迅速增加(圖1C)。將PDCoV在HEK293細胞上連續傳至4代,RT-PCR檢測發現當傳至第3代時,只能檢測到很弱的條帶,而傳至第4代時,檢測不到條帶(圖1B);Western blot 檢測發現,PDCoV傳至2代時,仍可檢測到很弱的病毒N蛋白表達水平(圖1D);TCID結果表明,PDCoV在HEK293細胞上第1代滴度約為4.36 lg TCID·mL,傳至2代時,病毒滴度稍微下降,約為3 lg TCID·mL(圖1E),表明PDCoV可感染HEK293細胞,但是不能在HEK293細胞上穩定傳代。
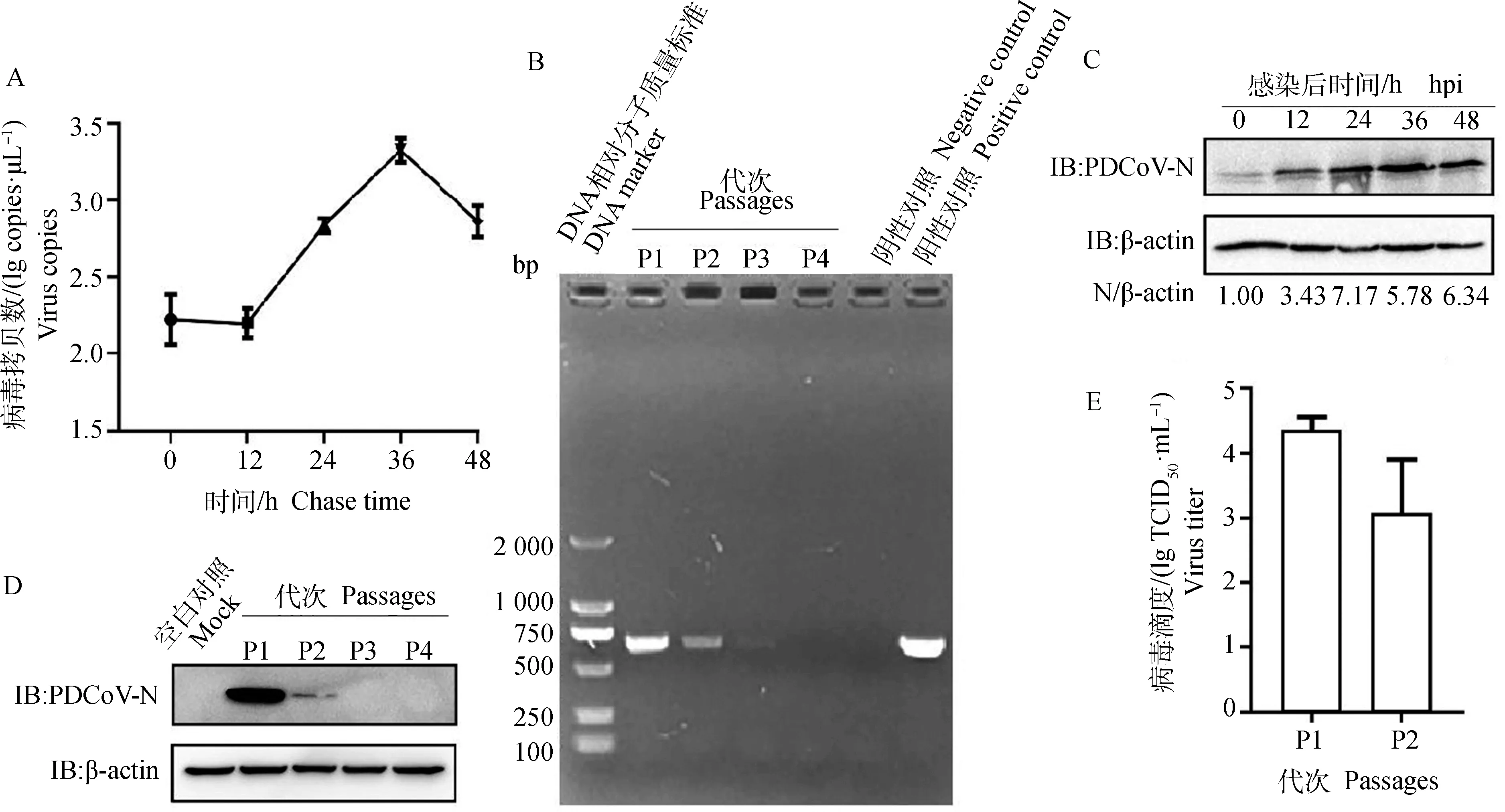
A.RT-qPCR檢測PDCoV在HEK293細胞上的增殖情況;B.RT-PCR檢測PDCoV在HEK293細胞上的傳代;C.Western blot檢測PDCoV感染細胞不同時間點的N蛋白表達水平;D.Western blot檢測PDCoV感染HEK293細胞不同代次的N蛋白表達水平;E.TCID50檢測PDCoV感染HEK293細胞不同代次的病毒滴度
2.2 hAPN基因敲除細胞系的構建和鑒定
用CRISPR/Cas9技術構建hAPN基因敲除細胞系,通過測序、RT-qPCR和Western blot檢測hAPN在HEK293細胞上的敲除情況。測序結果顯示,hAPN細胞系在PAM序列前出現明顯的重疊峰,且存在23個堿基的連續缺失(圖2A);RT-qPCR和Western blot結果顯示,在hAPN細胞上幾乎檢測不到hAPN基因表達(圖2B、C),表明hAPN在HEK293細胞上缺失成功。細胞活性檢測發現,hAPN和hAPN的活性無差異(圖2D),表明敲除hAPN對HEK293細胞活性無影響。
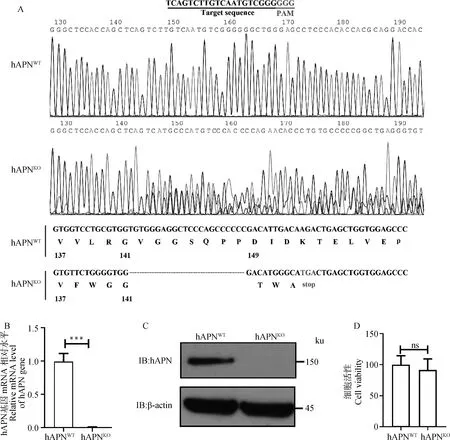
A.hAPNWT和hAPNKO細胞中hAPN基因的序列測定;B.RT-qPCR檢測hAPNKO細胞的hAPN基因mRNA水平(***.P<0.001);C.Western blot檢測hAPNKO細胞的hAPN蛋白表達水平;D.CCK-8檢測hAPNWT和hAPNKO細胞的細胞活性(ns.P>0.05)
2.3 敲除hAPN可降低PDCoV復制
為驗證hAPN敲除對PDCoV復制的影響,將PDCoV以MOI=0.1感染hAPN和hAPN細胞,24 h后,測定基因轉錄水平和N蛋白表達水平。結果表明,hAPN基因敲除后,導致基因mRNA水平下調約75%(圖3 A),N蛋白表達水平下降約66%(圖3 B),證實hAPN敲除能夠顯著抑制PDCoV復制。
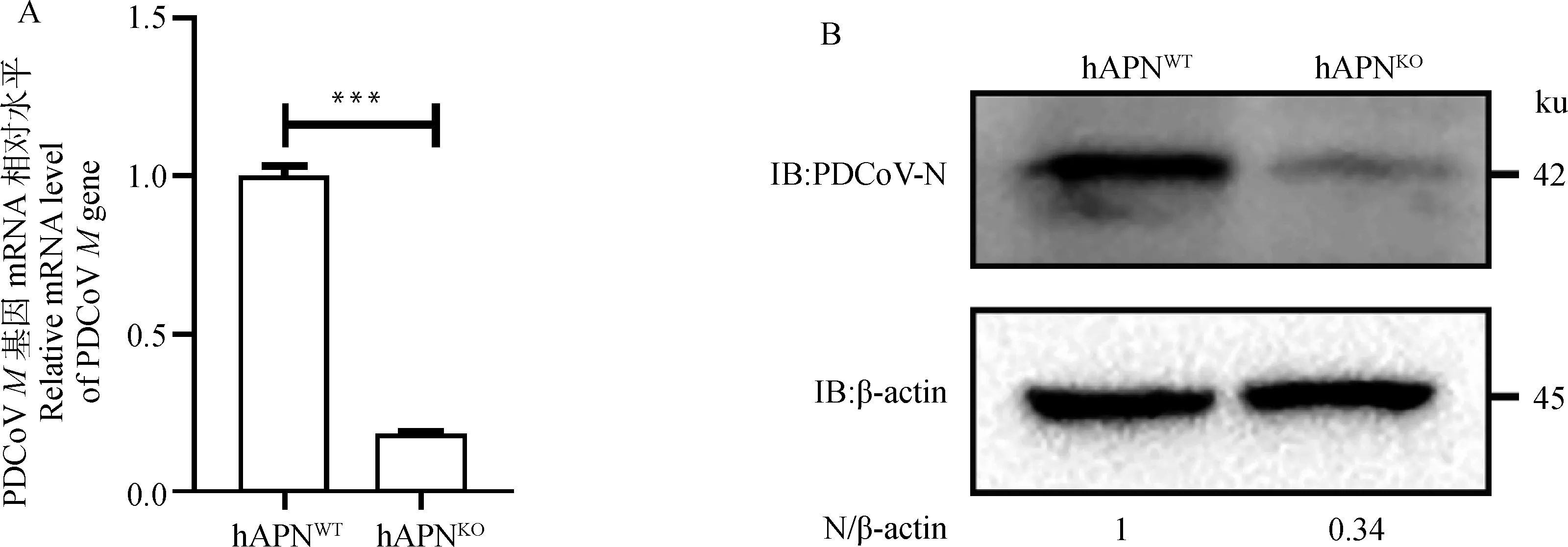
A.RT-qPCR檢測敲除hAPN后PDCoV M基因mRNA水平(***.P<0.001);B.Western blot檢測敲除hAPN后PDCoV N蛋白表達水平
2.4 過表達hAPN可促進PDCoV復制
為進一步驗證hPAN過表達對PDCoV復制的影響,構建hAPN真核表達質粒pIRES2-EGFP-hAPN,轉染至HEK293細胞中,24 h后,可以觀察到明顯的綠色熒光(圖4 A)。RT-qPCR和Western blot檢測發現,hAPN在HEK293細胞中成功表達(圖4 B、C)。將pIRES2-EGFP和pIRES2-EGFP-hAPN分別轉染HEK293細胞24 h后,接種PDCoV,病毒感染24 h后,RT-qPCR和Western blot檢測表明,過表達hAPN導致M基因mRNA水平上調2.7倍,N蛋白表達水平上調1.7倍(圖4 D、E),表明過表達hAPN促進PDCoV復制。
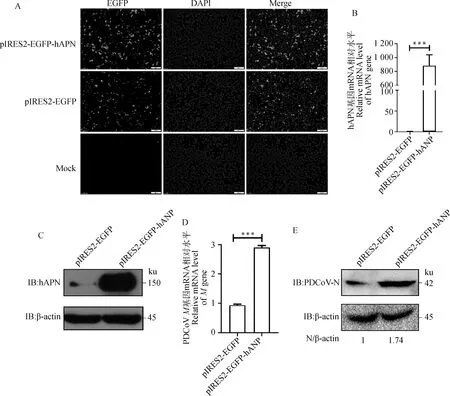
A.熒光顯微鏡觀察綠色熒光蛋白的表達(標尺=100 μm);B.RT-qPCR檢測HEK293細胞轉染pIRES2-EGFP-hAPN后hAPN基因mRNA水平(***.P<0.001);C.Western blot檢測HEK293細胞轉染pIRES2-EGFP-hAPN后hAPN蛋白表達水平;D.RT-qPCR檢測過表達hAPN后M基因mRNA水平(***.P<0.001);E.Western blot檢測過表達hAPN后N蛋白表達水平。掃描文章首頁OSID碼可查看彩圖
2.5 hAPN與PDCoV S蛋白的互作分析
為分析hAPN和PDCoV S蛋白的互作關系,從PDB數據庫獲取hAPN和PDCoV S的三聚體結構(圖5 A、G);PDCoV S蛋白的單體結構及其主要結構域包括C-末端結構域(C-terminal domain,CTD)、N-末端結構域(N-terminal domain,NTD)、融合肽(fusion peptide,FP)、七肽重復序列(heptad repeat,HR)(圖5 B)。HCoV-229E和PDCoV S1 RBD,包含6個β-折疊和3個短而不連續的環組成的受體結合基序(receptor binding motifs,RBM)(圖5 C、D)。序列和結構比對發現PDCoV和HCoV-229E S1 RBD具有相似的空間結構,表明PDCoV RBD與hAPN的結合可能類似HCoV-229E RBD和hAPN的結合(圖5 E、F)。分子對接結果表明,PDCoV S1 RBD能夠結合hAPN結構域Ⅱ,主要是S1蛋白的RBM1氨基酸殘基TYR、THR、THR、PHE和MET通過氫鍵與hAPN的氨基酸殘基PHE、GLN、ARG和SER結合(圖5 G、H)。
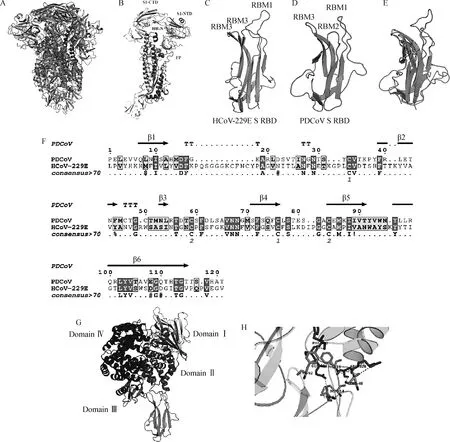
A.PDCoV S 蛋白整體結構;B.PDCoV S 蛋白單體結構;C.HCoV-229E S1 RBD;D.PDCoV S1 RBD;E.HCoV-229E和PDCoV S1 RBD結構比對;F.HCoV-229E和PDCoV S1 RBD序列比對;G~H.分子對接模擬PDCoV S1 RBD和hAPN蛋白的互作。掃描文章首頁OSID碼可查看彩圖
3 討 論
PDCoV是近年來新發現的一種豬冠狀病毒,人工接種PDCoV能夠感染豬、牛、雞和火雞等多種動物。PDCoV感染仔豬后引起明顯的腹瀉癥狀,而感染小雞后腹瀉癥狀較輕,接種PDCoV的小牛甚至未出現腹瀉和其他臨床癥狀。Lednicky等在兒童血清樣品中檢測到變異的PDCoV,首次報道了PDCoV可感染人。鑒于PDCoV在豬群的廣泛流行和跨宿主傳播風險,研究宿主細胞蛋白在PDCoV復制中的作用具有重要意義。過表達hAPN、fAPN、pAPN、cAPN顯著增加細胞對PDCoV的易感性。APN在不同腸段中的差異表達與PDCoV腸道組織嗜性也密切相關。本研究發現敲除hAPN降低PDCoV復制,而過表達hAPN促進PDCoV復制,表明hAPN是影響PDCoV復制的重要宿主細胞因子,豐富了PDCoV跨種傳播和致病機制理論。
S蛋白是冠狀病毒入侵宿主細胞的關鍵蛋白,在病毒感染宿主細胞的過程中,S蛋白構象的變化能促進病毒囊膜與宿主細胞膜的融合。此外,宿主細胞內的酸性環境和蛋白水解酶對S蛋白的活化也是病毒囊膜與宿主細胞膜融合所必需的。胰蛋白酶可通過增強細胞與細胞之間的融合而促進PDCoV增殖,但在病毒入侵細胞的過程中不發揮關鍵作用。此外,PDCoV通過胰蛋白酶介導的細胞膜表面入侵ST和IPI-2I細胞的效率明顯高于內吞體途徑。HEK293細胞是由剪切過的5型腺病毒DNA轉染的人胚腎細胞形成的細胞系,HEK293 T細胞是能夠穩定表達SV40 T抗原的HEK293衍生細胞系。PEDV可以感染HEK293細胞,且與Vero細胞上的增殖特點相似。此外,黃病毒科成員,日本腦炎病毒(Japanese encephalitis virus,JEV)、寨卡病毒(Zika virus,ZIKV)和黃熱病毒(yellow fever virus,YFV)也可感染HEK293T細胞。由于HEK293細胞貼壁能力弱,對胰蛋白酶的耐受程度較弱,本研究在不添加胰蛋白酶的情況下,發現PDCoV可在HEK293細胞至少傳至2代,表明PDCoV可不依賴于胰蛋白酶入侵HEK293細胞。
CRISPR/Cas9系統是新發現的一種基因編輯工具,廣泛應用于研究宿主因子在病毒復制中的作用。近年來,CRISPR/Cas9系統也被應用于篩選調節病毒復制的相關宿主因子。關于APN是否為PDCoV入侵宿主細胞的受體存在爭議。本研究為驗證hAPN在PDCoV毒株CHN-SC2015復制中的作用,通過CRISPR/Cas9技術構建hAPN敲除細胞系,發現hAPN敲除導致PDCoV基因mRNA水平下調約75%,N蛋白表達水平下降約66%。本研究還通過hAPN過表達驗證其對病毒復制的影響,結果發現過表達hAPN可導致PDCoV基因mRNA水平上調2.7倍,N蛋白表達水平上調1.7倍,證實hAPN可明顯促進PDCoV復制。
冠狀病毒S蛋白主要由S1和S2結構域組成,其中S1主要負責識別受體,而S2介導宿主細胞膜與病毒囊膜的融合。有研究表明,冠狀病毒S1 RBD可以與APN結合,介導病毒入侵宿主細胞。HCoV-229E與hAPN的胞外域Ⅱ結合,而TGEV主要與pAPN的胞外域Ⅳ結合。pAPN結構域Ⅶ(581—967 aa)在PEDV復制中發揮重要作用。在PDCoV研究中,Zhu等發現PDCoV S1-CTD蛋白可結合pAPN。本研究通過序列和結構比對發現PDCoV與HCoV-229E S1 RBD具有相似的空間結構,表明PDCoV可能與hAPN結合。因此,本研究通過分子對接方法模擬PDCoV S1 RBD與hAPN的結合,發現PDCoV S1 RBD能夠通過RBM1與hAPN結構域Ⅱ結合。
4 結 論
PDCoV可以感染HEK293細胞,宿主細胞因子hAPN表達可促進PDCoV復制。此外,PDCoV S1 RBD可通過RBM1氨基酸殘基TYR、THR、THR、PHE和MET與hAPN蛋白的氨基酸殘基PHE、GLN、ARG和SER結合,證實了hAPN是影響PDCoV復制的一個重要宿主細胞因子。

