HuR的功能及其對肌肉生長發育的調控作用
孫嚴金,薛亞男,仲 濤,王林杰,李 利,張紅平,占思遠
(四川農業大學 畜禽遺傳資源發掘與創新利用四川省重點實驗室,成都 611130)
肌肉組織是動物機體的重要組成部分,主要包括骨骼肌、心肌和平滑肌,其中骨骼肌約占成年動物體重的40%~60%。肌肉的生長發育是一個極其復雜和精密的過程,受到許多細胞因子和轉錄因子構成的調控網絡共同作用,其中包括生肌調節因子(myogenic regulatory factors, MRFs)家族、肌細胞增強因子2(myocyte enhancer factor 2,MEF2)家族和轉錄調控因子Pax(paired box)家族。近些年的研究表明,非編碼RNA,包括長鏈非編碼RNA(long noncoding RNA, lncRNA)、微小RNA(microRNA, miRNA)和環狀RNA(circular RNA, circRNA)等,參與了肌肉生成的調控網絡。RNA結合蛋白(RNA binding proteins,RBPs)作為細胞生命活動中的重要成員,通過與編碼和非編碼RNA互作,也參與了肌肉生長發育的調控過程。
RNA結合蛋白是細胞中一類重要的蛋白質,它們通過識別特殊的RNA結合域與RNA互作,廣泛參與到RNA剪切、轉運、序列編輯、胞內定位及翻譯控制等多個轉錄后調控過程中,在基因調控過程中扮演著關鍵作用。RNA結合蛋白的結構域包括K同源基序(K homology, KH)、RNA識別基序(RNA recognition motif, RRM)和鋅指結構域(zinc finger domain, ZNF)等。研究表明,RNA結合蛋白通過特異性結合靶mRNA分子3′非翻譯區(UTRs)的順式作用元件,調控靶基因的表達水平,進而參與組織發育、細胞周期及疾病發生等生物學過程。作為RNA結合蛋白家族的重要成員,HuR(human antigen R)蛋白在機體內廣泛表達,通過調控靶基因mRNA的穩定性或翻譯效率影響靶基因的表達水平,從而參與調控細胞的生命活動。本文結合近年來RNA結合蛋白HuR的相關研究,主要綜述了HuR的生物學特性、主要功能與作用方式及其在肌肉生長發育和相關疾病中的調控作用,同時對RNA結合蛋白HuR的今后研究方向進行了展望,以期讓相關科研人員更全面地了解HuR蛋白的研究進展,為進一步研究其在肌肉生長發育調控中的作用提供有力支撐。
1 HuR的生物學特性
RNA結合蛋白HuR是胚胎致死異常視覺(embryonic lethal abnormal vision, ELAV)基因家族成員之一,又被稱為類胚胎致死性異常視覺基因1(ELAV1)。ELAV家族包括HuB、HuC、HuD和HuR 4個成員。HuB、HuC和HuD主要在神經組織中表達,而HuR則是在機體各組織中普遍表達。HuR蛋白編碼基因在人類上位于第19號染色體,小鼠上位于第8號染色體,山羊上位于第7號染色體,編碼的蛋白均由326個氨基酸組成。HuR蛋白含有3個經典的RNA識別結構域,其中RRM1和RRM2結構域可以特異性的結合AU富含元件(AU-rich element, ARE)。RRM3對于穩定RNA-蛋白質復合物以及介導蛋白質-蛋白質相互作用非常重要。RRM2和RRM3之間還含有一個介導HuR進行核質穿梭的鉸鏈區(HuR nuclear shuttle, HNS),HuR的HNS區域含有核定位信號(nuclear localization sequence, NLS)和核輸出信號(nuclear export signal, NES),HuR主要存在于細胞核中,當細胞受到刺激時,HuR的鉸鏈區會發生不同的蛋白修飾,從而促進HuR從細胞核穿梭到細胞質中。
2 HuR的功能與作用方式
大量研究表明,HuR作為基因轉錄后水平的重要調控因子,通過與靶mRNA分子3′末端非翻譯區的ARE元件(AU rich element)結合來發揮其生物學功能,通常是通過提高靶mRNA的穩定性或翻譯效率而上調靶基因在細胞中的表達水平。此外有研究表明,HuR蛋白也可以與非編碼RNA(如miRNA、lncRNA)或其它RNA結合蛋白相互作用,進而參與調控RNA剪接加工、多聚腺苷酸化形成、細胞凋亡等生命活動,以及腫瘤的發生發展等過程(圖1)。
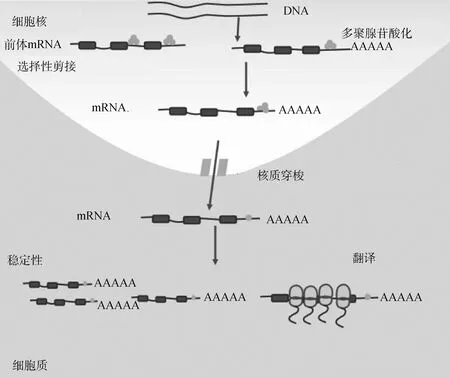
代表RNA結合蛋白HuR
2.1 HuR調控mRNA前體的剪接
研究發現,HuR通過調控剪接因子對mRNA前體內含子或外顯子上剪接位點的識別,進而調節前體mRNA的剪接模式。研究人員發現,TIA-1(T cell intracellular antigen 1)/TIAR(TIA1-related)蛋白與位于降鈣素(calcitonin gene-related peptide, CGPR)外顯子下游富含U的序列相互作用能夠促進降鈣素非特異性形成。HuR能夠阻斷拼接因子TIA-1或TIAR的活性,并與其競爭性地結合到內含子的U富集區域,促使CGRP mRNA前體非神經元外顯子4發生跳躍,致使正常應該產生的肽激素被神經傳遞素所代替。HuR通過改變SIRT1外顯子8周圍組蛋白修飾模式,使RNA聚合酶Ⅱ(RNA polymeraseⅡ, RNAPⅡ)的延伸速率加快,促進SIRT1外顯子8的切除,進而增加缺失SIRT1外顯子8的1 mRNA的表達,而TIA-1/TIAL1通過改變外顯子周圍組蛋白修飾模式,使RNAPⅡ的延伸速率減慢,促進SIRT1外顯子8的保留,使缺失SIRT1外顯子8的1 mRNA的表達降低。此外有研究表明,HuR蛋白還能夠發揮剪接增強子作用,結合HuD外顯子6下游的兩個AU元件,促進mRNA外顯子6插入。
2.2 HuR影響多聚腺苷酸化的形成
研究證明,HuR能夠選擇性結合到靶mRNA的U富集區,影響靶mRNA的poly(A)形成,進而影響靶mRNA多聚腺苷酸化的修飾過程。多聚腺苷酸化需要兩步反應,包括裂解和新生成的3′端上加poly(A)尾巴。這兩步需要切割刺激因子(cleavage stimulation factor, CstF)和多聚腺苷酸特異性因子(cleavage and polyadenylation specificity factor, CPSF)的參與,而HuR蛋白能夠與多聚腺苷酸化這兩個特異性因子(CstF、CPSF)競爭性結合富含U的序列,從而阻斷了mRNA的多聚腺苷酸化形成。
2.3 HuR調控mRNA的穩定性
研究發現,在人的心肌細胞中,HuR蛋白能夠識別并結合2C基因的ARE序列,增加其mRNA穩定性,從而促進了心臟鈉通道基因(cardiac sodium channel gene,5A)的轉錄。另外,HuR還可以通過與miRNA、lncRNA或circRNA相互作用調控靶mRNA的穩定性。環狀RNA circE2F2(circRNA transcription factor 2, circE2F2)與HuR蛋白結合能夠促進HuR結合在E2F2的3′UTR,進而增加E2F2的mRNA穩定性。研究表明,circDLC1可以與MMP1競爭結合HuR,通過降低MMP1的穩定性,進而抑制MMP1的表達,最終抑制肝癌細胞的增殖和遷移。食管鱗狀細胞癌相關研究發現,HuR通過與miR-4319競爭性結合SEMA4D,增強SEMA4D的穩定性,從而調節食管癌細胞的增殖、凋亡和遷移。當HOTAIR泛素化底物的水平較低時,HuR會優先與HOTAIR結合,并通過募集let-7-Ago2(argonaute RISC catalytic component 2)復合物來降低HOTAIR的穩定性。此外,HuR自身的蛋白修飾也可以影響靶mRNA的穩定性。HuR蛋白的磷酸化能夠影響其對應激蛋白1(stress-response protein)mRNA穩定性的調節,細胞周期檢查點激酶(checkpoint kinase 2, Chk2)對HuR進行磷酸化的修飾,抑制了HuR與1 mRNA的結合。在人類肝細胞癌的研究中發現,ADORA2A-AS1與肌動蛋白束蛋白(fascin actin-bundling protein 1, FSCN1)轉錄物競爭性結合HuR,通過影響FSCN1的穩定性來降低FSCN1的表達,從而阻斷了AKT通路的激活,最終抑制腫瘤的發生。此外有研究表明,LINC01119能夠與HuR相互作用,形成LINC01119-HuR復合物,進而與腦源性神經營養因子(brain-derived neurotrophic factor,)mRNA結合,增強其穩定性,提高BDNF在轉錄和蛋白水平的表達,促進神經性疼痛(neuropathic pain, NP)的發生。研究人員發現,LINC00668通過招募HuR增強蛋白激酶N2(protein kinase n2,PKN2)的穩定性,從而促進胃癌的轉移。
2.4 HuR調控mRNA的翻譯
有研究表明,HuR通過結合靶mRNA的3′UTR富含AU的ARE區,調節靶mRNA的翻譯效率,進而參與細胞生命活動。在人類小腸上皮細胞中,HuR可以結合微囊蛋白1(caveolin-1, Cav-1)的3′UTR區調節Cav-1 mRNA的翻譯,從而促進早期小腸上皮的恢復。另外研究發現,HuR也可以與靶基因的5′UTR結合來調控翻譯。HuR可特異性地結合到細胞周期素依賴性激酶抑制因子p27mRNA的5′UTR序列中的內部核糖體進入位點(internal ribosome entry site, IRES),抑制p27的翻譯。相關研究發現,真核細胞翻譯起始因子(eukaryotic translation initiation factor 3, EIF3)與HuR相互作用結合在1 mRNA的3′UTR上,正向調節1 mRNA的翻譯,從而調控細胞周期進程。此外有研究表明,HuR可以招募miRNA let-7(RNA-induced silencing complex, RISC)結合在-mRNA的3′UTR,進而抑制-mRNA下調。
研究發現,HuR還可以與非編碼RNA互作,調控靶mRNA的翻譯。小鼠上研究發現,過表達的miR-195能夠與HuR競爭性結合雙皮質素樣激酶1(double cortin-like kinase 1, DCLK1)的3′UTR并抑制DCLK1的翻譯,進而破壞腸絨毛細胞的功能。HuR也能與程序性細胞死亡因子4(programmed cell death 4, PDCD4)的3′UTR相互作用,阻止miR-21介導的PDCD4翻譯抑制。Abdelmohsen等研究發現,環狀多聚腺苷酸結合蛋白核1(circle poly(A)binding protein nuclear 1, PABPN1)能夠與HuR蛋白結合,并抑制HuR蛋白與1基因mRNA的結合能力,從而抑制其翻譯。在肺癌研究中發現,circBACH1通過促進HuR的核質易位,進而抑制p27的翻譯,促進肝癌細胞增殖。此外,在人類癌癥細胞的研究中發現,circAGO2能夠與HuR蛋白相互作用,促進其在促癌相關靶基因3′UTR的富集,從而減少HuR與AGO2的結合,抑制AGO2/miRNA介導的腫瘤進展相關的基因沉默。在小鼠研究中發現,CircPABPN1競爭性結合HuR,阻斷了其與ATG16L1的結合,抑制ATG16L翻譯,從而調節腸上皮細胞自噬。
3 HuR調控肌肉生長發育及相關疾病的研究
3.1 HuR通過影響mRNA的穩定性參與調控肌生成
近些年來的研究表明,RNA結合蛋白HuR能夠與編碼或非編碼RNA相互作用參與肌肉生長發育以及肌肉疾病的發生,其中研究較為廣泛的作用機制是HuR通過調節靶基因mRNA穩定性參與肌肉生長發育的調控(表1)。在分化的肌肉細胞中,RNA結合蛋白HuR能夠識別結合肌源性調節因子(p21、MyoD、MyoG和MyHC)的3′UTR的ARE序列,增加其mRNA穩定水平,進而促進肌肉分化。另外,研究人員還發現,HuR蛋白可以結合并穩定成肌細胞增殖的關鍵細胞周期控制因子CCND1,而Pitx2(paired like homeodomain 2)介導了HuR和CCND1之間的相互結合作用,在肌肉分化過程中,Pitx2被磷酸化,復合體Pitx2/HuR/CCND1解離,導致CCND1不穩定,引起細胞周期停滯,最終促進肌肉分化。此外有研究表明,在未分化的肌肉細胞中,HuR位于細胞核中,當肌肉細胞分化開始后,細胞質中的HuR增加,當細胞分化結束后,HuR重新回到細胞核,HuR在細胞核質的表達量的變化與肌源性調節因子的核質表達量相一致,表明HuR的核質穿梭與肌生成的調控密切相關。在成肌細胞融合過程中,半胱天冬酶發揮作用,使10%~15%的HuR被裂解為HuR-CP1(HuR-cleavage product 1, 24 ku)和HuR-CP2(HuR-cleavage product 2, 8 ku)兩個片段。在小鼠C2C12成肌細胞分化過程中,HuR-CP1表達增加,并與HuR導入因子轉運蛋白-2(HuR-import factor transportin-2,TRN2)結合,阻止TRN2介導完整的HuR分子進入細胞核,從而增加細胞質中HuR表達量,通過調節成肌基因mRNA的穩定性來促進肌肉生成。
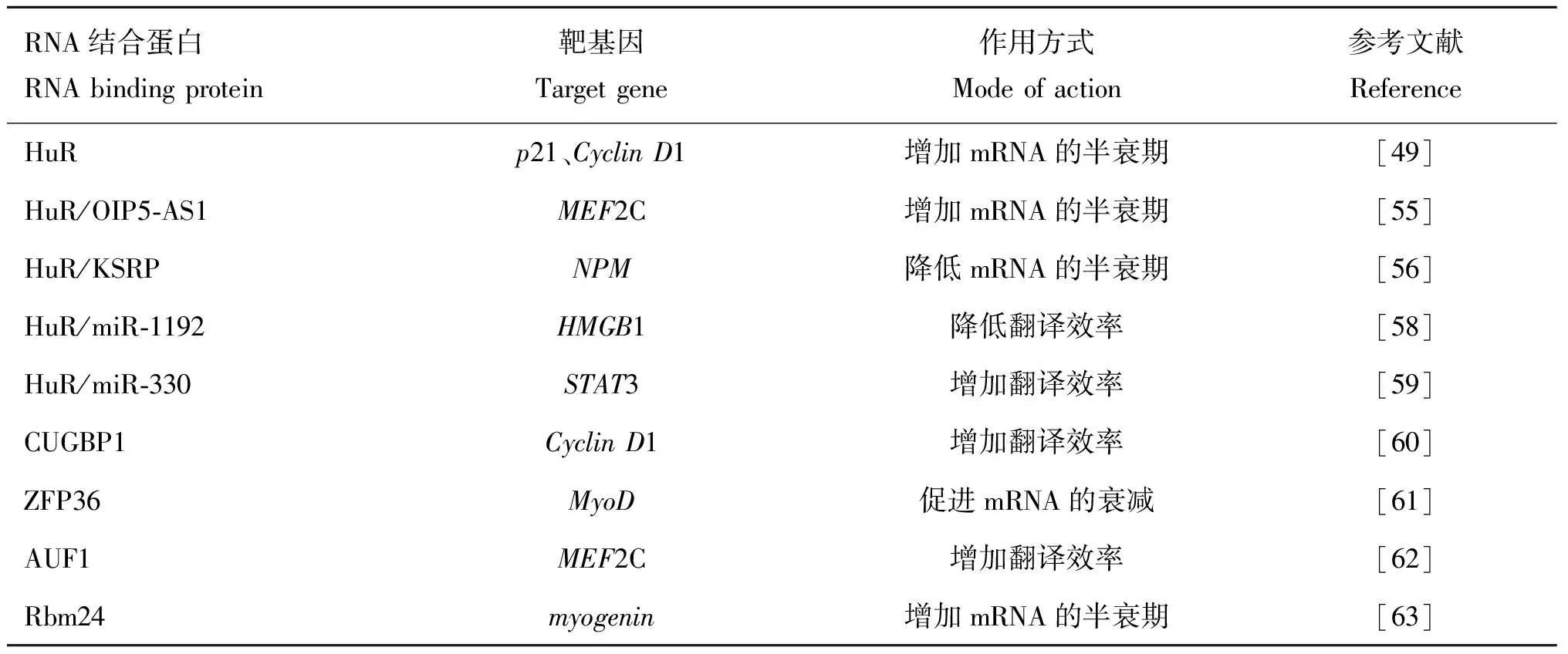
表1 RNA結合蛋白調控肌肉生長發育的靶基因及作用方式
Lv等在小鼠、豬和人中鑒定了一個新的促進肌肉生長的lncRNA——lncMGPF(lncRNA muscle growth promoting factor),該lncRNA主要通過兩方面調控肌生成,一是作為miR-135a-5p分子海綿,增加肌細胞增強因子2C(MEF2C)表達;二是通過調控HuR蛋白裂解促進HuR由細胞核到細胞質的遷移,增強HuR介導的肌源性調節基因、等mRNA的穩定性,進而提高肌細胞分化能力。有研究還發現,lncRNA-OIP5-AS1能夠結合肌細胞增強因子MEF2C的3′UTR區域,增強MEF2C的穩定性,從而促進MEF2C的表達,其作用方式是,lncRNA-OIP5-AS1作為一個“分子支架”,招募RNA結合蛋白HuR結合到MEF2C的3′UTR,促進MEF2C的表達,從而促進成肌分化過程。此外,有研究表明HuR還可通過與其它RNA結合蛋白相互作用參與調控肌肉生長發育。在肌肉發生早期,HuR和KSRP(KH-type splicing regulatory protein)以復合體的形式被募集到細胞周期啟動子核磷蛋白(nucleophosmin,)mRNA的3′UTR區域,而HuR/KSRP復合體可以招募兩種核糖核酸酶,多聚腺苷酸特異性核糖核酸酶(poly(A)specific ribonuclease, PARN)和EXOSC5(exosome component 5),降低mRNA的穩定性,進而促進肌肉纖維的形成。Legnini等研究發現,Linc-MD1作為miR-133b的宿主轉錄本,其在肌肉分化早期階段表達。一方面,Linc-MD1能夠與HuR蛋白結合并抑制Drosha酶作用,進而抑制miR-133合成來促進Linc-MD1的積累。另一方面,Linc-MD1又能作為miR-133的分子海綿,正向調控HuR蛋白的表達。此外,HuR蛋白可以與募集的miRNA協同來加強Linc-MD1的分子海綿活性,HuR和Linc-MD1之間形成的正向調控回路最終促進了肌肉的分化。
3.2 HuR通過解除miRNA介導的靶基因翻譯抑制參與調控肌生成
RNA結合蛋白HuR除了調節mRNA的穩定性,還可以通過解除miRNA介導的靶基因翻譯抑制參與調控肌生成。研究發現,miR-1192可以結合到高遷移率族蛋白1(high mobility group box 1,1)mRNA的3′UTR,抑制HMGB1的翻譯進而阻止肌生成過程,而HuR蛋白可以靶向結合HMGB1 3′UTR的miRNA結合位點鄰近區域,阻止AGO2/miR-1192復合物的形成,從而解除miR-1192介導的翻譯抑制,促進了肌生成。研究表明,在癌癥動物模型中,骨骼肌組織中STAT3(signal transducer and activator of transcription 3)的異常激活是導致肌肉萎縮的原因之一,而在炎癥誘導的肌肉萎縮過程中,研究人員發現,HuR蛋白可以結合STAT3的3′UTR富含U的序列,阻止miR-330介導的STAT3翻譯抑制,促進STAT3蛋白質的翻譯,影響肌肉的發育。
3.3 HuR調控肌肉發育相關疾病
研究發現,RNA結合蛋白HuR還參與肌肉發育相關疾病的調節過程,包括先天性肌強直綜合征和肌肉萎縮等。有研究表明,Q膠原蛋白(cooh-terminal collagen Q, COLQ)的突變會導致先天性肌強直綜合征并伴隨乙酰膽堿酯酶的缺失,而HuR在COLQ突變引起的先天性肌強直綜合征中,起著穩定乙酰膽堿酯酶的作用,具體機制是當Q膠原蛋白缺失后,HuR能夠識別并結合乙酰膽堿受體亞單位的3′UTR,增加其穩定性,促進其表達。另外研究發現,HuR蛋白參與調控由癌癥惡病質引起的肌肉萎縮,HuR特異性敲除可以促進小鼠Ⅰ型纖維的富集,進而使其免受癌癥誘導的肌肉萎縮,過氧化物酶體增殖物激活受體γ共激活因子-1(peroxisome proliferator-activated receptor γ coactivator-1, PGC-1)是過氧化物酶體增殖物激活受體PPARγ(peroxisome proliferator-activated receptor γ, PPARγ)的轉錄共激活因子,HuR通過與mRNA衰減因子KSRP互作調節-1 mRNA的穩定性,降低PGC-1的表達,進而抑制Ⅰ型肌纖維的形成,促進Ⅱ型肌纖維的形成,表明HuR可以通過促進糖酵解型肌纖維的形成,參與調節骨骼肌纖維類型。多聚腺苷酸結合蛋白核1(polyadenylate binding protein nuclear 1,1)基因第一外顯子突變能夠導致肌肉特異性疾病——眼咽型肌營養不良(oculopharyngeal muscular dystrophy, OPMD),研究人員利用小鼠體內外模型研究發現,HuR蛋白能夠識別并結合PABPN1 3′UTR的ARE序列,負向調控PABPN1的mRNA與蛋白水平,這一結果為以后研究OPMD治療策略提供了參考。
4 展 望
近年來,RNA結合蛋白與非編碼RNA互作調控肌肉生長發育成為肌肉生物學研究新的焦點之一,作為機體內表達最廣泛的RNA結合蛋白,HuR的生物學功能及在肌生成與肌肉疾病發生過程中的作用機制也逐漸被報道,其主要通過影響靶mRNA的穩定性和翻譯參與調控肌肉生長發育及肌肉疾病的發生。但是,目前關于HuR的功能研究主要集中在模式動物上,畜禽動物上HuR的功能和作用機制尚未闡明。近些年,隨著功能性非編碼RNA不斷被發掘,RNA結合蛋白和非編碼RNA互作的調控機制研究也會越來越多。通過開展RNA結合蛋白及其與非編碼RNA互作調控肌肉生長發育的相關研究,能夠進一步完善肌肉生成分子調控網絡,深化對肌肉生長發育潛在分子機制的認識,并可能為肌肉發育相關疾病的治療提供新的思路和應對策略。

