多發性骨髓瘤病人椎體壓縮性骨折風險預測模型構建分析
孫輝 王碧薇 崔澤軍
多發性骨髓瘤(multiple myeloma,MM)由單克隆丙種球蛋白病(MGUS)演變而來[1],MGUS作為惡性前期,沒有相關的骨髓浸潤(<5%漿細胞),也沒有骨骼事件,在80%的MM病人中發現彌漫性和(或)局灶性溶骨性破壞以及骨質疏松,這些變化導致骨折的高發病率,其中椎體壓縮性骨折最常見[2-3]。預測即將發生椎體壓縮性骨折的風險,是決定是否進行手術治療、化療等治療的關鍵。除年齡、性別、體質量指數(BMI)等基礎資料外[4-5],幾項研究提出了通過測量局灶性侵蝕的數量或范圍來預測骨折的方法,并表明雙能X線吸收法測定的骨密度可預測MM的股骨、髖部骨折風險和治療反應[6-7],但這些因素是否能成為預測椎體壓縮性骨折的可用數據仍值得探究。本研究從病人基本特征和椎體特定因素出發,試圖構建椎體壓縮性骨折風險的預測模型,為早期采取針對性處理措施提供理論依據。
對象與方法
一、對象
我院2017年4月~2021年1月收治的MM病人114例。納入標準:(1)符合MM診斷標準[8],經組織活檢證明有漿細胞瘤或骨髓涂片檢查中漿細胞比例>30%,伴有形態改變;(2)肝、腎功能正常;(3)具有較完整的臨床資料。排除標準:合并其他部位腫瘤;合并代謝性骨病;合并單抗遺傳病;合并骨質疏松;因創傷所致的椎體壓縮性骨折。專門人員收集病人一般資料,對數據進行平行雙錄入。經我院倫理委員會批準,病人及家屬均簽署知情同意書。
二、方法
1.預測模型構建及驗證:(1)建模:收集一般資料,對骨折風險行單因素和多因素分析,篩選與骨折有關的因素進行多因素Logistic回歸分析:將篩選后各獨立因素繪制風險預測模型的列線圖;(2)模型驗證:采用Bootstrap抽樣法重復抽樣1 000次,繪制校準曲線并計算C-index及95%置信區間。
2.治療方案:參考中國多發性骨髓瘤診治指南(2015年版)予以治療,包括含蛋白酶體抑制劑、免疫調節藥物、細胞毒藥物的誘導、鞏固和維持治療。以硼替佐米/環磷酰胺/地塞米松(VCD)、來那度胺/硼替佐米/地塞米松(RVd)、硼替佐米/阿霉素/地塞米松(PAD)和硼替佐米/沙利度胺/地塞米松(VTD)為主。
3.資料采集:治療前收集病人一般資料如年齡、性別、病程、BMI、DS 分期、免疫分型(IgA、IgG、輕鏈型)、骨折節段(單節段、多節段)、骨折部位(胸段、腰段)、骨髓漿細胞比例及脊柱腫瘤脊椎不穩評分(SINS)。
4.實驗室及影像學資料:抽取空腹肘靜脈血5 ml,采用全自動化血細胞分析儀(DxH 600型)檢測血紅蛋白(Hb)、血清白蛋白(ALB);采用LB-CA-1 鈣離子測定儀測定血清鈣水平;采用邁瑞BS-280型生化分析儀檢測血清β2- 微球蛋白(β2-MG)、血肌酐(Scr)水平。采用全身螺旋CT掃描儀(西門子 Definition AS40CT)進行軸位掃描,設置參數層厚5mm,增強掃描靜脈注射非離子型含碘對比劑,流速2.5 ml/s,基于最大可能感興趣區域測量Hounsfield單位(HU)的CT衰減。
5.隨訪及椎體壓縮性骨折診斷標準:隨訪觀察3個月,于門診定期復查,截止2021年5月1日,根據中國多發性骨髓瘤診治指南(2015年版),經MRI、CT或X線片檢查,任何椎體高度損失20%定義為椎體壓縮性骨折。
三、統計學處理

結果
1.椎體壓縮性骨折發生情況:截止末次隨訪時間2021年5月1日,44例發生椎體壓縮性骨折,70例未發生椎體壓縮性骨折,椎體壓縮性骨折發生率為38.60%。
2.臨床資料比較:骨折組和未骨折組性別、年齡、病程、免疫分型、DS分期、化療方案、骨折節段、骨折部位比較差異無統計學意義(P>0.05),骨折組和未骨折組BMI、骨髓漿細胞比例、SINS評分比較差異有統計學意義(P<0.05)。見表1。

表1 兩組病人一般資料比較
3.實驗室及影像學指標對比:骨折組和未骨折組血清β2-MG、Scr、血清鈣、ALB、Hb比較差異無統計學意義(P>0.05),骨折組和未骨折組HU值比較差異有統計學意義(P<0.05),見表2。

表2 兩組實驗室指標急影像學指標比較
4.椎體壓縮性骨折風險多因素Logistic回歸分析:以是否發生椎體壓縮性骨折作為因變量(骨折=1,未骨折=0),將上述差異有統計學意義的變量作為自變量進行Logistic回歸分析,變量篩選采用逐步法(α入=0.05,α出=0.1);多因素Logistic分析顯示,高BMI(OR=0.464,95%CI 0.293~0.735)、高HU值(OR=0.966,95%CI 0.949~0.984)為骨折的保護因素,高SINS(OR=1.285,95%CI 1.111~1.487)、骨髓漿細胞比例大(OR=1.078,95%CI 1.025~1.133)為骨折的危險因素(P<0.05),見表3~4。

表3 椎體壓縮性骨折風險Logistic分析的賦值表
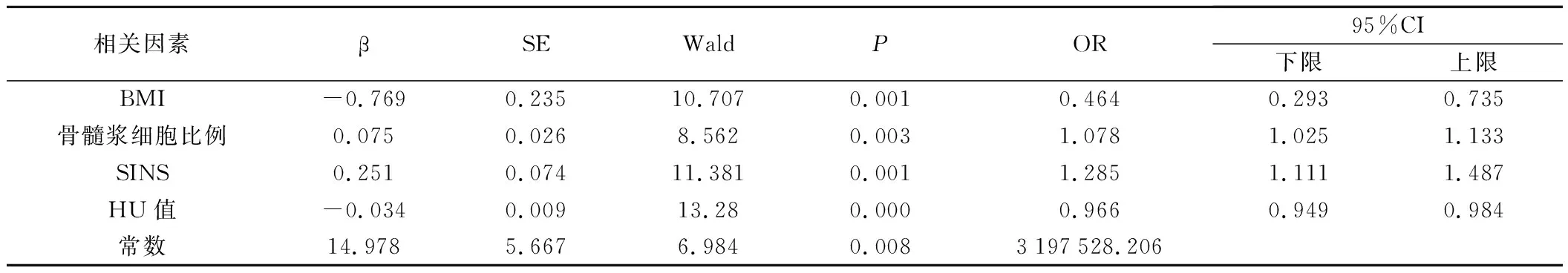
表4 椎體壓縮性骨折風險多因素Logistic回歸分析
5.椎體壓縮性骨折風險列線圖模型的構建與評估:將影響MM病人椎體壓縮性骨折風險的獨立相關因素納入列線圖模型,預測骨折相關因素的C-index為0.913(95%CI 0.863~0.963),校正曲線顯示觀察與實際預測情況一致性好。見圖1~2。
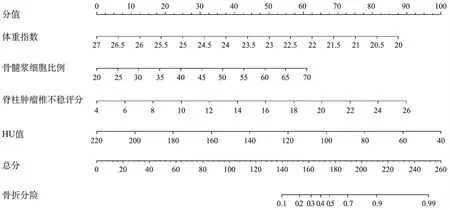
圖1 椎體壓縮性骨折預測列線圖
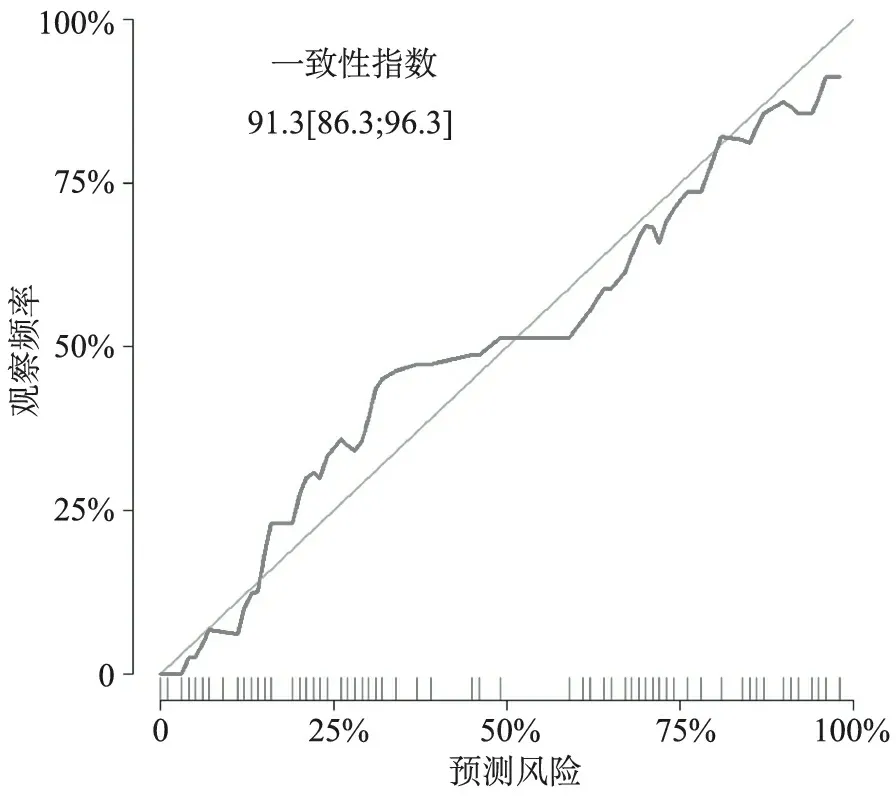
圖2 椎體壓縮性骨折預測模型校正曲線
討論
MM在疾病進展過程中會出現骨質破壞,且骨質破壞可發生在疾病的整個病程中,這種病理機制與破骨細胞及成骨細胞造成的骨質代謝失衡有關[9]。MM病人在發病過程易出現骨相關事件,其中以椎體壓縮性骨折較為常見[10]。椎體壓縮性骨折可引起嚴重背痛、脊柱不穩、新骨折風險增加、神經功能障礙和身體癥狀惡化。有研究證實,椎體壓縮性骨折的發生風險與顯著死亡率相關[11]。目前的治療雖然能使病人獲益,但這些治療主要集中于緩解癥狀和防止骨折進展,但在脊柱不穩定的早期跡象開始時,獲得最佳的功能結果,可能有助于提高這些治療的成功率。預測MM骨折風險模型中,有研究多集中于對MM所致的長骨骨折探討,并表明PET/CT影像學預測、較大的損傷尺寸及較長的病變潛伏期等變量制定新的評分系統可有效預測[12]。少量研究對MM椎體壓縮性骨折進行預測,認為病人的特征,如年齡、性別、BMI是MM椎體壓縮性骨折的預測因子[12-13]。
和既往研究不同的是,我們并未發現在年齡、性別方面的差異,雖然并非所有研究都發現年齡、性別方面與骨折間的這種聯系,但普遍認為,女性、年長患有椎體壓縮性骨折的風險更高[14-15]。Zijlstra 等[16]研究發現,男性病人患椎體壓縮性骨折風險增加,出現這一情況的原因可能在于該研究中男性病人占比70.99%,本研究納入男女占比較為均衡,故未出現這一情況。在年齡方面也未體現出差異,可能與樣本量少和觀察時間短有關。有研究指出,相較于高BMI者,低BMI者更容易發生骨折[17];20 kg/m2的BMI者與25 kg/m2的BMI者相比在骨質疏松或髖部骨折的發生率明顯增加[18],也有文獻在報道,椎體骨折與BMI下降10個單位有關[19]。本研究中,BMI作為預測因素也被確定,但沒有明確機制解釋BMI與骨折發生間的關系,我們認為,高BMI是骨量的保護因素,脂肪組織具有使雄激素芳香化為雌激素的作用,使外周脂肪組織中睪酮轉化為雌二醇、雄烯二酮轉化為雌酮,雌二醇和雌酮分泌則可刺激成骨細胞分泌IGF-1,刺激成骨細胞活性,增加骨密度,同時高BMI者骨所承受的機械負荷增加,可促進骨形成,減少骨吸收,以降低椎體壓縮性骨折發生幾率。
MM起源于紅骨髓,其典型的病變特征為骨髓內異常漿細胞的增生。漿細胞又稱之為效應B細胞,是機體免疫系統的重要組成部分,承擔著應答抗原刺激和合成、分泌抗體(免疫球蛋白)的重要功能。骨髓漿細胞比例已被證實為MM療效的評估和監測指標之一[20]。有研究顯示, 骨髓瘤漿細胞可通過產生脂肪酸和生長因子,改變破骨細胞功能而導致骨質疏松性骨折發生[21];有研究顯示,與骨髓漿細胞比例≥10%的MM病人比較,骨髓漿細胞比例小于10%的病人腫瘤負荷更低,中位生存期也顯著延長[22]。本研究顯示,骨髓漿細胞比例可預測椎體壓縮性骨折發生,這與骨組織受到破壞有關。
脊柱的穩定性是脊柱保持運動程度的能力,腫瘤導致的脊柱不穩定性主要是骨結構破壞,這與退行性、創傷性脊柱不穩定有很大區別。一項薈萃分析顯示,SINS可預測椎骨切除術后惡性腫瘤的療效和生存率[23];Amelot 等[24]研究證實,術前脊柱不穩定性是MM術后生存的預測因素。本研究顯示,SINS評分對椎體壓縮骨折的預測具有一定價值。MM直接破壞骨質導致脊柱剛性降低,加之MM一般為多節段受累,更有可能發生脊柱不穩或者在原來存在脊柱退行性不穩的基礎上又增加了腫瘤相關的不穩定。
在影像學方面,多項研究利用CT的HU值評估骨密度及其在評估骨折風險中的效用,且被認為是一種簡單、實用和可靠的技術[25]。先前的一項研究報道了普通人群胸椎和腰椎的HU值,并表明HU值隨著年齡的增長而降低,并且這種降低在更多的尾骨椎體中比例更大[26];Muchtar 等[27]研究證實,低BMI或低HU值)與較高的骨折風險相關。本研究中,HU評分較低的椎體壓縮性骨折發生率更高,但風險比僅為0.966。與骨質疏松癥病人比較,骨密度測定在評估MM病人骨折風險方面的診斷價值有限。因此,放射科醫生關于即將發生骨折的風險的陳述對轉診臨床醫生特別重要,以便決定是否進行額外的外科治療、椎體成形術、藥物干預或放射治療。另外,構建的列線圖預測模型顯示,上述因素預測骨折的C-index為0.913(95%CI 0.863~0.963),進一步說明上述因素的預測價值。
綜上所述,由BMI、HU值、骨髓漿細胞比例、SINS因素構建的MM病人椎體壓縮性骨折風險模型具有較高的預測價值。本研究也存在一定不足,在影像學方面,僅關注基于CT椎體壓縮性骨折預測因素,無法詳細獲取與MM病人溶骨病變的位置、大小和形狀以及周圍骨組織質量相關的生物力學結構變化,未來的前瞻性研究可通過對骨結構和骨強度的復雜測量,如有限元分析技術,以多種方式改進臨床評估,其次樣本量相對較少,未對椎體壓縮性骨折部位分別構建預測明顯,可能導致研究結果出現一定的偏差,考慮到MM是一種異質性疾病,如何通過研究將現有的骨折風險因素有機結合起來,準確選擇個性化治療方案,仍是今后進一步努力研究的方向。

