農桿菌介導的MsDUF基因轉化紫花苜蓿的遺傳轉化體系建立及優化
安明珠 馬向麗 周凱 段新慧 姜華 韓博




摘要:為建立適宜MsDUF基因轉化紫花苜蓿的遺傳轉化體系,本試驗在已知的紫花苜蓿再生體系的基礎上,采用農桿菌介導法,以保定紫花苜蓿(MedicagosativaL.cv.Baoding)下胚軸和子葉為轉化受體,將MsDUF基因導入到紫花苜蓿中,通過對愈傷誘導、分化及生根培養階段抗生素濃度的篩選建立了優化的遺傳轉化體系,同時對篩選獲得的轉基因紫花苜蓿進行PCR和RT-PCR檢測。結果表明,農桿菌介導的MsDUF基因遺傳轉化的最佳條件為:將預培養2d的紫花苜蓿下胚軸用含pCAMBIA1301-MsDUF質粒的農桿菌菌液(OD600為0.3~0.5)侵染10min,共培養暗處理2d后轉入含30mg/LHyg和500mg/LCef的愈傷誘導培養基和分化培養基上誘導分化,待抗性芽長到2~3cm高時轉入含30mg/LHyg和300mg/LCef的生根培養基上,得到6株經PCR檢測為陽性的抗性植株;選取5株進行RT-PCR檢測,均檢測出大小與目的條帶相吻合的清晰條帶,證明MsDUF基因已成功轉入保定紫花苜蓿中。本試驗成功建立了農桿菌介導的高效MsDUF基因轉化紫花苜蓿的遺傳轉化體系,為進一步研究MsDUF基因功能奠定了基礎,同時為紫花苜蓿育種和種質創新提供了基礎材料。
關鍵詞:紫花苜蓿;MsDUF基因;農桿菌介導;遺傳轉化體系;PCR檢測;RT-PCR檢測
紫花苜蓿(MedicagosativaL.)是世界上重要的優質豆科牧草之一,具有營養價值豐富、產量高、適口性好等優點[1,2],主要集中在我國西北干旱、半干旱及鹽堿地區種植[3,4]。紫花苜蓿不僅是一種重要的經濟飼料作物,還是一種很好的水土保持植物,在畜牧業可持續發展和環境改善等方面具有重要作用[5]。
紫花苜蓿的遺傳轉化率較低,易受多種因素的影響,例如外植體材料、植物激素、抗生素濃度等[6-8]。穩定的遺傳轉化體系是提高紫花苜蓿遺傳轉化率及產量的前提[9]。Deak等[10]在1986年首次對紫花苜蓿進行轉基因改良,建立了紫花苜蓿遺傳轉化體系。此后,研究人員在此基礎上進一步優化遺傳轉化體系,以期能夠獲得較高的轉化率,提高紫花苜蓿的耐性[11,12]。He等[13]研究4個苜蓿品種的再生能力時,通過改變植物生長調節劑的濃度,進一步改良用于遺傳轉化的再生體系。李晶等[14]采用下胚軸作為轉化受體,利用不同濃度潮霉素對轉化植株進行篩選,建立了一個農桿菌介導的紫花苜蓿smt1富硒基因遺傳轉化體系,為富硒苜蓿新品種選育奠定了基礎。薛曉峰[15]通過對紫花苜蓿遺傳轉化條件進行完善,將SeNHX1鹽角草逆向轉運蛋白基因導入紫花苜蓿中,建立了較為完善的苜蓿再生體系,為提高苜蓿的抗鹽性提供了方法。張靜[16]將LYZGFP雙元基因導入3個苜蓿品種中,并對其遺傳轉化體系進行了優化,為研究轉基因抗病苜蓿新品種奠定了基礎。
MsDUF基因是從紫花苜蓿自身提取出的,是DUF4228家族成員之一,在紫花苜蓿各組織中均有發現,能在不同的逆境下上調表達[17]。但其他植物能否通過表達該基因而使抗逆能力提高還有待研究。
本試驗采用農桿菌介導法,通過篩選轉化受體及愈傷誘導、分化和生根培養基的最優抗生素濃度,建立了一套高效的MsDUF基因轉化紫花苜蓿的遺傳轉化體系,這將為進一步研究MsDUF基因的功能奠定基礎。
1材料與方法
1.1試驗材料
1.1.1轉化材料 供試品種為保定紫花苜蓿(MedicagosativaL.cv.Baoding),購自中國農業科學院北京畜牧獸醫研究所。選取7日齡無菌苗的葉片和下胚軸作為遺傳轉化受體。
大腸桿菌DH5α由北京天根生化科技有限公司提供,農桿菌菌株GV3101由西北農林科技大學生命科學學院張大鵬提供;植物表達載體質粒pCAMBIA1301-MsDUF,由本實驗室構建,該質粒攜帶有MsDUF基因。
1.1.2培養基 種子萌發培養基為1/2MS固體培養基,農桿菌介導培養基為YEB培養基,愈傷組織誘導培養基為UM+2mg/L2,4-D+0.25mg/LKT,分化培養基為UM+0.7mg/LKT,生根培養基為1/2MS培養基,預培養基、共培養基均為MS培養基。
YEB、MS、UM、1/2MS培養基配方參照《植物生理學實驗》[18],所有培養基均需在121℃下滅菌25min,抗生素用BiosharpBS-PES-2233mm0.22μm一次性針頭濾器進行過濾。培養基的大量元素、微量元素、鐵鹽和有機質母液的配制均參照《實用植物組織培養技術教程》[19]。
1.2試驗方法
1.2.1轉化受體的篩選及農桿菌介導轉化 選取保定紫花苜蓿成熟種子,用75%乙醇消毒5min后,無菌水沖洗;再用10%次氯酸鈉消毒10min,無菌水反復沖洗幾次后將種子置于含有1/2MS固體培養基的無菌三角瓶中,在(25±2)℃培養箱中發芽并生長一周后,取無菌苗的子葉和下胚軸各100個作為外植體。
把pCAMBIA1301-MsDUF質粒轉入到農桿菌中,然后在YEB培養基中低速振蕩培養至OD600值為0.3~0.5;將苜蓿子葉和下胚軸放入MS培養基中預培養2d后,將其轉移到上述含有農桿菌的YEB培養基中振蕩培養10min,然后將外植體材料取出用無菌紙吸干后放在MS共培養基中暗培養2d,轉到愈傷誘導培養基上,統計誘導出愈傷組織的外植體數及愈傷組織誘導率。
1.2.2愈傷組織誘導的抗生素濃度篩選 將苜蓿材料(每個處理50個樣本,重復5次)從MS共培養基中取出后依次用滅菌水、含有400μg/mL頭孢(Cef)的滅菌水沖洗,并在液體MS培養基里清洗幾分鐘,然后轉到含有不同濃度潮霉素(Hyg濃度為10、30、50、70mg/L)和頭孢(Cef濃度為100、300、500、700mg/L)的愈傷誘導培養基中進行培養,每20天繼代一次,繼代2次,觀察抗生素抑制農桿菌的狀況及愈傷組織的褐化情況,并統計愈傷數及愈傷率,選擇最適抗生素濃度。
1.2.3分化培養的抗生素濃度篩選 將愈傷組織轉移到分化培養基(抗生素濃度設計與愈傷組織誘導培養基中的相同)上,每個處理轉移50個愈傷,重復5次,30d后觀察胚狀體分化及污染狀況,統計分化出的胚狀體數及分化率。
1.2.4生根培養的抗生素濃度篩選 待抗性芽生長至2~3cm高時轉入含有不同濃度抗生素(抗生素濃度設計與愈傷誘導培養基中的相同)的生根培養基中進行生根培養,統計生根率,然后將獲得的轉基因植株移栽到花盆中進行煉苗。
1.2.5轉基因植株的鑒定 (1)PCR檢測:以CTAB法提取出的轉基因紫花苜蓿葉片基因組為模板,使用目的基因特異引物MsDUF-F(5′-CTAATGGGGAACACTTTTGG-3′)和MsDUF-R(5′-AAATCTCCTCAGTTTGGTGAG-3′)進行PCR檢測。
(2)RT-PCR檢測:利用Trizol法提取經PCR檢測陽性的轉基因紫花苜蓿總RNA,并使用TaKaRa公司的去基因組DNA反轉錄試劑盒反轉錄為cDNA,以紫花苜蓿看家基因β-Actin作為內參,MsDUF-F和MsDUF-R為基因特異性引物,對MsDUF基因進行Real-TimePCR檢測。
1.3數據統計與分析
采用MicrosoftExcel2010整理和分析數據。涉及的計算公式為:
愈傷誘導率(%)=誘導出愈傷組織的外植體數/接種的外植體總數×100 ;
分化率(%)=分化的胚狀體數/轉移的愈傷數×100 ;
生根率(%)=生根株數/分化株數×10
2結果與分析
2.1轉化受體的選擇
分別以下胚軸和子葉為外植體進行愈傷組織誘導,培養20d后下胚軸的愈傷誘導率達到99%(表1),高于子葉(90%),故選擇下胚軸作為最優外植體。
2.2愈傷誘導培養基的抗生素濃度篩選
結果顯示,當Hyg和Cef濃度較低時,愈傷組織呈現出淡黃色,內部致密外部松散,表面干燥,生長較快,但污染率較高;Hyg和Cef濃度高時,愈傷組織塊表現為黃褐色,結構松軟,用手捻碎愈傷塊可發現水分含量較高,愈傷組織死亡率增加,愈傷誘導率降低,但污染率最低,表明抗生素濃度高對愈傷組織產生強烈的抑制作用。綜合比較,30mg/LHyg+500mg/LCef處理的愈傷組織誘導效果最好(表2);在此條件下誘導培養5d,下胚軸開始膨脹變大,形成愈傷組織;10d后,愈傷組織塊增大,呈白色或淡黃色,質地緊密(圖1)
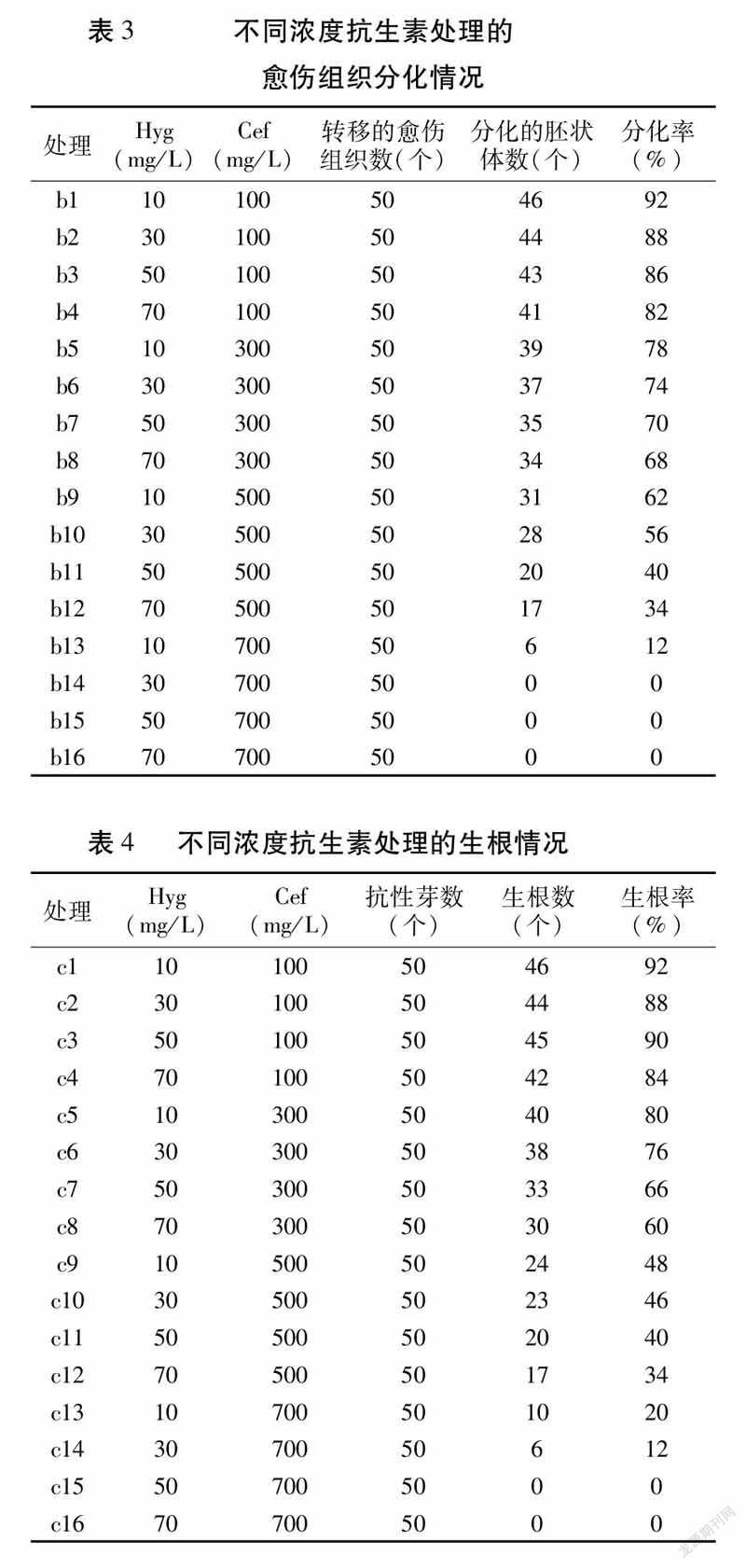
2.3分化培養基抗生素濃度的篩選
將愈傷組織轉入含有不同濃度抗生素的分化培養基中,觀察發現20d時,愈傷組織出現淡綠色的胚狀體;30d后,隨著抗生素濃度的增加,分化的胚狀體數逐漸減少,分化率降低,抗生素濃度最高時全部褐化死亡。表明高濃度抗生素對愈傷組織分化有明顯的抑制作用。綜合愈傷組織污染及分化情況,選用30mg/LHyg+500mg/LCef作為分化培養的最適抗生素濃度處理(表3)。
2.4生根培養基的抗生素濃度篩選
抗性芽在添加不同濃度抗生素的1/2MS培養基上的生根率隨抗生素濃度的升高而降低,甚至出現死亡(表4)。綜合來看,當抗生素濃度為30mg/LHyg+300mg/LCef時根系的生長狀況最佳,根系長、粗壯、須根發達(圖2)。
2.5轉基因苜蓿的PCR檢測
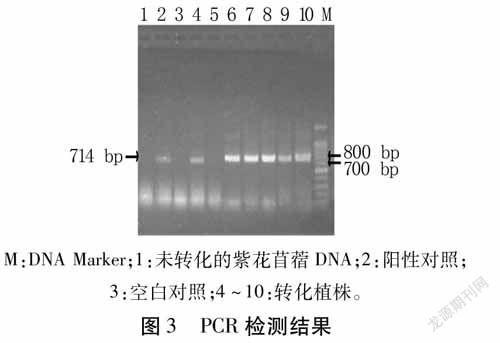
利用提取的轉基因植株DNA為模板,以MsDUF-F和MsDUF-R為引物進行PCR擴增,以經過相同再生過程的野生型紫花苜蓿為陰性對照,水為空白對照,發現選取的7株轉基因苜蓿中有6株檢測出與目的基因大小相同的條帶,經1%瓊脂糖凝膠電泳檢測,產物長度為714bp(圖3)。初步得到6株轉基因陽性植株。
2.6轉基因苜蓿的RT-PCR檢測
以反轉錄后的cDNA為模板、以MsDUF-F和MsDUF-R為引物進行Real-TimePCR擴增,經電泳檢測后發現,從選取的5株再生苜蓿(分別對應圖3中的6、7、8、9、10)中均檢測出與目的基因大小相吻合的清晰條帶(圖4),表明目的基因已整合進紫花苜蓿中,同時可以在RNA水平上正常表達。
3討論
紫花苜蓿在畜牧業發展和環境改良中具有重要作用,但隨著干旱范圍的擴大,紫花苜蓿的生長及產量受到了極大的限制[17]。高效的紫花苜蓿遺傳轉化體系能夠降低成本,減少損失,使轉化率增高[20],對進一步研究轉化后的紫花苜蓿MsDUF基因功能具有重要作用。
要建立高效的紫花苜蓿遺傳轉化再生體系,選擇再生能力好的外植體材料及適宜的抗生素濃度非常關鍵。紫花苜蓿外植體大多選用葉片、下胚軸及子葉。本研究分別用保定紫花苜蓿的下胚軸和子葉為外植體進行愈傷誘導率對比,發現用下胚軸為外植體時的愈傷誘導率較高,這與錢瑾[21]和王涌鑫等[22]的研究結果一致,而與謝鑫星等[23]的研究結果有所不同,可能是由于所用紫花苜蓿品種不同造成的。
在使用農桿菌介導MsDUF基因轉入到紫花苜蓿中時,殘留的農桿菌往往會造成培養基污染,使植株成活率降低。為解決該問題,通常采用在培養基中加入抗生素的方法來抑制農桿菌生長,進而提高轉化率。但高濃度抗生素又會對植物細胞產生損傷[24,25],因此,選擇適宜的抗生素濃度對于遺傳轉化成功尤為重要。本試驗過程中發現,當抗生素濃度低時,愈傷組織成活率較高,但污染率也較高;而當抗生素濃度高時,雖然污染率降低,但是愈傷組織死亡率升高。這與馬伶俐[26]和許來俊[27]的研究結果一致,也證明了選用適宜濃度的抗生素對獲得較高遺傳轉化效率具有重要影響。
4結論
本研究建立了適宜農桿菌介導的轉MsDUF基因保定紫花苜蓿的最佳遺傳轉化體系:以下胚軸為外植體,在MS培養基上預培養2d后,轉移到OD600為0.3~0.5的農桿菌(含有pCAMBIA1301-MsDUF質粒)菌液內振蕩培養10min,在MS共培養基中暗培養2d,再轉入到愈傷培養基(UM+2mg/L2,4-D+0.25mg/LKT+30mg/LHyg+500mg/LCef)上誘導愈傷組織,光照16h、黑暗8h,每隔20天繼代一次,繼代2次后轉移到分化培養基(UM+0.7mg/LKT+30mg/LHyg+500mg/LCef)上進行分化,30d后待抗性芽生長至2~3cm高時轉移到生根培養基(1/2MS+30mg/LHyg+300mg/LCef)進行生根培養,獲得完整植株后移栽到花盆中,經PCR和RT-PCR檢測獲得轉基因陽性植株,說明MsDUF基因已經整合到植物基因組中。

