骨肉瘤患者血清中miR-34a、miR-449a表達及與新輔助化療耐藥的關系
楚利濤 李興華 朱梁豫 辛曉林 魏 瑄 駱曉飛
骨肉瘤是骨組織最常見的原發性惡性腫瘤,其惡性程度較高,并常見于青少年。目前關于骨肉瘤發生機制研究常處于探索中,與青春期骨生長過快和遺傳等因子有關[1]。骨肉瘤主要發生在膝關節周圍,可能和青春期股骨遠端和脛骨近端的骨骺快速生長關密切[2],且女性患者發病高峰稍早于男性。有數據報道[3],手術聯合化療治療后5年生存率為55%~65%,常見于肺部轉移,且2年生存率不到25%。最近幾年關于基因在骨肉瘤發生和發展過程中的作用越來越多,認為基因治療是一種有效途徑[4]。MicroRNA(miRNA)可以特異性識別靶基因的3'短非翻譯區而對其表達起到負性調節作用。miR參與腫瘤發生、轉移和治療及預后等。miR-34a和miR-449a表達水平影像腫瘤發生和發展。本文選擇醫院2019年1月至2020年1月診治的骨肉瘤患者,給與新新輔助化療前檢測血清中miR-34a、miR-449a表達水平,現將研究結果報告如下。
1 材料與方法
1.1 一般資料
隨機選擇醫院2019年1月至2020年1月診治的骨肉瘤83例,將其納入研究組。研究組納入標準:①病理確診;②知情同意患者;③首次確診和治療的患者;④新輔助化療患者。排除標準:①合并其他惡性腫瘤患者;②復發患者;③免疫系統紊亂患者;④活動性出血患者;⑤妊娠期、哺乳期患者。另選取同期體檢健康受試者83例,將其納入對照組。對照組納入標準:① 8~28歲受試者;②知情同意;③自愿參加。研究組,年齡6~17歲,平均(11.06±1.29)歲,男性43例,女性40例。對照組,年齡5~27歲,平均(20.07±1.28)歲,男性44例,女性39例。兩組患者一般資料差異比較無統計學意義(P>0.05),具有可比性。
1.2 方法
血清miR-34a、miR-449a檢查:抽取兩組受試者空腹血液3 ml,低速離心(20 min)處理后留下血清,將上層血清轉移到新試管中,儲備。按照血清RNA提取試劑盒指令提取,采用實時定量逆轉錄聚合酶聯式反應檢測血清miR-34a、miR-449a水平。臨床病理特征:使用問卷調查法收集患者臨床病理特征,包括年齡、性別、腫瘤位置、分期。
新輔助化療方案:第一周期大劑量MTX方案:MTX 200 mg/kg或8~12 g/m2;第二周期IFO方案:2~3 g/m2,連用5天;第三周期AP方案:用法ADM 60 mg/m2,DDP 120 mg/m2,每一周期間隔12天左右,3個周期為一個療程。
化療反應:根據化療結果將其分成無效化療組和有效化療組,分別為31例和52例。
1.3 評價指標
比較兩組患者血清miR-34a、miR-449a水平,分析血清miR-34a、miR-449a水平與骨肉瘤患者臨床病理特征的關系,對比化療有效和無效患者治療前后血清miR-34a、miR-449a水平。
1.4 統計學方法
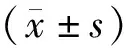
2 結果
2.1 兩組受試者血清miR-34a、miR-449a水平比較
研究組患者血清miR-34a水平(6.47±1.28)明顯高于對照組(P<0.05),miR-449a水平(29.47±1.23)低于對照組(P<0.05),見表1。
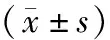
表1 兩組受試者血清miR-34a、miR-449a水平比較
2.2 血清miR-34a、miR-449a水平與骨肉瘤病理特征的關系
不同年齡、性別、腫瘤部位患者血清miR-34a、miR-449a水平比較無統計學意義(P>0.05)。不同腫瘤大小、分期患者的血清miR-34a、miR-449a水平比較有統計學意義(P<0.05),見表2。
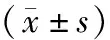
表2 血清miR-34a、miR-449a水平與骨肉瘤臨床病理特征的關系
2.3 血清miR-34a、miR-449a表達水平及與新輔助化療耐藥關系分析
化療有效組血清miR-34a表達水平(7.09±1.09)明顯低于無效組(P<0.05),miR-449a表達水平(33.74±2.06)明顯高于化療無效組(P<0.05),見表3。
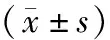
表3 血清miR-34a、miR-449a表達水平及與新輔助化療耐藥的關系
3 討論
骨肉瘤也稱為成骨肉瘤,是骨的原發性惡性腫瘤,在原發性骨腫瘤中骨肉瘤發生率僅次于漿細胞骨髓瘤。目前認為,骨肉瘤出現轉移的風險為20%,常見肺部轉移或全身彌漫性轉移后死亡。最近幾年隨著化療技術發展,骨肉瘤患者生存率得到明顯提升,生存時間延長。但化療伴有嚴重毒副作用,且化療耐藥影響化療效果。多藥耐藥是指腫瘤細胞被一種藥物誘發耐藥后,同時對其他多種結構和作用機制完全不同的藥物產生交叉耐藥的一種現象。化療多藥耐藥是一個多基因參與的復雜過程[5]。以往研究結果顯示[6],癌細胞對化療藥物的敏感性決定了抗癌小幅。因此,迫切需要尋找理想的腫瘤標志物,以提升化療效果。MiRNA的前身是初級轉錄RNA,初級轉錄RNA在細胞核內被一類多蛋白復合體切除miRNA前體[7-9]。在特異性酶作用下解旋呈單鏈狀態后具有了生物活性,能與靶mRNA上的miRNA依賴性基因沉默復合物結合,通過識別并與非翻譯區結合,從而抑制mRNA的翻譯。miR-34家族成員較多,其中miR-34a備受關注[10]。目前已研究證實[11-12],腫瘤細胞中的染色體雜合性缺失和啟動子區域的GpG島甲基化導致了miR-34a表達量的異常,而其通過多種下游靶分子參與了調節腫瘤細胞的生物學特征[13],包括腫瘤增殖與凋亡等。miR-449a是最近幾年來新發現的一種miRNA,能通過轉錄后調控的方式來調控多種基因表達,直接或間接參與某些疾病的發生和發展[14]。miR-449a能上調p53的表達,間接激活p21基因,在PARP與其他細胞凋亡相關蛋白參與下,最終有道細胞程序性凋亡,其表達上調能進一步抑制癌細胞政增殖和促進癌細胞程序性死亡[15]。
由于循環miRNA可以在血液中穩定表達,并具有無損傷,可以多次反復取材檢查的優點,因而現已廣泛用于各種癌癥的檢查和判斷預后[16]。在指導臨床診治上,miRNA具有很廣闊的前景[17-19]。本文納入分析了83例骨肉瘤患者和83例體檢健康的受試者,對其血清miR-34a、miR-449a表達水平進行比較,結果顯示骨肉瘤研究組患者miR-34a高表達,而miR-449a低表達。說明,骨肉瘤患者血清miR-34a、miR-449a表達情況異于同齡健康人群。進一步分析發現,不同腫瘤大小、分期患者的血清miR-34a、miR-449a水平存在差異,其中>19歲、腫瘤直徑>10cm和Ⅲ期分期患者的血清miR-34a水平最高,而miR-449a水平最低。提示,骨肉瘤患者年齡、腫瘤直徑、分期影響血清miR-34a、miR-449a表達。患者經新輔助化療治療后,出現63.56%(52/83)的化療無效現象,說明存在一定程度的化療耐藥情況[20]。化療有效組患者血清miR-34a表達水平明顯低于無效組,miR-449a表達水平明顯高于化療無效組。提示miR-34a高表達和miR-449a低表達可能影響骨肉瘤細胞對化療藥物的敏感性,高表達miR-34a和低表達miR-449會增強癌細胞對多種化療藥物產生耐受,進而降低細胞對化療的敏感性。
綜上所述,骨肉瘤患者血清miR-34a高表達,miR-449a低表達,并協同參與影響新輔助化療耐藥。

