補體C3和C4表達水平與早期非小細胞肺癌老年肥胖患者臨床病理特征及預后的相關性分析
蘆翼飛 任中海 王 磊 賈彥巍
非小細胞肺癌(non-small cell lung cancer,NSCLC)占肺癌總數的80%以上,NSCLC的5年生存率低于15%,預后較差[1]。目前,NSCLC的診斷標志物主要是細胞角蛋白19片段,糖類抗原125和50等,但上述幾種標志物對患者預后評價效果仍不能滿足臨床需求[2]。
肥胖是炎癥系統的慢性激活,而肥胖與腫瘤的交互作用關系更是受到廣泛關注。美國1/7的男性、1/5的女性癌癥及歐盟國家4%的男性癌癥及7%的女性癌癥的發生均與肥胖有關[3]。補體是炎癥過程中不可或缺的,對先天性感染具有先天免疫力[4]。鑒于補體系統與炎癥之間的潛在聯系,一些補體成分可能在與炎癥相關的致癌作用中發揮作用。此外,補體激活可通過直接促進腫瘤細胞裂解或補體依賴性細胞毒性途徑,從而發揮對癌癥的先天免疫[4]。補體C3是三種補體激活途徑的收斂點;C4是補體經典激活途徑中另一重要組分。補體C3與C4在上皮性卵巢癌[5],胃癌[6],舌鱗狀細胞癌[7]等多種腫瘤的研究已有報道。目前,NSCLC患者腫瘤組織中補體C3與C4蛋白水平的定量檢測尚未見報道。本研究旨在探究早期NSCLC組織中補體C3和C4表達水平與老年肥胖患者臨床病理特征及預后的相關性。
1 材料與方法
1.1 研究對象
收集2018年2月到2019年8月行手術的Ⅰ~Ⅱa期NSCLC患者(年齡≥50歲)癌組織及癌旁組織共120例。NSCLC的分期依據2018年美國國立綜合癌癥網絡(national comprehensive cancer network,NCCN)指南第5版[8]。120例患者中位年齡為63歲,年齡為50~78歲,平均年齡為(59.8±4.7)歲;男性84例,女性36例;鱗狀細胞癌68例,腺癌28例,大細胞癌24例;高分化72例,中分化20例,低分化28例。本研究組織樣本及臨床資料的獲取經醫院倫理會批準,所有患者均簽署知情同意書。計算患者體重指數(Body Mass Index,BMI)(kg/m2)。依據BMI的三分位數將患者分為低、中、高BMI三組。
1.2 隨訪
于術后對120例患者進行24個月電話隨訪或門診隨訪,隨訪日期截止至2021年9月。
1.3 Wb法檢測組織補體蛋白C3和C4含量
低、中、高BMI三組各取4對NSCLC癌組織及癌旁組織制備細胞總蛋白,進行SDS-PAGE凝膠電泳。以C3和C4單克隆抗體為一抗(兔源性單抗),辣根過氧化物酶標記的山羊抗兔IgG抗體為二抗,檢測C3和C4蛋白的表達,以GAPDH為內參照。同時,Wb法檢測癌組織炎癥因子CRP水平。
1.4 免疫組織化學法檢測
取NSCLC患者組織病理石蠟切片,使用5%血清進行室溫封閉40 min,然后加入單克隆抗體C3和C4(兔源性單抗),堿性磷酸酶(羊抗兔性)二抗4 ℃孵育。磷酸緩沖鹽溶液清洗后分別加入SP和DAB恒溫顯色封片。按陽性細胞百分比(%)及陽性細胞染色強弱進行免疫組化評分。
1.5 統計學分析
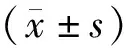
2 結果
2.1 低、中、高BMI三組基本資料比較
低、中、高BMI三組年齡、性別、吸煙史、飲酒史等比較無統計學意義(P>0.05),組間具有可比性,見表1。

表1 低、中、高BMI三組基本資料比較(例,%)
2.2 不同BMI患者癌組織及癌旁組織中C3和C4免疫組織化學結果
如表2所示,與癌旁組織相比,低、中、高BMI三組癌組織中C3和C4蛋白免疫組化評分逐漸增高(P<0.05)。

表2 C3和C4蛋白的免疫組化評分分)
2.3 不同BMI患者癌組織及癌旁組織中C3和C4的蛋白表達水平及CRP水平
低、中、高BMI3組各取4例NSCLC癌組織及4例癌旁組織應用WB技術檢測蛋白表達水平,如表3和圖1所示,與癌旁組織相比,低、中、高BMI三組癌組織中C3和C4蛋白表達水平逐漸增高(P<0.05)。同時CRP水平隨著BMI增高逐漸增高(P<0.05)。

圖1 低、中、高BMI三組癌組織及癌旁組織中C3和C4的蛋白表達水平
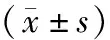
表3 不同BMI患者癌組織及癌旁組織中C3和C4的蛋白表達水平
2.4 C3和C4蛋白水平與NSCLC臨床病理特征的關系
C3和C4蛋白水平與NSCLC患者年齡、性別和組織學類型等無相關性(P>0.05),而與腫瘤分化程度(C3:γ=0.688,P<0.001;C4:γ=0.577,P<0.001)和BMI(C3:γ=0.603,P<0.001;C4:γ=0.590,P<0.001)呈線性關聯,且C3和C4蛋白在低分化和高BMI組患者中的水平增高最顯著,見表4。
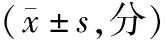
表4 C3和C4蛋白水平與NSCLC臨床病理特征的關系
2.5 癌組織中C3和C4蛋白水平與NSCLC預后的關系
經24個月隨訪,共56例患者死亡,無失訪。依據C3和C4蛋白免疫組織化學水平中位數,將患者分為高、低組。相比低C3組與低C4組,高C3組(χ2=17.564,P<0.001,圖2A)和高C4組(χ2=9.767,P<0.001,圖2B)累積生存率均顯著降低;隨著BMI增高,患者的累積生存率逐漸降低(χ2=14.879,P<0.001,圖2C)。

圖2 癌組織中C3和C4蛋白水平與NSCLC預后的關系
3 討論
雖然近年來關于NSCLC的臨床診療有了顯著發展,但患者的5年生存率仍維持在較低水平。肥胖體質促進機體炎癥系統的慢性激活[9]。炎癥被認為可促進癌癥發生,越來越多的研究旨在尋找與炎癥相關的腫瘤標志物,以提供更好的癌癥預后策略[3-4]。補體是針對非自身細胞或不良宿主元素的第一防御系統,也是參與機體炎癥反應的重要系統,被認為與癌癥進展相關的生物學過程有關。本研究就補體系統C3和C4在NSCLC癌和癌旁組織中的差異表達分析,旨在找尋NSCLC預后評估的有效分子標志物。
多篇研究指出,補體C3與癌癥間存在作用關系。Zhang等[10]發現外源性C3體外增強可促進胰腺癌細胞的增殖和活性。Farrokhi Yekta等[11]的研究發現,乳頭狀甲狀腺癌中補體C3表達增加,進一步分析表明C3觸及的補體激活級聯反應參與了甲狀腺癌的發病機制。上述研究提示,C3的差異表達通過干擾機體炎癥反應程度參與腫瘤的發生、發展過程。C4是另一個重要的補體,報道指出高血清水平的補體C4和C3可作為骨髓瘤骨病的新標志物[12]。Ajona 等[13]指出總之,支氣管液中C4的持續升高,有助于對肺癌的早期診斷,在鑒別健康人時的曲線下面積達到0.7。然而,關于C3和C4在老年肥胖NSCLC患者組織中的表達水平,及其與NSCLC生物學功能的相關性和患者預后評估的價值尚未見報道。
本研究發現,與癌旁組織相比,低、中、高BMI三組癌組織中C3和C4蛋白水平逐漸增高。此外,C3和C4免疫組織化學水平與患者的分化程度和BMI呈線性關聯,且C3和C4蛋白在低分化和高BMI組患者中的水平增高最顯著,提示兩者與NSCLC癌的不良預后密切相關,且在不同BMI患者中存在差異,同時,我們對CRP水平檢測也證實了炎癥因子CRP隨著BMI的增高在增加。我們分析可能的原因包括:①早前報道指出,超重或肥的人被診斷為癌癥時,他們的腫瘤會更大,比BMI在25以下的人平均高出33%[14];②報道指出BMI較高的患者炎癥因子水平更高,更易促進癌細胞增長[15];③對BMI高者使用標準劑量藥物治療時,可能會使藥物不足或者分布不均[16]。相比低C3組與低C4組,高C3組和高C4組累積生存率均顯著降低,而隨著BMI增高,患者的累積生存率也逐漸降低。同時,對于C3與C4水平差異仍處在部分混雜因素,由于C3與C4的水平波動伴隨著體內免疫反應及蛋白含量的波動而變化,對于營養不良或者腎臟疾病等患者,即使早期臨床病癥不明顯而沒有得到臨床確診或者患者忽視檢查最終進入到試驗階段,仍會對C3、C4水平產生錯誤估低。
本次研究發現早期NSCLC癌組織中C3和C4蛋白水平與患者分化程度和BMI相關,且高C3和C4蛋白水平均提示NSCLC患者預后較差。

