甲基磺酸乙酯誘變的棘豆鏈格孢菌菌株苦馬豆素合成基因簇相關基因表達模式分析
余永濤,毛彥妮,趙清梅,李金榮,白曉南,薛佳祺,張浩東
(1.寧夏大學農學院,銀川 750021;2.北方民族大學生物科學與工程學院,銀川 750021;3.國家民委發酵釀造工程生物技術重點實驗室,銀川 750021)
瘋草是豆科棘豆屬(Oxytropis)和黃芪屬(Astragalus)有毒植物的統稱[1-2],動物過量采食瘋草會發生以神經系統機能紊亂為特征的慢性中毒病[3-4]。苦馬豆素(swainsonine, SW)是瘋草的主要毒性成分,由瘋草中的鏈格孢屬波狀芽管孢組(AlternariaSectionUndifilumspp)內生真菌產生[5-7],該類內生真菌包括棘豆鏈格孢菌(Alternariaoxytropis)、A.fulvum和A.cinereum等3個種。目前,瘋草內生真菌合成SW的機制仍未闡明,該機制的闡釋可為從控制內生真菌角度預防動物瘋草中毒病提供新思路。據報道,酵母氨酸還原酶、酵母氨酸脫氫酶、酵母氨酸氧化酶、吡咯-5-羧酸還原酶、聚酮合酶和細胞色素氧化酶P450等基因可能是棘豆鏈格孢菌中參與SW合成的關鍵基因[8-10],但上述基因的具體功能及其在棘豆鏈格孢菌SW合成中的作用機制仍不清楚。
研究表明,植物病原真菌豆類絲核菌(Slafractonialeguminicola)、昆蟲病原真菌金龜子綠僵菌(Metarhiziumrobertsii)、番薯屬植物表生菌(Chaetothyriaceaespp)、人和動物皮膚病原真菌Trichophytonspp和Arthrodermaspp等也可產生SW[11-13]。比較基因組學研究表明,上述真菌中均存在一類高度同源、結構相似的I型聚酮合酶(type I polyketides synthetase, T1-PKS)基因簇,T1-PKS基因簇廣泛存在于細菌、真菌、植物中,負責次生代謝產物的合成[11]。Cook等[11]將綠僵菌中該基因簇的swnK基因敲除后,敲除菌株不再產生SW,確定該基因簇在綠僵菌SW生物合成中發揮關鍵作用,并將產SW真菌中的這一類基因簇統一命名為SW合成基因簇(swainsonine biosynthesis gene cluster,SWN)。SWN基因簇主要由swnR、swnN、swnH1、swnH2、swnK等基因組成,在棘豆鏈格孢菌SWN基因簇5′端還存在一個氨基酸轉運樣蛋白基因(amino-acid transporter-like,AATL)。swnK是SWN基因簇中最主要的基因,由具有腺苷酰化作用區域(adenylylation,A)、2個磷酸泛酰巰基乙胺結合作用區域(phosphopantetheine-binding/thiolation,T)、β-聚酮合酶(β-ketoacyl synthase,KS),酰基轉移酶(acyltransferase,AT),β-酮酯酰基還原酶(β-ketoacyl reductase,SDR)和硫酯還原酶(thioester reductase,SDRe1)等多個功能區組成(圖1)。功能預測分析表明,swnK可能編碼從L-哌可酸到1羥基吲哚里西啶形成之前6步酶促反應所需的多功能復合酶。而swnR、swnN、swnH1、swnH2等基因可能分別編碼從1羥基吲哚里西啶到SW的3步酶促反應所需的酶[11-12]。但迄今為止,棘豆鏈格孢菌SWN基因簇中各基因的功能仍未經過試驗驗證,其功能和SW合成途徑是否與預測結果一致還有待進一步研究。
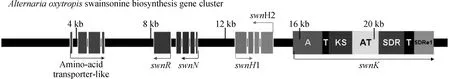
圖1 棘豆鏈格孢菌的SWN基因簇
從不同種瘋草中分離到不同的棘豆鏈格孢菌菌株,雖然這些菌株生長特性和顯微形態相近,且在遺傳進化上高度同源,但不同菌株在SW合成、分生孢子產生等方面存在顯著差異[14-16]。近年來,一些未被歸類到瘋草的豆科植物中也分離到鏈格孢屬波狀芽管孢組真菌,如Alternariabornmuelleri和甘肅鏈格孢菌(Alternariagansuense),但它們均為植物病原真菌,僅能產生極微量的SW。進一步的研究表明,這兩種病原真菌基因組中也存在與棘豆鏈格孢菌高度同源的SWN基因簇[17-19]。因此,需要對棘豆鏈格孢菌等瘋草內生真菌和甘肅鏈格孢菌等病原真菌SWN基因簇各基因的功能及其在SW合成的分子調控機制進行深入研究。
目前,棘豆鏈格孢菌SWN基因簇各基因表達水平的變化是否與真菌的SW合成相關仍未見報道。本研究擬對棘豆鏈格孢菌野生型菌株UA003進行EMS誘變處理,測定各菌株菌絲中SW的含量,篩選SW產率顯著變化的誘變菌株。然后對棘豆鏈格孢菌野生型菌株、SW產率發生顯著變化的EMS誘變菌株及僅能產生微量SW的甘肅鏈格孢菌SWN基因簇各基因表達模式和swnK基因突變位點進行分析,探究其基因表達變化的原因。通過上述研究,初步了解棘豆鏈格孢菌SWN基因簇各基因的表達模式及其與SW合成的關系,以期為進一步闡明棘豆鏈格孢菌SWN基因簇中各基因的功能奠定基礎。
1 材料與方法
1.1 材料
1.1.1 供試菌株 棘豆鏈格孢菌AlternariaSectionUndifilumOxytropis(=AlternariaOxytropis)UA003菌株,分離自變異黃芪[20];甘肅鏈格孢菌AlternariaSectionUndifilumgansuense(=Alternariagansuense)EA菌株分離自直立黃芪[19]。
1.1.2 儀器與試劑 Simpli Nano超微量分光光度計,美國GE公司;qTOWER 2.2熒光定量PCR儀,德國Jena公司;總RNA提取試劑(TaKaRa RNAiso Plus)、primeScript RT reagent kit with a gDNA eraser和B GreenTMPremix Ex TaqTMⅡ購自寶生物工程有限公司;蝸牛酶、溶壁酶、纖維素酶、甲基磺酸乙酯(EMS)購于Sigma公司;無水乙醇、三氯甲烷和異丙醇購自上海國藥集團化學試劑有限公司;焦碳酸二乙酯(DEPC)原液購自北京天根生化有限公司。相關引物(表1、表2)由上海生工生物技術有限公司合成。

表1 Real-time PCR引物序列
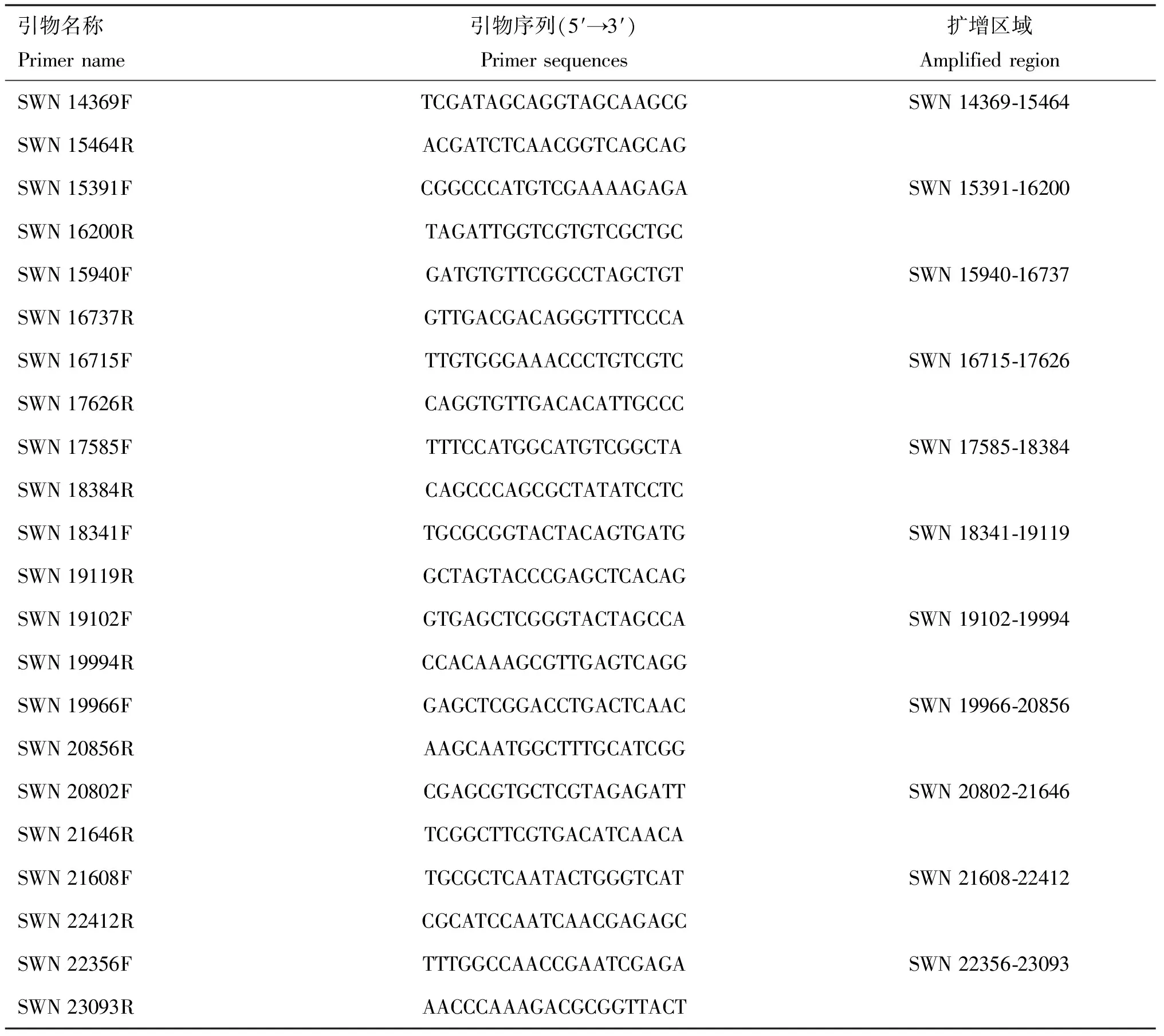
表2 swnK基因擴增引物序列
1.2 方 法
1.2.1 棘豆鏈格孢菌原生質體制備 將棘豆鏈格孢菌UA003菌株接種于PDA培養基,25 ℃培養20~30 d。將培養的真菌菌落制成6 mm直徑的菌餅,接種于裝有100 mL PDB培養基的三角瓶中,25 ℃恒溫振蕩培養15 d。用神奇濾布過濾菌液,并用0.6 mol·L-1MgSO4溶液洗滌菌絲。稱量100 mg菌絲,按質量體積比1∶10加入纖維素酶、溶壁酶和蝸牛酶質量分數比為1∶1∶1.2的酶解液,室溫90 r·min-1孵育2 h。用神奇濾布過濾酶解消化的菌絲,獲得原生質體。將原生質體轉入50 mL離心管中室溫4 000 r·min-1離心。去上清后,在離心管中加入10 mL STC buffer重懸細胞,4 000 r·min-1離心。棄去上清,在離心管中加入1 mL STC buffer重懸細胞,取少量懸液滴入血球計數板中,置顯微鏡下進行細胞計數。然后加入適量STC buffer調節原生質體濃度至1×105~1×106個·mL-1備用。
1.2.2 原生質體EMS誘變處理 取100 μL原生質體懸液,加入不同體積10 mol·L-1EMS原液,混勻,使EMS工作濃度分別為0.02、0.04、0.06、0.08 mol·L-1。分別置恒溫搖床200 r·min-1室溫孵育20、30 min,反應結束后10 000 r·min-1離心6 min,棄上清。向離心管中加入100 μL STC buffer重懸細胞,將混懸液均勻涂布于再生培養基上,20 ℃恒溫培養。每個濃度做3組平行處理,每個處理重復3次。同時設空白對照組,對照組不加EMS。
1.2.3 誘變菌株篩選 隨機挑取經EMS誘變處理和未經EMS處理的再生菌落,接種于PDA固體培養基上培養30 d。分別收集PDA培養基培養的各菌株新鮮菌絲0.5~1.0 g,液氮冷凍研磨成粉末并干燥。將粉末置于裝有5 mL甲醇的10 mL離心管中,30 ℃超聲提取30 min。每個菌株同時設置3個平行重復,每個樣品提取3次,合并提取液,然后減壓揮干溶劑。粗提物用適量甲醇溶解并用0.22 μm孔徑濾膜過濾,定容至5 mL,制成待檢液。采用張蕾蕾等[21]報道的α-甘露糖苷酶抑制法對菌絲中SW含量進行測定。比較經EMS誘變處理的誘變菌株和未經EMS處理的野生型菌株菌絲中的SW含量,篩選SW含量發生顯著變化的誘變菌株。將對照菌株和篩選所得的SW含量發生顯著變化的誘變菌株分別接種于PDA培養基上,連續傳代培養3代,分別測定每代真菌菌絲中的SW含量,進一步篩選與對照菌株SW合成差異顯著、且始終穩定的EMS誘變菌株。
1.2.4 真菌總RNA提取 收集PDA培養基上培養30 d的棘豆鏈格孢菌野生型菌株UA003、SW含量發生顯著變化的EMS誘變菌株和甘肅鏈格孢菌EA菌株的真菌菌絲50~100 mg,用液氮將其研磨成粉末。將粉末轉移至2 mL離心管中,按照試劑盒說明書提取各樣品總RNA,測定總RNA濃度,并用電泳對RNA的完整性進行評估。
1.2.5 cDNA合成 以真菌總RNA為模板,按照試劑盒操作說明將總RNA反轉錄為cDNA。去基因組DNA反應體系為5×gDNA Eraser Buffer 2 μL,gDNA Eraser 1 μL,RNA 90 ng,添加RNase Free ddH2O到10 μL。反應參數為42 ℃ 2 min,然后4 ℃保存。反轉錄反應體系為去基因組DNA后的反應液10 μL,PrimeScript RT Enzyme Mix I 1 μL,RT Primer Mix 1 μL,5× PrimeScript Buffer 4 μL,RNase Free ddH2O 4 μL。反轉錄條件為37 ℃ 15 min,85 ℃ 5 s,4 ℃保存。
1.2.6 EMS誘變菌株與野生型菌株中SWN基因簇各基因表達分析 根據Cook等[11]報道的棘豆鏈格孢菌SWN基因簇中AATL、swnR、swnN、swnH1、swnH2、swnK(A、AT、KS、SDRe1、SDR)各基因的序列信息,利用NCBI中的BLAST-Primer軟件設計引物(表1)。使用TaKaRa SYBR Green I Real-time PCR試劑盒進行Real-Time PCR擴增反應,分別以β-actin和GAPDH為內參基因,以dd H2O為陰性對照,反轉錄所得的cDNA為模板按下列組分配制PCR反應液,每個樣品設置3個重復。反應體系為TB Green Premix ExTaqⅡ(RNaseH Plus)10 μL,PCR Forward Primer 0.8 μL,PCR Reverse Primer 0.8 μL,ROX Reference Dye 0.4 μL,cDNA模板2 μL,RNase Free dd H2O 6 μL。反應條件為95 ℃預變性30 s;95 ℃變性5 s,60 ℃退火20 s,72 ℃延伸1 min,40個循環。PCR擴增產物經凝膠回收后送至上海生工生物技術公司進行測序驗證。將各組所得Ct值分別以β-actin和GAPDH基因為內參校正,采用2-ΔΔCt法計算各菌株不同基因的表達量,ΔΔCt=[Ct(處理組目的基因)-Ct(處理組內參基因)]-[Ct(對照組目的基因)-Ct(對照組內參基因)]。
1.2.7swnK基因的擴增與突變位點分析 收集棘豆鏈格孢菌UA003、SW含量發生顯著變化的EMS誘變菌株和甘肅鏈格孢菌EA菌株真菌菌絲100 mg,液氮研磨至粉末,并轉移至2 mL離心管中。然后按照試劑盒說明書提取DNA,測定各樣品的DNA濃度。使用表2中的引物對swnK基因的編碼區和非編碼區進行PCR擴增,每個片段同時設置3個平行重復。擴增體系為rTaq酶 0.5 μL,10× PCR Buffer 5 μL,dNTP 4 μL,F-Primer 0.5 μL,R-Primer 0.5 μL,DNA模板0.5 μL,加ddH2O至50 μL。反應條件為94 ℃預變性 3 min;94 ℃ 變性 30 s,60 ℃退火30 s,72 ℃延伸45 s,共30個循環;最后72 ℃ 延伸 10 min。
將每個基因片段的3個平行重復的PCR擴增產物經凝膠回收后,均送至上海生工生物技術公司進行雙向測序,應用DNAStar軟件中的SeqMan程序對雙向測序片段進行拼接,使用DNAMAN 8軟件中的ClustalW程序對拼接好的swnK基因進行序列比對分析。
1.2.8 數據處理與分析 使用IBM SPSS Statistics 20和GraphPad Prism 7統計軟件中的單因素方差法對各組真菌的SW含量及各基因的表達量進行差異分析。
2 結 果
2.1 EMS誘變菌株的篩選
隨著EMS工作濃度的增加,菌株致死率也隨之增高。當EMS工作濃度為0.06和0.08 mol·L-1時,真菌的死亡率為100%,但當EMS工作濃度為0.02和0.04 mol·L-1時,再生培養基上均有菌株存活。本研究隨機挑取了34株經EMS誘變處理且能夠在再生培養基生長的菌株,并分別對上述菌株和對照菌株真菌菌絲的SW含量進行了測定。結果表明,當EMS工作濃度為0.02 mol·L-1,處理30 min,再生后隨機挑選的所有菌株,其SW含量均高于對照菌株。經初步篩選,共有12株EMS誘變處理菌株的SW含量與對照菌株相比發生了顯著改變。本研究對初步篩選所得的12株菌株進行了連續3代的傳代培養和SW檢測,其中誘變菌株的SW含量經連續3代培養后始終與對照組差異顯著且高于對照菌株的有E02、E23和E25等。SW測定結果表明,對照菌株UA003中SW含量為(0.087±0.004)mg·g-1菌絲干重,EMS誘變菌株E02、E23、E25的SW含量均顯著高于對照菌株UA003(P<0.05或P<0.01),其中E02菌株的SW含量最高,為(0.202±0.006)mg·g-1,極顯著高于對照菌株UA003(P<0.01)(圖2)。此外本研究也測定了甘肅鏈格孢菌EA菌株的SW含量,其SW含量僅為(0.004±0.001)mg·g-1菌絲干重,極顯著低于其他菌株(P<0.01)。
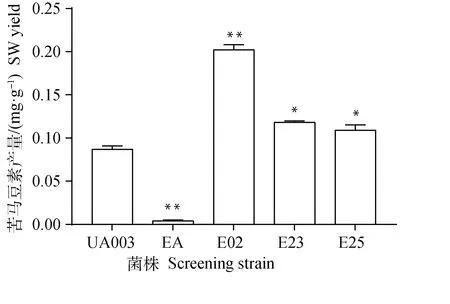
與對照組(UA003)比較,*.差異顯著(P<0.05);**.差異極顯著(P<0.01)
2.2 誘變菌株與野生型菌株中SWN基因簇各基因的表達分析
如表3所示,當以β-actin為內參基因時,與UA003菌株相比,AATL、swnR、swnN、swnH1及swnH2在EA、E02、E23和E25菌株中表達均顯著下調(P<0.05或P<0.01)。A、KS、SDR和SDRe1基因在EA、E02、E23和E25菌株中表達均顯著上調(P<0.05或P<0.01),而AT基因在E23菌株中表達極顯著上調(P<0.01),在EA、E02和E25菌株中表達則極顯著下調(P<0.01)。
由表3所示,當以GAPDH為內參基因時,與UA003菌株相比,AATL、swnR、swnN、swnH1及swnH2在EA、E02、E23和E25菌株中表達均顯著下調(P<0.05或P<0.01)。A、KS、SDR和SDRe1基因在EA、E02、E23和E25菌株中表達均顯著上調(P<0.01或P<0.05),但AT基因僅在E23菌株中表達上調(P<0.01),在EA、E02和E25菌株中的表達下調(P<0.01)。

表3 SWN基因簇各基因的相對表達量
2.3 swnK基因突變位點分析
測序結果表明,UA003、E02、E23、E25和EA等5株真菌的swnK基因序列與已公開的棘豆鏈格孢菌的swnK基因(GenBank登錄號為KY365741.1)均具有較高一致性。
UA003、E23、E25等3菌株swnK基因序列完全一致,與已公布的棘豆鏈格孢菌swnK基因序列(KY365741.1)一致性為99.97%,僅有2處堿基存在差異,均在SDR區域,但其編碼的氨基酸序列與KY365741.1完全一致。E02菌株swnK基因序列與KY365741.1的序列一致性為99.80%,與UA003的swnK基因序列一致性為99.83%。與UA003相比,E02共有13個位點的堿基發生了突變,其中,轉換突變有11個位點(G16756A、G16871A、G16939A、T16993C、T17189C、A17305G、C17429T、T17446C、G17502A、C17505T、A17307G),顛換突變有2個位點(G16997A、T17280C),分別位于swnK基因KS區域上游的A、T區域(圖3A),其編碼的氨基酸序列共有6個位點發生了突變(D403N、L445V、S509P、G613D、A614V、S615G)(圖3B)。
甘肅鏈格孢菌EA菌株的swnK基因與KY365741.1序列一致性為97.55%,與UA003swnK基因序列一致性為97.80%。與KY365741.1相比,EA菌株共有163個位點的堿基不同,分布于swnK基因的非編碼區和編碼區的各個區域,其編碼的氨基酸序列有67個位點不同,位于swnK基因的各個區域。其轉錄產物的起始段缺失了一段由15個氨基酸組成的肽鏈(MLTPAVSLKNLTKPK),在轉錄產物的1 135與1 143處(KY365741.1中對應的位置)插入了一條由7個氨基酸組成的短肽(TEVDGVP)(圖3C)。
3 討 論
棘豆鏈格孢菌SW合成能力及其在宿主植物組織中的生物量與宿主中SW的含量緊密相關[15]。據報道,棘豆鏈格孢菌SW合成能力受底物、環境、菌株等因素的影響[22-23]。棘豆鏈格孢菌SWN基因簇相關基因可能是真菌SW生物合成的關鍵基因[11],但相關基因表達水平與SW合成存在何種聯系仍有待進一步研究。目前,人們從不同種瘋草中分離到不同的棘豆鏈格孢菌菌株,由于環境和遺傳等因素的影響,直接分析不同來源的菌株SWN基因簇各基因的表達水平,并不能真實的反映各菌株SW合成能力與SWN基因簇各基因表達水平的相關性。因此,本研究對棘豆鏈格孢菌野生型菌株UA003進行了EMS誘變處理,對經EMS誘變處理并能再生的誘變菌株進行了篩選,篩選出與野生型菌株SW合成能力差異顯著的突變菌株,以此為研究模型來分析SWN基因簇各基因表達水平的變化與SW合成的關系。在本研究中,突變菌株E02、E23和E25由野生型菌株UA003誘變而來,其遺傳背景與UA003相同,比較分析其與野生型菌株UA003菌株SWN基因簇各基因的表達模式,從理論上來說能夠更為真實地反映真菌SW合成與SWN基因簇各基因之間的關系。
在本研究中,E02、E23和E25菌株經EMS誘變處理后,SW生物合成能力顯著升高。與UA003相比,3株誘變菌株SWN基因簇各基因表達水平也顯著改變。其中swnK中A、KS、SDR、SDRel等基因的表達均顯著上調,其表達模式與SW合成呈正相關。而AATL、swnR、swnN、swnH1及swnH2基因表達均顯著下調,其表達模式與SW產率呈負相關。而swnK中的AT基因在E02、E25菌株中表達顯著下調,呈現出與swnK中A、KS、SDR、SDRel等基因相反的表達模式。在金龜子綠僵菌的研究中,swnH2基因的表達水平與SW合成呈負相關,這與本研究結果相一致,但swnR基因表達水平與SW合成呈正相關,而swnH1、swnK、swnN等基因表達與SW合成未表現出相關性[24],該研究也表明,金龜子綠僵菌中SWN基因簇各基因的表達模式可能不同于棘豆鏈格孢菌。在本研究中,E02、E23和E25菌株來源于野生型菌株UA003,但各菌株的SW產率和SWN基因簇各基因表達模式發生了顯著變化,應該是由于EMS誘導野生型菌株基因組中的堿基突變,導致了相關基因結構和功能的改變,抑制了AATL、swnR、swnN、swnH1、swnH2等基因的表達,增強了swnK基因的表達,但swnK基因表達的增強是否是導致誘變菌株SW合成增加的直接原因還有待進一步研究。
EMS是一種可改變DNA結構的高效烷化劑,能在基因組中引發多個位點的突變[25-28]。EMS通過不同的方式引發轉換型突變、顛換型突變或造成染色體片段的缺失[29]。本研究中,突變菌株E02swnK基因編碼區13個位點的堿基發生了突變,分別位于A、T區域,其中11個位點為轉換型突變,2個位點為顛換型突變,而swnK基因5′端的上游非編碼區序列未發生突變。E02菌株swnK基因的突變使其編碼產物中6個氨基酸位點發生錯義突變,可能會導致swnK基因表達水平和功能的改變。盡管E23、E25菌株SWN基因簇中各基因的表達模式與E02相似,然而這兩株突變菌株swnK基因編碼區及其5′端上游非編碼區序列未發生突變。在真菌基因表達調控中,轉錄水平的調控發揮著至關重要的作用。轉錄水平的調節由位于基因轉錄起始位點上游的非編碼區順式作用元件,以及可與非編碼區或編碼區互作的反式作用因子、RNA聚合酶等共同參與。啟動子、增強子、抑制子等順式作用元件,通過引發基因轉錄起始來調控轉錄頻率。而轉錄因子等反式作用因子,則能與基因5`端上游非編碼區特定序列專一性結合,通過調節基因的轉錄從而保證目的基因以特定的強度在特定的時間與空間的表達[30-31]。在本研究中,E02、E23和E25等3株突變菌株swnK基因的表達水平與野生型菌株相比均發生了顯著變化,但swnK基因5′端上游非編碼區序列(順式作用元件)并未發生突變。表明3株突變菌株swnK基因表達水平變化與啟動子等順式作用元件無關,其在轉錄水平的調控可能是由轉錄因子等反式作用因子或RNA聚合酶等其他元件來調節。目前仍不清楚與swnK基因互作的反式作用因子有哪些,上述誘變菌株中相關轉錄因子編碼基因是否也發生了突變仍不清楚。由于棘豆鏈格孢菌SWN基因簇全長約23 kb,受研究成本限制,本研究并未對AATL、swnR、swnN、swnH1及swnH2等基因及其非編碼區突變位點進行分析,這些基因核苷酸序列是否發生了突變,并導致轉錄產物或基因表達水平的變化仍不清楚。進一步的研究應結合全基因組測序、SNP等分析技術,對誘變菌株突變位點進行全面分析,這將為進一步揭示SWN基因簇各基因的分子調控機制奠定基礎。
在本研究中,甘肅鏈格孢菌EA菌株分離自直立黃芪,同屬于鏈格孢屬波狀芽管孢組真菌,其基因組中同樣存在與棘豆鏈格孢菌高度同源的SWN基因簇,但該菌僅能產生極微量的SW。在以UA003為對照時,EA菌株呈現出與E02、E23和E25等菌株相同的表達模式,盡管培養條件一致,但EA菌株與UA003、E02、E23和E25等菌株的遺傳背景和來源不同。突變位點分析結果表明,與棘豆鏈格孢菌相比,EA菌株swnK基因序列共有163個位點不同,分布于swnK基因的非編碼區和編碼區的各個區域,其編碼的氨基酸序列也有67個位點不同,其轉錄起始位點也不同,表達產物缺失了一段由15個氨基酸組成的肽鏈,在AT區域還插入了一段由7個氨基酸組成的短肽,上述位點的差異表明,甘肅鏈格孢菌EA菌株swnK基因的結構和功能必然與同屬的棘豆鏈格孢菌等瘋草內生真菌不同。因此,以UA003為對照菌株,并不能客觀地反映EA菌株SWN基因簇各基因的表達模式及其與SW產率的關系。進一步的研究需要對甘肅鏈格孢菌和棘豆鏈格孢菌SWN基因簇各基因的結構和功能進行比較分析,這將為闡明棘豆鏈格孢菌等瘋草內生真菌SWN基因簇各基因的功能及其轉錄調控機制奠定基礎。
4 結 論
EMS能顯著改變棘豆鏈格孢菌的苦馬豆素合成能力和SWN基因簇各基因的表達水平。棘豆鏈格孢菌SWN基因簇中AATL、swnR、swnN、swnH1、swnH2等基因的表達模式與苦馬豆素合成呈現負相關趨勢,A、KS、SDR和SDRe1等基因的表達模式與苦馬豆素合成呈現負相關趨勢,EMS突變菌株苦馬豆素的合成的變化可能與SWN基因簇相關基因結構和功能的變化有關。本研究可為進一步闡明棘豆鏈格孢菌等瘋草內生真菌SWN基因簇中各基因的功能奠定基礎。

