牛種布魯氏菌Ⅳ型分泌系統對巨噬細胞內質網應激和細胞凋亡的影響
楊 琴,鄧肖玉,謝珊珊,易繼海,王 勇,張 倩,王 震,陳創夫*
(1.石河子大學動物科技學院,石河子 832000;2.人獸共患傳染性疾病防治協同創新中心,石河子 832000;3.新疆農墾科學院省部共建綿羊遺傳改良與健康養殖國家重點實驗室,石河子 832000;4.動物疫病防控兵團重點實驗室,石河子 832000)
布魯氏菌病(brucellosis)是一種由布魯氏菌(Brucella)感染引起的人獸共患病,是我國重大的公共衛生問題之一[1]。布魯氏菌致病機制的關鍵是它與宿主細胞的相互作用,巨噬細胞作為機體重要的免疫細胞,常常是布魯氏菌入侵的首選對象[2],布魯氏菌可利用自身的多種機制逃避宿主細胞的識別及殺傷,適應胞內環境并進行生存及復制[3]。布魯氏菌的T4SS是一組由virB啟動子(virB1~virB12)調控表達的多蛋白復合物,也是布魯氏菌主要的毒力因子,主要通過分泌效應蛋白發揮毒力作用,協助布魯氏菌順利到達內質網,完成胞內的入侵及繁殖[4-5]。布魯氏菌侵入宿主細胞后能通過調控細胞凋亡來影響自身的存活,因此研究布魯氏菌調控細胞凋亡的具體機制成為越來越多學者關注的方向。研究表明,羊種布魯氏菌能夠誘導宿主細胞發生凋亡[6],最新研究發現,布魯氏菌的一種核效應蛋白BspJ能夠發揮抑制細胞凋亡的作用[7]。細胞凋亡發生途徑通常有三條,近年來,經由內質網應激誘導的細胞凋亡途徑愈發走進學者們的視野[8-9]。內質網是蛋白質加工、折疊及運輸的主要場所,也是細胞重要的鈣庫,對于細胞穩態的維持至關重要[10-11],同時也是布魯氏菌賴以生存的復制基地,然而,大量研究證實,正是因為布魯氏菌在內質網中的大量復制,常常會導致內質網的穩態失衡,發生內質網應激[12-13],若內質網應激強度過強或持續時間過長,內質網穩態無法及時恢復,細胞就會走向凋亡。研究已經證實,T4SS效應蛋白VceC以及VceA的缺失能夠影響布魯氏菌調控的細胞凋亡[14],且VceC能夠直接參與布魯氏菌對內質網應激的調控[15]。但這些研究只是對布魯氏菌T4SS效應蛋白所調控的內質網應激和細胞凋亡作了闡述,而對于整個T4SS在布魯氏菌誘導的內質網應激和細胞凋亡過程中發揮的作用還不清除。
因此,本研究用牛種布魯氏菌T4SS啟動子缺失株A19ΔVirB侵染小鼠RAW264.7細胞,探究T4SS對牛種布魯氏菌感染引起的內質網應激及細胞凋亡的影響,深入了解T4SS在布魯氏菌胞內寄生過程中的作用,為進一步解析布魯氏菌的致病機制及T4SS的功能研究提供理論依據。
1 材料與方法
1.1 材 料
1.1.1 菌株和細胞 小鼠巨噬細胞系 RAW264.7和牛種布魯氏菌A19疫苗株及其T4SS啟動子缺失株A19ΔVirB[16]為兵團動物疫病防控重點實驗室保存。細胞的培養和侵染方法按文獻[17]進行。
1.1.2 主要試劑及儀器 RNA提取試劑盒和cDNA第一鏈合成試劑盒購自北京康為世紀生物科技有限公司;兔抗GRP78單克隆抗體、兔抗CHOP單克隆抗體、兔抗BCL-2 單克隆抗體和兔抗BAX單克隆抗體均購自美國CST公司;細胞凋亡檢測試劑盒購自上海愛必信生物科技有限公司;高通量實時熒光定量PCR儀購自賽默飛世爾科技公司;流式細胞儀購自美國BD公司。
1.2 方 法
1.2.1 引物設計與合成 參照GenBank中公布的GRP78、CHOP、BAX和BCL-2基因的mRNA序列,利用Primer 5.0軟件設計對應的qRT-PCR引物(引物序列見表1),引物由上海生工生物工程股份有限公司合成。

表1 qRT-PCR引物序列
1.2.2 qRT-PCR檢測內質網應激、凋亡相關基因的轉錄水平 布魯氏菌A19和A19ΔVirB以100∶1的感染復數侵染RAW264.7細胞[16],在侵染的6、12和24 h用Trizol裂解細胞,收集的細胞裂解液置于無 RNAase 的EP 管中,按照康為世紀RNA提取試劑盒說明書進行細胞總RNA的提取,取1 μL樣品進行 RNA 濃度和純度的測定;而后繼續按照康為世紀cDNA 第一鏈合成試劑盒的說明書將提取的RNA 反轉錄成 cDNA;最后以 cDNA 為模板,GAPDH為內參基因,用實時熒光定量PCR儀進行檢測,qRT-PCR反應條件:95 ℃ 5 min;95 ℃ 15 s,59 ℃ 30 s,72 ℃ 30 s,共40個循環;試驗完成后,用2-ΔΔCt法來計算各基因的相對轉錄量。
1.2.3 Western blot 檢測內質網應激、凋亡相關基因的蛋白表達水平 布魯氏菌A19和A19ΔVirB以100∶1的感染復數侵染RAW264.7細胞,在侵染的6、12和24 h收集細胞,在收集細胞前5 min先在冰上按照比例配制好RIPA和蛋白酶抑制劑混合物,用配制好的混合物在冰上裂解細胞約10 min,而后用細胞刮輕輕將細胞刮下,收集裂解液于無菌EP管中;按照凱基 BCA 蛋白含量檢測試劑盒說明書進行蛋白濃度的測定,并進行蛋白濃度的調齊;最后進行SDS-PAGE 凝膠電泳,對比蛋白Marker的大小切下目的條帶后轉膜,分別孵育GRP78、CHOP、BCL-2和BAX抗體,按照Western blot常規步驟進行檢測。
1.2.4 流式細胞術檢測細胞凋亡情況 布魯氏菌A19和A19ΔVirB以100∶1的感染復數侵染RAW264.7細胞,在侵染的6、12和24 h用不含EDTA的胰酶消化細胞,消化下來的細胞收集到無菌EP管中,800 r·min-1離心5 min,棄上清,用無菌PBS漂洗細胞,離心后棄上清,用Binding buffer將細胞重懸,按照細胞凋亡檢測試劑盒說明書進行相應抗體的孵育,立即上機進行檢測。
1.2.5 數據統計 所有數據使用SPSS 26.0軟件進行差異顯著性分析,并用GraphPad Prism 8.0軟件作圖。
2 結 果
2.1 牛種布魯氏菌T4SS對內質網應激標志性分子GRP78和CHOP轉錄水平的影響
通過收集感染不同時間點的RAW264.7細胞,提取細胞總RNA,檢測內質網應激標志性分子GRP78和CHOP的轉錄水平,結果顯示,在侵染的6、12和24 h,缺失株A19ΔVirB組GRP78的轉錄水平均顯著低于親本株A19組(P<0.05)(圖1A);在侵染后的6 h,缺失株組CHOP的轉錄水平也顯著低于親本株(P<0.05),12 h時升高(P>0.05),而到了24 h,缺失株組CHOP的轉錄水平發生了顯著高于親本株(P<0.01)的現象(圖1B)。本試驗結果初步表明T4SS的缺失能夠降低牛種布魯氏菌誘導內質網應激的能力。

A.GRP78;B.CHOP。NC.正常對照組;A19.A19感染組;A19ΔVirB.A19ΔVirB感染組;與A19組相比,*.差異顯著(P<0.05), **.差異極顯著(P<0.01);下同
2.2 牛種布魯氏菌T4SS對內質網應激標志性分子GRP78和CHOP蛋白表達水平的影響
通過收集感染不同時間點的RAW264.7細胞,提取細胞總蛋白,檢測內質網應激標志性分子GRP78和CHOP的蛋白表達變化,結果顯示,在侵染的6、12和24 h,缺失株組GRP78的蛋白表達水平均顯著低于親本株(P<0.05或P<0.01)(圖2A、B);在侵染后的6 h,缺失株組CHOP的蛋白表達水平也顯著低于親本株(P<0.05),而到了24 h,變成了顯著高于親本株(P<0.05)(圖2C、D)。本試驗結果與qRT-PCR結果相符,更進一步表明T4SS的缺失能夠降低牛種布魯氏菌誘導內質網應激的能力。

A.GRP78的蛋白表達水平;B.A圖的灰度值分析;C.CHOP的蛋白表達水平;D.C圖的灰度值分析
2.3 牛種布魯氏菌T4SS對凋亡相關分子BAX和BCL-2轉錄水平的影響
通過收集感染不同時間點的RAW264.7細胞,提取細胞總RNA,檢測凋亡相關分子BAX和BCL-2的轉錄水平,結果顯示,在侵染的24 h,缺失株A19ΔVirB組BAX的轉錄水平顯著高于親本株(P<0.05)(圖3A),而缺失株組抗BCL-2的轉錄水平顯著低于親本株(P<0.01)(圖3B),本試驗結果初步表明T4SS的缺失能夠促進牛種布魯氏菌誘導細胞凋亡的能力。

A.BAX;B.BCL-2
2.4 牛種布魯氏菌T4SS對凋亡相關分子BAX和BCL-2蛋白表達水平的影響
通過收集感染不同時間點的RAW264.7細胞,提取細胞總蛋白,檢測凋亡相關分子BAX和BCL-2的蛋白表達變化,結果顯示,在侵染的24 h,缺失株A19ΔVirB組BAX的蛋白表達水平顯著高于親本株(P<0.05)(圖4A、B),而BCL-2的蛋白表達水平顯著低于親本株(P<0.05)(圖4C、D),本試驗結果與qRT-PCR結果相符,更進一步表明T4SS的缺失能夠促進牛種布魯氏菌誘導細胞凋亡的能力。

A.BAX的蛋白表達水平;B.A圖的灰度值分析;C.BCL-2的蛋白表達水平;D.C圖的灰度值分析
2.5 牛種布魯氏菌T4SS對RAW264.7細胞凋亡的影響
通過收集感染不同時間點的RAW264.7細胞,按照凋亡試劑盒說明書進行抗體的孵育,用流式細胞儀進行檢測,結果顯示,在侵染的24 h,缺失株A19ΔVirB引起的細胞凋亡率顯著高于親本株(P<0.05)(圖5、6),與qRT-PCR和Western blot結果相符,證實T4SS的缺失確實增強了布魯氏菌誘導細胞凋亡的能力。
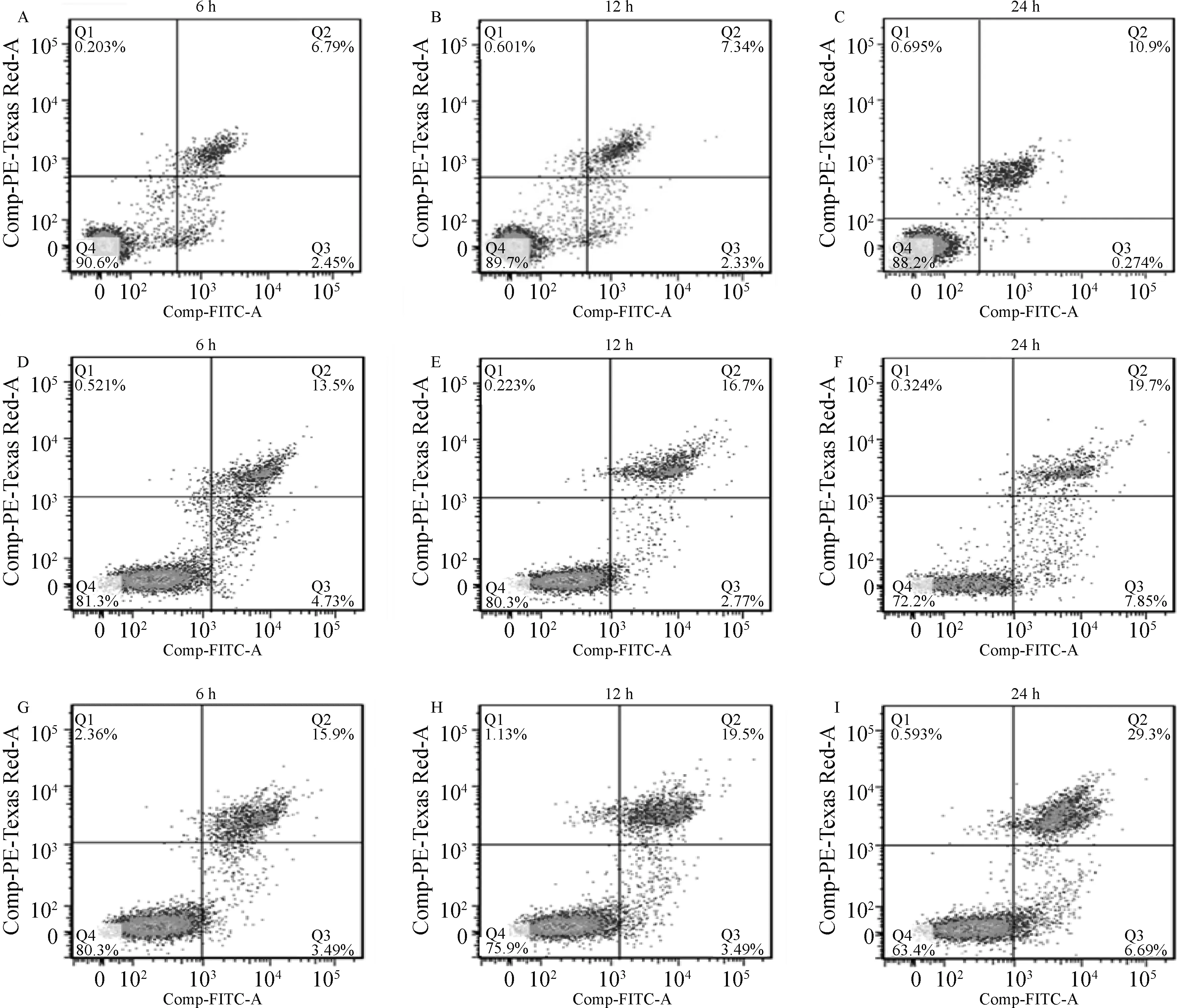
A~C.對照組6、12和24 h;D~F.布魯氏菌A19侵染組6、12和24 h;G~I.布魯氏菌A19ΔVirB侵染組6、12和24 h
3 討 論
布魯氏菌是一種胞內寄生菌,利用其特有的胞內寄生機制在機體內建立起慢性感染。內質網是細胞維持穩態的重要細胞器,同時也是布魯氏菌肆虐繁殖的場所[18]。virB編碼的T4SS是布魯氏菌主要的毒力因子之一,在它的幫助下,布魯氏菌逃避了被溶酶體降解的命運,順利到達內質網開始大量的增殖[19]。然而,也正因為布魯氏菌在內質網中的肆虐繁殖,導致內質網喪失其原本平衡的環境,內質網應激便應然而生。有報道稱,粗糙型布魯氏菌能通過促進T4SS分泌的方式誘導內質網應激[20],也有報道發現,布魯氏菌T4SS分泌的效應蛋白VceC能夠誘導內質網應激,甚至能夠操控內質網應激從而保證布魯氏菌的胞內存活[15]。GRP78通常在內質網應激發生時大量表達,是參與維持內質網穩態的重要蛋白[21],CHOP在內質網應激誘導的細胞凋亡途徑中扮演著重要角色[22],二者是衡量內質網應激發生與否的重要指示性分子。本研究結果顯示,親本株A19及其T4SS啟動子缺失株A19ΔVirB均能引起GRP78的表達水平升高,且變化趨勢一致,前期升高明顯,后期則出現下降,這可能是細胞的一種防御機制,通過GRP78表達的升高來幫助恢復內質網穩態,延長細胞在失衡環境下的存活時間;缺失株A19ΔVirB的GRP78的表達水平始終低于親本株,提示缺失株引起內質網應激的能力較親本株弱,這可能是因為virB的缺失使T4SS無法正常表達,限制了其幫助布魯氏菌順利到達內質網的能力,從而降低了布魯氏菌誘導內質網應激的能力;此外,兩株菌中CHOP的表達水平也始終高于對照組,但趨勢則與GRP78相反,呈現逐漸上升的趨勢,此結果與支飛杰[23]在山羊肺泡巨噬細胞中的研究結果相似,其中的機制可能是因為隨著GRP78的表達下降,細胞挽回內質網應激的能力減弱,無法及時恢復穩態,最終啟動了CHOP介導的細胞凋亡途徑;缺失株組CHOP的表達水平在感染前期顯著低于親本株,與GRP78的表達變化相呼應,更進一步地證實缺失株引起內質網應激的能力較親本株弱,但到了感染的24 h,出現了顯著高于親本株的現象,提示CHOP介導的凋亡途徑可能被激活,而這可能是因為virB的缺失使T4SS無法正常表達,因而無法正常分泌一些對細胞凋亡具有抑制作用的蛋白,從而更容易啟動CHOP主導的細胞凋亡途徑,誘發凋亡。

圖6 細胞凋亡率分析
當內質網應激程度過強或者持續時間太久,就會發生細胞凋亡[24]。細胞凋亡是細胞“自我犧牲”的體現,也是宿主對抗病原菌感染的重要途徑[25]。布魯氏菌常常通過抑制被感染細胞凋亡的方式促進自身的存活,而被感染細胞則通過凋亡來限制布魯氏菌生存。史靜雪[14]發現,布魯氏菌T4SS分泌的效應蛋白VceC和VceA均具有促進人滋養層細胞凋亡的作用;而最新的一項研究表明,布魯氏菌T4SS分泌的效應蛋白VceC能夠抑制CHOP介導的山羊胚胎滋養層細胞凋亡從而有利于布魯氏菌的胞內復制[12]。本研究通過qRT-PCR和Western blot檢測了細胞凋亡關鍵分子BAX和BCL-2的轉錄及蛋白表達水平,結果表明,缺失株引起促凋亡基因BAX表達水平升高的能力較親本株強,且缺失株抑制抗凋亡基因BCL-2的能力也較親本株強,表明缺失株引起細胞凋亡的能力強于親本株;為了進一步證實細胞凋亡確實發生,又使用流式細胞術檢測了兩株菌感染后細胞凋亡的情況,發現缺失株引起細胞凋亡的能力比親本株強,與BAX和BCL-2的表達水平變化結果相符,而出現這種現象的原因可能是因為virB缺失后T4SS喪失了毒力功能,使布魯氏菌的毒力減弱,從而更容易被宿主細胞識別并啟動細胞凋亡將其清除。本研究整體表明,牛種布魯氏菌T4SS的缺失降低了布魯氏菌誘導內質網應激的能力,反而增強了其誘導凋亡的能力,出現這種結果的原因可能是因為布魯氏菌誘導的凋亡是多種因素相互作用的結果,而其中的具體機制還需進一步探索。
4 結 論
使用牛種布魯氏菌T4SS啟動子缺失株A19ΔVirB侵染RAW264.7細胞后發現,牛種布魯氏菌T4SS的缺失能夠降低布魯氏菌誘導內質網應激的能力,卻增強布魯氏菌誘導細胞凋亡的能力,這對于布魯氏菌致病機制的闡明具有一定的意義,為今后T4SS功能的研究奠定了基礎,也為布魯氏菌有效疫苗的研發提供了科學依據。

