自噬對噪聲性耳聾急性損傷期毛細胞凋亡的作用機制研究*
李 林,于佳雪,黃宏明,崔 勇,盛曉麗△
(1.廣東省人民醫院珠海醫院/廣東省珠海市金灣中心醫院耳鼻喉頭頸外科 519040;2.廣東省醫學科學院/廣東省人民醫院耳鼻咽喉頭頸外科 510080)
噪聲性耳聾是感音神經性耳聾里最常見的原因之一,目前其發病機制及治療是全世界共同難題之一。導致噪聲性耳聾的一個關鍵因素是感覺毛細胞的氧化損傷。研究表明活性氧(ROS)的過度產生已成為各種內耳損傷的常見病理機制,如噪音暴露和耳毒性藥物所致的耳蝸損傷[1-2]。既往研究發現在噪聲暴露前后給予抗氧化劑治療能夠有效減少噪聲引起的毛細胞死亡從而有效改善噪聲性耳聾的發生[3-4]。越來越多的證據表明ROS會通過誘導自噬發生來保護細胞,這一過程是通過形成自噬小體來介導的,自噬小體與溶酶體融合,對吞噬的成分進行酶解[4]。通過程序性地處理這些可能受損的細胞成分,包括受損的細胞器和錯誤折疊的蛋白,起到了限制病理進展的作用[4-5]。
自噬與ROS表達水平的復雜關系表明自噬在噪聲性耳聾的發生發展中起著潛在關鍵作用,然而其具體的調控機制仍不明確。越來越多的證據表明自噬誘導的氧化應激(OS)與耳聾密切相關[6-8]。脂質過氧化、線粒體DNA氧化損傷和谷胱甘肽結合蛋白的過表達都被證明與小鼠耳蝸老化密切相關[6,9-10]。因此,探尋自噬導致的耳蝸細胞變性的確切機制及可能導致耳聾的關鍵分子靶標,無疑對噪聲性耳聾患者的治療有著極為重要的意義。本研究擬觀察自噬在噪聲性耳聾中的確切表達情況,以及其對ROS水平的調控機制,進一步明確自噬和ROS與聽覺閾值之間的相關性,為臨床治療噪聲性耳聾奠定理論基礎。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
健康成年 SD 大鼠 48只,雌雄不限,體重220~240 g,由華南理工大學動物實驗中心提供,分為3組:對照組,自噬抑制劑3-甲基嘌呤(3MA)組和自噬激動劑雷帕霉素(RAP)組。RAP、3MA購自上海寶曼生物科技有限公司;TUNEL 試劑盒購自瑞士Roche 公司;酶標儀購自美國Thermo Fisher公司;LE2202S 型電子天平購自德國Sartorius 公司;Image-Pro Plus 6.0 圖像分析軟件(美國Media Cybernetics 公司);LeicaDC500 病理圖像分析系統(德國Leica 公司);H-7650 透射電鏡(日本Hitachi 公司)。
1.2 噪聲暴露
噪聲性耳聾模型按既往文獻進行造模[11],即將大鼠放入暴露艙(0.5 m×1.5 m×0.5 m),用UZ-3型噪聲發生器發聲,平均聲強為106 dB。動物暴露范圍內聲揚不均勻度為±2 dB,噪聲頻率為4 kHz,持續暴露6 h。
1.3 腹腔注射給藥
RAP以75 mg/mL溶于DMSO并在-20 ℃下儲存;3-MA以30 mg/mL溶于0.9%的生理鹽水并在-20 ℃下儲存。根據文獻報道使用劑量[11],即每只大鼠共接受3次腹腔內注射,RAP的劑量為每次7.5 mg/kg,3-MA的劑量為每次30 mg/kg。使用時間為在噪聲暴露前24 h、前2 h和暴露后即刻進行腹腔注射。
1.4 聽覺腦干反應(auditory brainstem response,ABR)
按以往文獻描述對大鼠行ABR檢測[11]。即分別以10%水合氯醛(30 mg/kg)腹腔麻醉,在靜電屏蔽室內采用Nicolet Compass系統測試ABR。ABR閾值即為觀察到有刺激反應的最低刺激水平和無刺激反應的最高水平。所有的ABR閾值測量都由同一個實驗者進行。
1.5 末端DNA轉移酶dUTP缺口末端標記(TUNEL)法檢測凋亡
耳蝸基底膜組織切片常規脫蠟至水,按照試劑盒說明書完成余下操作后,鏡下觀察耳蝸毛細胞凋亡情況,光鏡下400倍視野觀察拍照。細胞核呈綠色顆粒伴核形態不規則或固縮的即為凋亡細胞。
1.6 免疫熒光定量分析
按免疫熒光染色按試劑盒說明書操作,使用的一抗分別為稀釋濃度1∶50的多克隆兔抗LC3B(美國丹佛Cell Signaling Technology公司),1∶50的多克隆兔抗3-硝基酪氨酸(3-NT,美國比爾里卡EMD Millipore公司)。Alexa Fluor 594標記二抗的稀釋濃度為1∶200,Alexa Fluor 488標記的二抗的稀釋濃度為1∶100(美國Life Technologies公司)。所有切片均置于電子顯微鏡下觀察攝片,并使用ImageJ軟件量化處理。
1.7 Western blot
耳蝸基底膜組織切片經PBS清洗后按蛋白提取試劑盒說明書提取組織總蛋白,100 ℃變性5 min。然后各泳道等量蛋白進行十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)電泳分離蛋白并轉至聚偏氟乙烯(PVDF)膜。經5%的牛血清清蛋白(BSA)封閉1 h后加入相應的一抗(LC3-Ⅱ/LC3-Ⅰ、Beclin-1蛋白一抗),4 ℃過夜孵育。第2天加入相應二抗,室溫孵育1.5 h。最后加入發光液,以GAPDH為內參于凝膠成像儀進行曝光拍照并進行條帶灰度值分析。
1.8 統計學處理
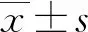
2 結 果
2.1 抑制自噬能夠降低ABR閾值
噪聲暴露后1、12、24 h檢測各組ABR閾值后發現,各組ABR閾值較暴露前升高。RAP組在噪聲暴露后1、12、24 h各時間點的ABR閾值較對照組均明顯增加;而3MA組在以上各時間點的ABR閾值較對照組則明顯減少(均P<0.05)。見圖1。
2.2 抑制自噬能夠抑制耳蝸毛細胞中自噬標志蛋白和ROS表達水平
在噪聲暴露后1、12、24 h分別檢測各組耳蝸毛細胞自噬標記蛋白LC3-Ⅱ/LC3-Ⅰ和Beclin-1發現,各組噪聲暴露后耳蝸毛細胞自噬標記蛋白表達水平明顯升高。RAP組噪聲暴露1、12、24 h耳蝸毛細胞自噬標記蛋白表達水平明顯高于對照組,而3MA組以上各時間點耳蝸毛細胞自噬標記蛋白表達水平則明顯低于對照組(均P<0.05),見圖2。為進一步驗證自噬表達與細胞程序性死亡的終末產物ROS水平的相關性,本研究檢測了噪聲暴露后1、12、24 h 3-NT水平后發現,噪聲暴露后耳蝸毛細胞3-NT水平明顯較暴露前增高,RAP組暴露1、12、24 h 3-NT水平較對照組增加;而3MA組以上各時間點3-NT水平較對照組減少(均P<0.05),見圖3。

a:P<0.05,b:P<0.05,與對照組比較。

A:Western blot;B:Western blot定量分析圖;a:P<0.05。
2.3 抑制自噬能夠抑制毛細胞凋亡發生
為驗證自噬是否會導致細胞程序性死亡,本研究檢測了噪聲暴露后24 h的細胞凋亡情況。結果發現噪聲暴露后各組耳蝸毛細胞凋亡較暴露前明顯增加,RAP組耳蝸毛細胞凋亡較對照組增加,而3MA組耳蝸毛細胞凋亡較對照組減少(均P<0.05),見圖4。

a:P<0.05。
3 討 論
耳蝸毛細胞屬高度分化的終末細胞,毛細胞作為聽覺傳入的重要神經信號傳導細胞,它的損傷程度直接反映了聽力的受損程度。但毛細胞一旦損傷凋亡,則無法再生,進而出現感音神經性耳聾。因此如何保護毛細胞避免噪聲性損傷導致毛細胞死亡成為防治噪聲性耳聾的首選策略。本研究發現,在噪聲性耳聾發生時,自噬表達明顯上調,OS標記物如3-NT水平明顯增加,進而導致毛細胞的程序性凋亡。抑制自噬能夠有效改善毛細胞的OS損傷,同時明顯抑制毛細胞凋亡的發生。
耳蝸毛細胞極易受到噪聲的損傷,既往研究證明噪聲引起OS,耳蝸組織蛋白3-NT水平明顯增加[10,12-13]。本研究進一步證明了這一結論,即噪聲暴露會導致OS,耳蝸毛細胞中3-NT的表達水平升高。值得注意的是盡管既往文獻同時發現OS導致細胞凋亡的發生,但其具體途徑仍未明確闡述[14-16]。OS的形成,如超氧化物、羥基自由基和一氧化氮,可能會根據壓力的不同機制而發生。噪聲暴露后耳蝸中OS系統激活的確切信號機制十分復雜。目前公認有以下幾種可能:超氧自由基的增加是由于其他自由基的連鎖反應形成,這一過程可能是由于線粒體氧化過程加強所致;組織末梢血管收縮引起的長時間組織缺氧也可能導致OS表達增加,或組織局部的缺血再灌注損傷[14,16]。但在噪聲性耳聾中針對毛細胞的損傷凋亡以上理論均有待商榷。
自噬也稱為Ⅱ型程序性細胞死亡,參與了許多退變性疾病的發生發展,如帕金森病、阿爾茨海默病等神經退行性疾病,骨性關節炎、風濕性關節炎等[17-19]。但在噪聲性耳聾中,自噬的具體作用機制仍存在爭議。自噬和OS的相關性仍缺乏系統研究。本研究揭示噪聲性耳聾急性期的自噬和OS的確切作用機制,結果表明,急性損傷期毛細胞的自噬表達明顯增加,誘導細胞通過OS系統進入程序性凋亡狀態。在抑制自噬表達后OS標記蛋白3-NT隨之下降,同時細胞凋亡數量也明顯降低。
綜上所述,強噪聲暴露后耳蝸毛細胞在急性損傷期通過自噬途徑誘導OS系統激活,進而誘導細胞程序性死亡。這一結論為噪聲性耳聾特別是急性期的防治提供了新的思路和研究方向。通過深入研究自噬和噪聲性耳聾的具體作用機制可以為防治噪聲性耳聾提供新的藥物作用靶點及基因治療策略。

