miR-328-5p通過調節自噬影響乳腺癌細胞對紫杉醇化療敏感性的機制
李建梅,孫靜宜,馬英橋,趙 月,李仕武
化療是乳腺癌臨床治療中不可缺少的重要治療手段之一,而紫杉醇(Taxol)是治療乳腺癌的常用一線化療藥物,在控制病情、延長患者生存時間方面具有較好效果[1-2]。但根據臨床對乳腺癌患者的隨訪追蹤調查,使用Taxol期間因發生耐藥性而限制了該藥物的應用,這使得其有效率僅為30%~70%,且效果不長久,一般只能持續6~10個月,同時增加了患者復發、轉移的風險,故在目前臨床抗腫瘤藥物有限的條件下,提高乳腺癌對Taxol的敏感性尤為重要[3-4]。隨著對微小RNAs(miRNAs)研究的不斷深入,miRNAs通過靶向其下游基因調節腫瘤多藥耐藥成為研究熱點。曾有研究顯示,miR-328在乳腺癌組織中低表達,且miR-328的過表達抑制了乳腺癌細胞增殖、耐藥性和細胞周期進展[5]。既往有文獻顯示,整合素家族中整合素α5(ITGA5)可誘導細胞自噬發生[6]。還有研究證實,miR-33a-5p可通過抑制自噬,進而提高乳腺癌細胞對放療的敏感性[7]。本文旨在分析miR-328-5p與ITGA5的關系及對乳腺癌Taxol敏感性的影響,進一步探討miR-328-5p調節乳腺癌化療耐藥的具體機制。
1 材料與方法
1.1主要試劑與儀器 胎牛血清及RPMI-1640培養基均購自美國Gibco公司,CCK-8試劑盒購自上海碧云天生物技術有限公司,Lipofectamine TM 2000轉染試劑盒購自美國Invitrogen公司,Matri-gel基質膠及細胞培養基均購自美國BD公司,miR-328-5p和miR-NC(批號:121547)均購自上海美軒生物科技有限公司,兔抗人ITGA5多克隆抗體購自博奧派克生物有限公司、兔抗人ITGA5單克隆抗體購自美國Abcam公司,siRNA陰性對照、siRNA干擾試劑盒均購自上海生工生物工程有限公司。PCR儀(Applied Biosystems ABI7500)、化學發光儀(Promega 30IOC)、凝膠成像系統(Bio-rad ChemiDoc XRS)、流式細胞儀及透射電鏡(Thermo fisher Spectra S/TEM)均購自美國,熒光顯微鏡(Olympus BX53)、光學顯微鏡(Olympus CX33)及相差顯微鏡(Olympus CKX53)均購自日本。
1.2方法
1.2.1細胞培養:乳腺癌MCF-7細胞購自美國ATCC細胞庫。MCF-7細胞于含體積分數為10%胎牛血清的RPMI-1640培養基中進行培養,過程中加入青霉素-鏈霉素,然后置于37 ℃、體積分數為5% CO2的培養箱中進行恒溫培養。根據細胞的生長速度及狀態,每2~3天更換培養基,待細胞長至對數生長期時,用0.25%的胰酶消化,然后進行傳代,或擴大培養,或進行試驗。最后用胰酶消化處于對數生長期的MCF-7細胞,1000 r/min離心10 min,棄上清液,向沉淀中加入細胞凍存液(含10%甲基亞砜的培養基),混懸細胞后將其轉移至細胞凍存管中,用封口膜封閉凍存管口,依次于4 ℃保存2 h,-20 ℃保存2 h,然后置于-80 ℃的低溫冰箱中過夜,次日將細胞凍存管轉移至液氮罐中長期保存。
1.2.2細胞轉染:選取生長狀態良好的乳腺癌MCF-7細胞,利用脂質體轉染技術分別使用miR-328-5p mimics和si-ITGA5轉染MCF-7細胞,用于后續實驗。
1.2.3實驗分組及處理:①miR-328-5p過表達時MCF-7細胞對Taxol敏感性:miR-NC組(轉染陰性對照)、miR-328-5p組(轉染miR-328-5p mimics)、miR-NC+Taxol組(轉染陰性對照后加入50 nmol/L的Taxol培養MCF-7細胞24 h)及miR-328-5p+Taxol組(轉染miR-328-5p mimics后加入50 nmol/L的Taxol培養MCF-7細胞24 h)。②干擾ITGA5后MCF-7細胞對Taxol敏感性:si-NC組(轉染陰性對照)、si-ITGA5組(轉染si-ITGA5)、si-NC+Taxol組(轉染陰性對照后分別加入5、50、100 nmol/L的Taxol培養MCF-7細胞24 h)和si-ITGA5+Taxol組(轉染si-ITGA5后分別加入5、50、100 nmol/L的Taxol培養MCF-7細胞24 h)。
1.2.4miR-328-5p、ITGA5 mRNA表達檢測:采用qRT-PCR檢測miR-328-5p、ITGA5 mRNA相對表達水平[8],使用RNA提取試劑盒從各組細胞中提取RNA,按照逆轉錄試劑盒Prime Script RT Reagent Kit和SYBR Prime Script miRNA RT-PCR Kit 試劑盒進行逆轉錄和qRT-PCR。通過計算機系統自動分析各個樣本Ct值,采用2-ΔΔCt計算miR-328-5p、ITGA5 mRNA的相對表達量。
1.2.5細胞增殖:采用CCK-8實驗檢測細胞增殖情況[9],取各組對數生長期的MCF-7細胞胰酶消化后用牛鮑計數板計數。以每孔3000個細胞將不同濃度Taxol(5、50、100 nmol/L)處理的MCF-7細胞分別鋪于96孔板中,培養48 h,加入10 μl CCK-8試劑,室溫孵育4 h,使用酶標儀測定450 nm處OD值并計算MCF-7細胞增殖抑制率,增殖抑制率(%)=(1-實驗組OD值/對照組OD值)×100%。
1.2.6細胞凋亡:采用Annexin-FITC/PI雙染法檢測各組MCF-7細胞凋亡情況[10],細胞經轉染處理后,胰酶消化收集細胞,PBS洗滌,加入5 μl Annexin V-FITC和5 μl PI試劑室溫避光孵育30 min后,190 μl結合緩沖液洗滌,1000 r/min離心5 min,使用PBS重懸細胞上機應用流式細胞術檢測。記錄汞激發波長488 nm處紅色熒光。計數1000個細胞,計算細胞凋亡率,凋亡率=早期凋亡率+晚期凋亡率。
1.2.7ITGA5、微管相關蛋白1輕鏈3B(LC3B)及p62蛋白相對含量:采用Western Blot方法[11]測定ITGA5、LC3B及p62蛋白相對含量,使用蛋白提取試劑盒提取細胞總蛋白,通過BCA法測定蛋白濃度,根據目的蛋白和內參灰度值之比分析轉染miR-328-5p及干擾ITGA5表達前后ITGA5、LC3B及p62蛋白的相對含量。
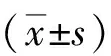
2 結果
2.1miR-328-5p轉染效率 qRT-PCR檢測結果顯示,經轉染后,miR-NC組和miR-328-5p組中miR-328-5p的相對表達量分別為1.08±0.02、127.64±3.07。轉染miR-328-5p mimics后MCF-7細胞中miR-328-5p相對表達量顯著提高,約為miR-NC組的118倍,比較差異具有統計學意義(P<0.01)。
2.2miR-328-5p對乳腺癌MCF-7細胞自噬水平的影響 miR-328-5p組、miR-NC+Taxol組LC3B-Ⅱ/LC3B-Ⅰ值顯著低于miR-NC組,p62蛋白含量顯著高于miR-NC組,差異有統計學意義(P<0.05);miR-328-5p+Taxol組LC3B-Ⅱ/LC3B-Ⅰ值均低于miR-NC+Taxol組和miR-328-5p組,p62蛋白含量均高于miR-NC+Taxol組和miR-328-5p組,差異有統計學意義(P<0.05)。見表1。
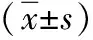
表1 miR-328-5p對乳腺癌MCF-7細胞自噬水平的影響
2.3miR-328-5p對乳腺癌MCF-7細胞ITGA5 mRNA及蛋白表達的影響 miR-328-5p組、miR-NC+Taxol組ITGA5 mRNA及蛋白表達均低于miR-NC組,差異有統計學意義(P<0.05);miR-328-5p+Taxol組ITGA5 mRNA及蛋白表達顯著低于miR-NC+Taxol組和miR-328-5p組,差異有統計學意義(P<0.05)。見表2。
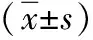
表2 miR-328-5p對乳腺癌MCF-7細胞ITGA5 mRNA及蛋白表達的影響
2.4干擾ITGA5后乳腺癌MCF-7細胞ITGA5 mRNA及蛋白表達情況 qRT-PCR分析顯示,si-ITGA5組ITGA5 mRNA及蛋白表達水平分別為0.38±0.11及0.24±0.06,si-NC組分別為1.19±0.33及0.64±0.11。si-ITGA5組ITGA5 mRNA及蛋白表達水平顯著低于si-NC組,差異有統計學意義(P<0.05)。
2.5干擾ITGA5后Taxol對MCF-7細胞自噬的影響 si-ITGA5組、si-NC+Taxol組(50 nmol/L)LC3B-Ⅱ/LC3B-Ⅰ值顯著低于si-NC組,而p62蛋白含量顯著高于si-NC組,差異有統計學意義(P<0.05)。si-ITGA5+Taxol組(50 nmol/L)LC3B-Ⅱ/LC3B-Ⅰ值均低于si-ITGA5組和si-NC+Taxol組,p62蛋白含量均高于si-ITGA5組和si-NC+Taxol組,差異有統計學意義(P<0.05)。見表3。
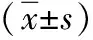
表3 干擾ITGA5后Taxol對乳腺癌MCF-7細胞自噬水平的影響
2.6干擾ITGA5后不同濃度Taxol對乳腺癌MCF-7細胞增殖、凋亡的影響 不同Taxol濃度時,si-ITGA5+Taxol組乳腺癌MCF-7細胞增殖抑制率及凋亡率均顯著高于si-NC+Taxol組,差異統計學意義(P<0.05)。Taxol濃度50 nmol/L、100 nmol/L時,si-NC+Taxol組、si-ITGA5+Taxol組乳腺癌MCF-7細胞增殖抑制率及凋亡率均顯著高于Taxol濃度5 nmol/L時,且Taxol濃度100 nmol/L時兩組上述指標顯著高于50 nmol/L時,差異有統計學意義(P<0.05)。見表4。

表4 干擾ITGA5后不同濃度Taxol對乳腺癌MCF-7細胞增殖、凋亡的影響
3 討論
乳腺癌是女性最常見的惡性腫瘤,在女性癌癥所致死亡中居首位[12-13]。流行病學數據顯示,2018年全世界有210萬左右新診斷乳腺癌病例,約占女性腫瘤病例的25%[14]。蒽環類藥物、紫杉烷類藥物和DNA損傷劑(環磷酰胺、氟尿嘧啶或鉑類化合物)是臨床上治療乳腺癌的主要化療藥物。大量臨床試驗證明,Taxol是一種能抑制微管聚合從而抑制有絲分裂的天然藥物,能顯著提高乳腺癌患者的存活率,已成為乳腺癌輔助化療的一線藥物,然而近年來臨床亦有不少文獻報道患者在接受紫杉醇治療后出現藥物耐受,最終導致治療失敗[15-18]。
細胞自噬屬于Ⅱ型程序性細胞死亡,屬于機體抵御不良環境的一種自我保護機制,是通過隔離膜包裹細胞質和(或)細胞器形成自噬體,然后與溶酶體融合形成自噬溶酶體并在其中發生降解的過程,對維持細胞穩定有著較好的作用。隨著生物學研究的不斷深入,有研究提出,在腫瘤發生、進展過程中,細胞自噬起著關鍵作用,還可參與腫瘤化療藥物細胞毒性的發揮[19]。本組結果顯示,轉染miR-328-5p后,miR-328-5p組LC3B-Ⅱ/LC3B-Ⅰ值顯著低于miR-NC組,而p62蛋白含量顯著高于miR-NC組,且miR-328-5p+Taxol組上述指標較miR-NC+Taxol組更低或更高。由此提示,miR-328-5p的過度表達可抑制乳腺癌MCF-7細胞自噬作用。LC3B是與細胞自噬活性密切相關的基因,曾有文獻證實,LC3B-Ⅰ的低表達與非小細胞肺癌的發生、進展密切相關[20]。本文進一步研究發現,經干擾ITGA5后發現,MCF-7細胞內ITGA5 mRNA及蛋白表達顯著降低,且si-ITGA5組LC3B-Ⅱ/LC3B-Ⅰ值顯著低于si-NC組,而p62蛋白含量顯著高于si-ITGA5組,因此ITGA5表達與細胞的自噬也有著一定聯系。ITGA5是整合素家族的重要成員,可與ITGβ1結合形成二聚體,是基質重要成分纖維連接蛋白的受體。近年來,ITGA5可通過調節細胞自噬和凋亡增加癌細胞對化療藥物敏感性的觀點被不少學者提出[21],但尚未明確,僅有報道證實,ITGA5可誘導自噬作用發生[22]。本文進一步分析miR-328-5p與ITGA5的關系發現,經轉染miR-328-5p后,乳腺癌MCF-7細胞內ITGA5 mRNA及蛋白表達含量顯著降低。且在先前研究基礎上,本文將干擾ITGA5與Taxol聯合處理乳腺癌MCF-7細胞發現,不同Taxol濃度時,si-ITGA5+Taxol組細胞增殖抑制率及凋亡率均顯著高于si-NC+Taxol組,且隨著Taxol濃度升高細胞增殖抑制率及凋亡率均呈上升趨勢。提示干擾ITGA5后乳腺癌MCF-7細胞對Taxol的敏感性增強。因此,干擾ITGA5的表達可通過抑制細胞的自噬作用和誘導細胞凋亡,從而提高MCF-7細胞對Taxol的敏感性。
miR-328-5p可增強乳腺癌MCF-7細胞對化療藥物Taxol的敏感性,作用機制可能與miR-328-5p通過抑制ITGA5表達,從而抑制細胞自噬相關。

