芍藥苷靶向鈣激活氯通道TMEM16A減少NFκB活化治療急性胰腺炎
王清華,姚 旭,魏新智,鞠業濤,閔冬雨
(遼寧中醫藥大學附屬醫院,沈陽 110033)
鈣激活氯通道(CaCCs)很早就已被人們研究,直到2008年才證明跨膜蛋白16A(transmembrane protein 16A,TMEM16A,也被稱為anoctamin1)是鈣激活氯通道的分子基礎。該通道的特征是:一方面受細胞膜電壓調節,表現為電流的外向整流特性;另一方面它與細胞漿的鈣離子濃度相關,表現為鈣離子濃度依賴性激活。TMEM16A通道受鈣離子結合位點變構調節來控制通道的開關。課題組前期研究發現,在AP動物和細胞模型中,TMEM16A蛋白表達上調;TMEM16A高表達促進胰腺炎的發生發展,提示TMEM16A可能成為治療AP新靶標[1]。
芍藥苷是芍藥的主要藥效成分,具有廣泛的抗炎抗免疫作用[2]。研究[3]發現,芍藥苷對AP模型大鼠具有治療作用。然而芍藥苷治療急性胰腺炎的機制不清。課題組前期研究發現,芍藥苷可抑制AP時腺泡細胞內的TMEM16A蛋白,據此本研究以TMEM16A為切入點,研究芍藥苷抑制TMEM16A治療AP的可能作用機制,為芍藥苷治療AP提供理論基礎。
1 材料
1.1 細胞
大鼠胰腺腺泡細胞AR42J購于美國ATCC公司。
1.2 藥品與試劑
芍藥苷(北京索萊寶科技有限公司,批號為SP8030);雨蛙肽(美國Sigma公司,批號為C9026);大鼠TNF-α和IL-6 ELISA試劑盒(武漢伊萊瑞特生物科技股份有限公司,批號分別為 E-ELR2856c和 E-EL-R0015c);TMEM16A抗體(美國abcom公司,批號為ab191040);山羊抗兔二抗(美國abcom公司,批號為ab205718); Lipofectamine 2000轉染試劑(美國Invitrogen公司,批號為11668-019);CCK8細胞增殖和毒性檢測試劑盒(北京索萊寶科技有限公司,批號為CA1210);胎牛血清(fetal bovine serum,FBS)(美國Gibco公司,批號為10270-106)、RPMI1640培養基(美國Gibco公司,批號為12633012);RIPA裂解液(強)(上海碧云天生物技術有限公司,批號為P0013B);BCA蛋白濃度測定試劑盒(增強型) (上海碧云天生物技術有限公司,批號為P0010S)。
1.3 儀器
Axopatch 2008膜片鉗放大器/Digidata1322A/pClamp9(美國AXON公司);P-2000 微電極拉制儀(美國Sutter公司);Bio-Rad Mini-Protean 小型垂直電泳轉印系統(美國伯樂);二氧化碳培養箱(美國Thermo 公司);Epoch酶標儀(美國BioTek公司);Bio-rad chemidoc xr+凝膠成像系統(美國伯樂)。
2 方法
2.1 細胞培養
大鼠腺泡細胞AR42J購買于ATCC公司,采用含10% 胎牛血清及1% 的100 nm青鏈霉素的1640細胞培養液,于37 ℃,5% CO2培養箱中進行細胞培養,每天觀察細胞生長狀態,3 d換液1次。
2.2 芍藥苷對細胞活力的影響
將指數生長的AR42J以1×104個/孔接種在96孔細胞培養板內,用不同濃度的芍藥苷(0 μmol·L-1、1 μmol·L-1、5 μmol·L-1、10 μmol·L-1、20 μmol·L-1、50 μmol·L-1)分別處理細胞,每組設8個復孔,24 h后,每孔加入10 μL 的CCK8試劑,避光孵育2 h,在490 nm 波長時測定各孔的吸光度,觀察不同濃度芍藥苷對細胞活力的影響。
2.3 細胞分組及給藥
將對數生長的AR42J細胞分為對照組、模型組及芍藥苷治療組,芍藥苷預處理30 min后,模型組和芍藥苷治療組細胞用雨蛙肽(10-8mol·L-1)作用24 h。取細胞上清液用于ELISA檢測,細胞用PBS清洗后,提取細胞總蛋白用于Western blot 蛋白檢測。
2.4 ELISA檢測
細胞上清液于4℃,3000 rpm·min-1離心15 min,取上清液,放置在-80℃冰箱保存,用于TNF-α和IL-6的含量檢測。實驗過程嚴格按照試劑盒說明書操作,最終在450 nm 波長處測定各孔的吸光度,計算細胞因子的含量。
2.5 Western blot蛋白印記
細胞總蛋白用RPIA裂解液提取,BCA法進行蛋白定量,采用10% SDS凝膠進行電泳,轉膜,封閉后在4℃冰箱中進行一抗孵育過夜(TMEM16A一抗稀釋比例為1:2 000,p-NFκB為1:1 000)。二抗于室溫孵育1 h,用ECL化學發光法進行成像分析。實驗重復3次。
2.6 膜片鉗記錄TMEM16A鈣激活氯電流
將帶有EGFP的TMEM16A質粒用Lipofectamine 2000轉染到HEK293細胞中,轉染48 h后,在熒光顯微鏡下定位轉染成功的細胞進行全細胞膜片鉗方法記錄電流,電極電阻為2~4 M?。細胞電壓鉗制在0 mV,刺激電壓為100 mV~+100 mV,步階電壓20 mV,刺激時間為700 ms。在1 μmol·L-1細胞內鈣離子時記錄不同電壓和不同時間點電流值。
2.7 分子模擬對接
利用分子對接技術方法,以TMEM16A為受體,采用 MOE (Molecular Operating Environment)2015.1001 軟件包中的 DOCK 模塊分析芍藥苷分子與TMEM16A通道蛋白間的相互作用,及其作用的空間作用模式。找出芍藥苷與TMEM16A通道蛋白作用可能的關鍵氨基酸位點。
2.8 統計學方法
采用SPSS 17.0統計軟件對數據進行統計學分析。統計結果用均數±標準差(±s)表示,2組組間比較采用t檢驗;以P<0.05為差異具有統計學意義。
3 結果
3.1 芍藥苷對細胞活力影響
應用CCK8對芍藥苷處理的AR42J細胞進行細胞活力檢測。結果顯示<20 μmol·L-1的芍藥苷對細胞生長明顯沒有影響(P>0.05),當濃度為50 μmol·L-1,出現了細胞活力下降(P<0.05),因此將20 μmol·L-1作為后續實驗濃度。
3.2 芍藥苷減少AP細胞炎性水腫,減少上清液中的炎癥細胞因子生產
AR42J細胞用芍藥苷預處理30 min 后,再經雨蛙肽10-8mol·L-1作用24 h,鏡下可見,對照組AR42J細胞呈纖維狀或卵圓形生長,聚集狀增殖,細胞周圍能合成分泌少量胰酶顆粒,模型組經雨蛙肽處理后,細胞出現顯著變圓,體積增大,亮度增加,細胞團周圍可見大量顆粒狀分泌物的炎癥改變;經芍藥苷治療后,與雨蛙肽模型組相比較,細胞水腫形態顯著減輕,細胞周圍分泌顆粒減少,提示芍藥苷能減少AR42J炎性水腫,減少細胞酶原顆粒的分泌,減輕細胞的炎癥反應(見圖1)。對細胞培養上清液中的炎癥因子檢測結果顯示,與對照組相比,雨蛙肽模型組作用24 h后,細胞上清液中TNF-α和IL-6的含量顯著上升,差異有統計學意義(P<0.05)。與模型組相比,經芍藥苷治療后,TNF-α和IL-6的含量明顯降低,差異有統計學意義(P<0.05)(見表1)。
表1 芍藥苷可減少腺泡細胞炎癥時TNF- α 和IL-6 生成比較(±s )
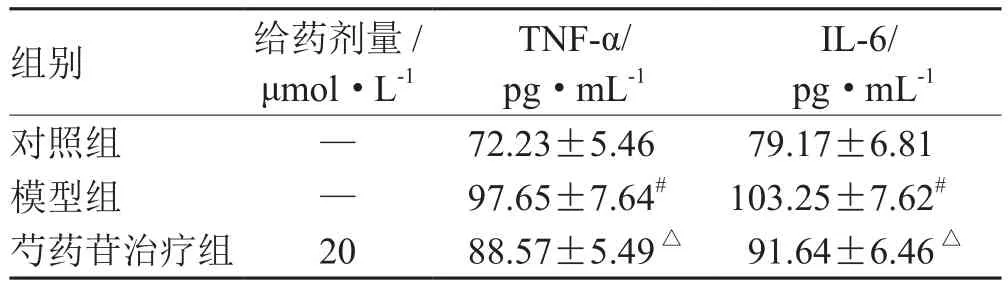
表1 芍藥苷可減少腺泡細胞炎癥時TNF- α 和IL-6 生成比較(±s )
注:與對照組比較,# P<0.05;與模型組比較,△P<0.05
組別 給藥劑量/μmol·L-1 TNF-α/pg·mL-1 IL-6/pg·mL-1對照組 — 72.23±5.46 79.17±6.81模型組 — 97.65±7.64# 103.25±7.62#芍藥苷治療組 20 88.57±5.49△ 91.64±6.46△
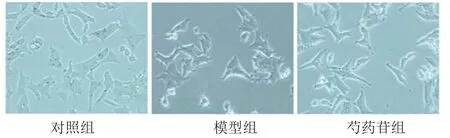
圖1 芍藥苷可減輕腺泡細胞的炎癥反應
3.3 芍藥苷對胰腺炎性腺泡細胞TMEM16A具有抑制作用
AR42J細胞用芍藥苷預處理30 min后,再經雨蛙肽10-8mol·L-1作用24 h,檢測細胞蛋白中TMEM16A蛋白表達。結果顯示,與對照組相比,雨蛙肽誘導腺泡細胞炎癥時,TMEM16A蛋白表達明顯升高;經芍藥苷治療后,與模型組相比,TMEM16A蛋白表達明顯下降。提示芍藥苷具有抑制TMEM16A蛋白作用(見圖2)。
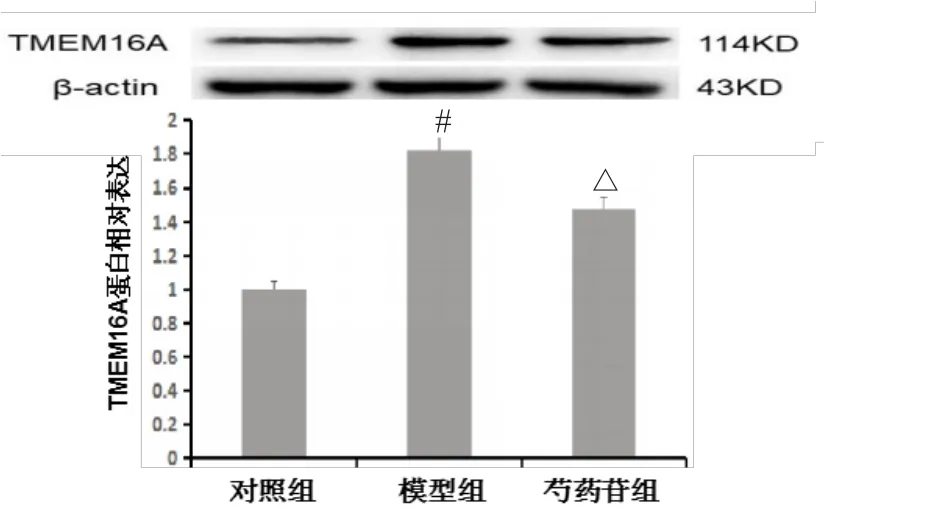
圖2 芍藥苷能抑制急性胰腺炎細胞中TMEM16A蛋白表達
3.4 芍藥苷通過TMEM16A抑制腺泡細胞內NFκB的活化
過表達TMEM16A質粒用lipofectine 2000轉染到AR42J細胞中,轉染24 h后,用芍藥苷(20 μmol·L-1)處理轉染的細胞 24 h后,提取細胞總蛋白,進行Western blot 檢測細胞內NFκB的活化程度。結果顯示,在AR42J細胞中過表達TMEM16A后,NFκB磷酸化程度增加;再經芍藥苷處理后,抑制了TMEM16A 促NFκB磷酸化程度(見圖3)。
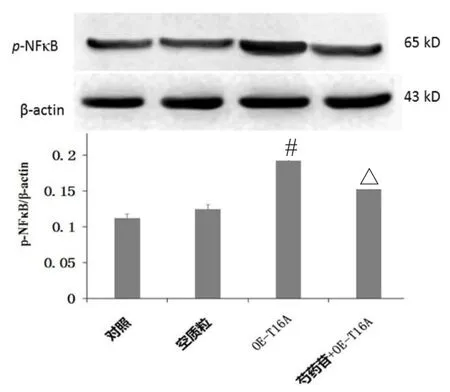
圖3 芍藥苷通過TMEM16A抑制NFκB磷酸化
3.5 芍藥苷對TMEM16A通道電流的抑制作用
將帶有EGFP的過表達TMEM16A質粒用lipofectine 2000 轉染到HEK293細胞中,轉染48 h后,在熒光顯微鏡下定位轉染成功的細胞進行電流記錄。1 μmol·L-1細胞內鈣離子時記錄不同電壓和不同時間點電流值。結果顯示,100 mV電壓下記錄的不同時間TMEM16A電流值進行均一化處理,Inormalized=It/Imax(It 為不同時間點的電流值,Imax為記錄最大電流值)。芍藥苷處理后,TMEM16A電流明顯被抑制,抑制率約為55%(見圖4 A)。給藥前不同電壓不同時間點所記錄的電流圖,與之相比,給芍藥苷(20 μmol·L-1)后再次記錄,在相同電壓的TMEM16A電流值明顯減小(見圖4 B)。
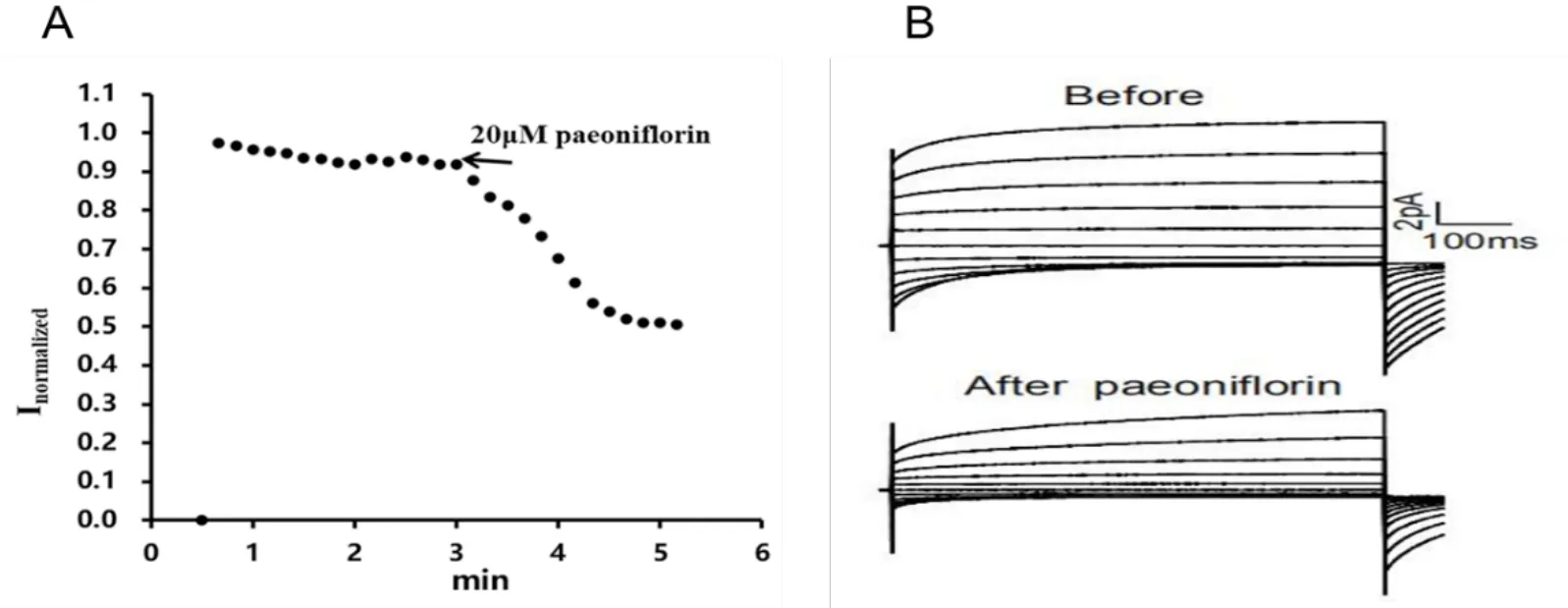
圖4 芍藥苷對TMEM16A電流的抑制作用
3.6 芍藥苷分子與TMEM16A蛋白的分子模擬對接
利用 MOE(Molecular Operating Environment)2015.1001 軟件包中的 DOCK 模塊,以 TMEM16A(PDB ID:6BGI)為受體,與芍藥苷進行分子模擬對接(見圖5)。結果顯示,芍藥苷分子能與TMEM16A蛋白通過不同的化學鍵進行緊密結合。根據構象分析和分子對接模擬技術,初步篩選出芍藥苷與TMEM16A蛋白結合的三個重要氨基酸殘基為Arg373、Leu627和Asp812。
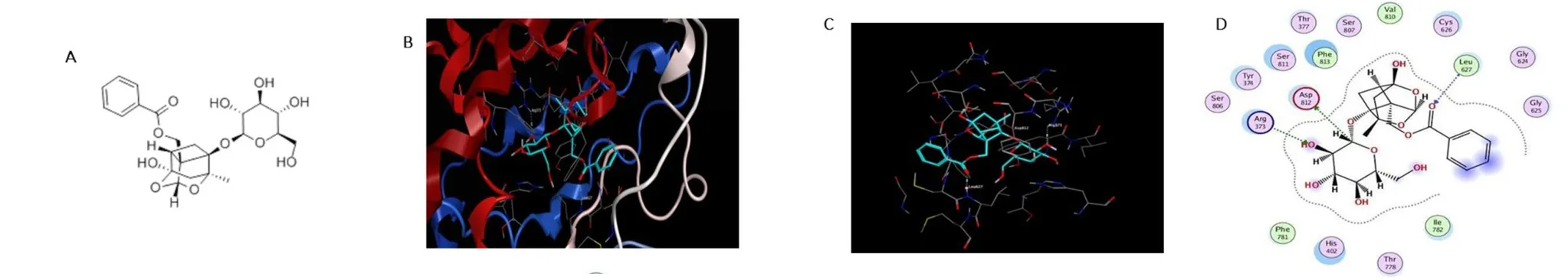
圖5 芍藥苷與TMEM16A分子模擬對接
4 討論
近年來的研究發現,鈣激活氯通道TMEM16A具有廣泛的生理功能,如TMEM16A參與唾液腺、胰腺、呼吸道及腸道上皮細胞的氯離子分泌,調節心肌等興奮性細胞的動作電位形成和血管平滑肌細胞的收縮功能[4]等。關于TMEM16A參與疾病的病理生理功能的研究亦成為研究熱點,TMEM16A異常會導致哮喘、高血壓、胃腸道運動障礙和癌癥等多種疾病[5]。深入研究其病理生理功能,可能成為很多疾病病理機制研究的重要靶標蛋白,也可能成為治療疾病的潛在靶標分子。
在炎性疾病中研究發現,TMEM16A作為陰離子通道,參與了很多炎癥的發病過程:1)中慢性鼻竇炎伴鼻息肉(CRSwNP)患者中TMEM16A通過EGF-PI3K-TMEM16A信號通路上調MUC5AC表達參與該病的病變進展[6];2)在心肌細胞中特異性抑制TMEM16A可抑制NLRP3炎性小體炎癥信號的激活,從而保護小鼠心肌缺血再灌注損傷[7];3)哮喘及其他過敏性炎癥中,TMEM16A可導致黏液高分泌和支氣管收縮,特異性抑制TMEM16A減少粘液的產生和分泌,以及支氣管收縮,同時可減輕炎癥介質的釋放[8]。AP是常見的胰腺病變,本課題組前期研究發現,TMEM16A參與了急性胰腺炎的病理進程。研究發現腺泡細胞中TMEM16A在嘌呤能刺激下,從胞質重新定位到腔膜,產生分泌電位[9];其過程受到鈣調蛋白調節,參與胰腺管腔內酸性化,此過程可能參與急性胰腺炎的發生發展[10]。
芍藥苷具有廣泛的抗炎抗免疫作用,通過多種機制參與炎癥的發生發展:如芍藥苷通過抑制NLRP3炎癥小體激活,改善LPS誘導的炎癥和神經性疼痛[11];芍藥苷可部分通過腸道微生物群—上皮細胞自噬軸來緩解結腸炎[12]。本研究發現,芍藥苷能夠抑制急性胰腺炎腺泡細胞上TMEM16A通道蛋白,抑制NFκB磷酸化程度,減少炎癥因子的生產作用;同時發現芍藥苷可抑制TMEM16A鈣激活氯電流作用,通過分子模擬對接方式發現芍藥苷與TMEM16A蛋白具有直接結合位點,其中TMEM16A蛋白的Arg373,Leu627和Asp812是其結合的三個關鍵氨基酸殘基。下一步將通過位點定向突變方法,對關鍵氨基酸殘基進一步研究。

