4 ℃液態保存對奶山羊精子超微結構的影響
韓亞雯,賴貞霖,張夢美,趙慧英,劉騰飛*
(1.西北農林科技大學動物醫學院,楊凌 712100;2.惠農區動物疾病預防控制中心,石嘴山 753600)
奶山羊作為重要的奶畜之一,近幾年倍受重視,產業發展形勢良好,已成為地方畜牧經濟的支柱產業。然而,由于良種繁育體系缺乏、選育工作滯后等因素,我國部分地區奶山羊個體小、產奶量低、泌乳期短,嚴重制約了該產業的健康發展[1]。當前,要充分發揮我國現有少數高產優質奶山羊品種在改造低產奶山羊中的作用,就必須借助人工授精的方法,而作為其核心環節的精液保存就成為加速我國奶山羊品種改良和培育的關鍵技術[2]。
精液保存分為冷凍保存和液態保存,冷凍保存能夠實現精液的長期保存,但凍融過程會引起精子生理生化指標異常、受精能力和存活率下降,降低繁殖成功率[3]。液態保存是在非冷凍的液態條件下實現的,不僅工藝操作簡便、利于運輸,更重要的是能減少凍融過程對精子的損傷,是精液保存較為理想的方式[4]。但是,液態保存時間短,精子活力下降迅速,極大限制了該技術的發展和推廣,因此迫切需要探明影響液態保存效果的關鍵因素[5]。大量研究表明,精子結構損傷是影響精子液態保存質量的重要因素[6-7]。電子顯微鏡技術已被廣泛用于精子形態學研究,到目前為止,已報道人[8]、犬[9]和羊[10]等精子冷凍保存過程中的超微結構損傷,但鮮有報道涉及液態保存中奶山羊精子超微結構變化。
本研究采集關中奶山羊精液并進行4 ℃液態保存,利用伊紅染色檢測精子活率變化,掃描電子顯微鏡(scanning electron microscope,SEM)和透射電子顯微鏡(transmission electron microscope,TEM)觀察精子超微結構改變,研究結果為闡明影響奶山羊精子液態保存質量的相關機制提供形態學依據。
1 材料與方法
1.1 主要試劑及儀器設備
1.1.1 主要試劑 Tris、果糖、檸檬酸、青霉素、鏈霉素購自杭州弗德生物公司;常規生化試劑購自上海碧云天生物技術有限公司。
1.1.2 主要儀器 自動熒光顯微鏡(LECIA DM6B)、場發射SEM(Nano SEM-450)、臨界點干燥儀(EM CPD300)、TEM(TECNAI G2 SPIRIT BIO)、徠卡修塊機(EM TRIM2)、超薄切片機(EM UC7)。
1.2 試驗方法
1.2.1 奶山羊精液采集 選取6只2~3歲、繁殖性能良好、健康的雄性關中奶山羊(陜西省千陽縣種羊場),采用假陰道法收集新鮮精液,精子濃度大于3×109個·mL-1、精子活力在90%以上的精液用于試驗。
1.2.2 精液稀釋與4 ℃液態保存 合格精液用37 ℃稀釋液(Tris:36.3 mg·mL-1;果糖:5.0 mg·mL-1;檸檬酸:19.9 mg·mL-1;蛋黃:100 mL·L-1;青霉素:50 IU·mL-1;鏈霉素:1 mg·mL-1)稀釋至3×108個·mL-1,緩慢降溫至4 ℃,并開始計算保存時間。每隔24 h收集精液樣品,以精子活率>50%計為有效液態保存期。
1.2.3 伊紅染色檢測精子活率 各組精液樣品稀釋至3×106個·mL-1,每組設置5個生物學重復。精液樣品和伊紅染色液以1∶1比例混合均勻,LECIA DM6B顯微鏡觀察。
1.2.4 SEM和TEM觀察精子超微結構 基于伊紅染色結果,選取0、48、96 h精液樣品在SEM和TEM下觀察超微結構,每組設置3個生物學重復。精液樣品用PBS緩沖液洗滌3次,2.5%戊二醛4 ℃固定24 h。乙醇梯度脫水后臨界點干燥儀干燥3 h、粘臺、噴金和上樣,場發射SEM觀察。1%鋨酸固定1.5 h,精子經乙醇梯度脫水并用白膠浸潤,滲透包埋。采用超薄切片機切片,2%醋酸雙氧鈾和檸檬酸鉛避光處理10 min,TEM觀察。
1.3 統計分析
試驗數據以“平均值±標準誤(Mean±SEM)”表示,使用SPSS 20.0軟件進行分析,通過單因素方差分析檢驗數據差異性,以P<0.05為差異顯著性判斷標準。
2 結 果
2.1 4 ℃液態保存中奶山羊精子活率變化
伊紅染色檢測4 ℃液態保存中奶山羊精子活率,結果顯示:隨著保存時間延長,精子活率逐漸降低(圖1)。0 h精子活率為95.4%;與0 h相比,保存至24 h后,精子活率均顯著降低(P<0.05),144 h的精子活率小于50%。基于以上結果,收集0、48、96 h精液樣品進行后續超微結構研究。

A~G.分別為0、24、48、72、96、120和144 h精子染色圖;H.精子活率,柱上不同字母表示差異顯著(P<0.05)
2.2 SEM觀察4 ℃液態保存中奶山羊精子超微結構變化
SEM觀察4 ℃液態保存至0、48、96 h奶山羊精子超微結構(圖2)。0 h時,精子頭、頸、尾部形態結構正常,頭部為扁卵圓形,由細胞核和頂體組成,頂體完整,邊界清晰光滑,尾部(中段、主段、末端)結構完好(圖2A);保存至48 h,部分精子出現畸形,表現為精子窄頭(圖2B),尾部斷裂卷曲(圖2C),結構損傷精子為34.7%(圖2G);保存至96 h,精子頂體破損(圖2D),尾部主段斷裂(圖2E),尾部中段線粒體鞘腫脹(圖2F),結構損傷精子大于60%(圖2G)。
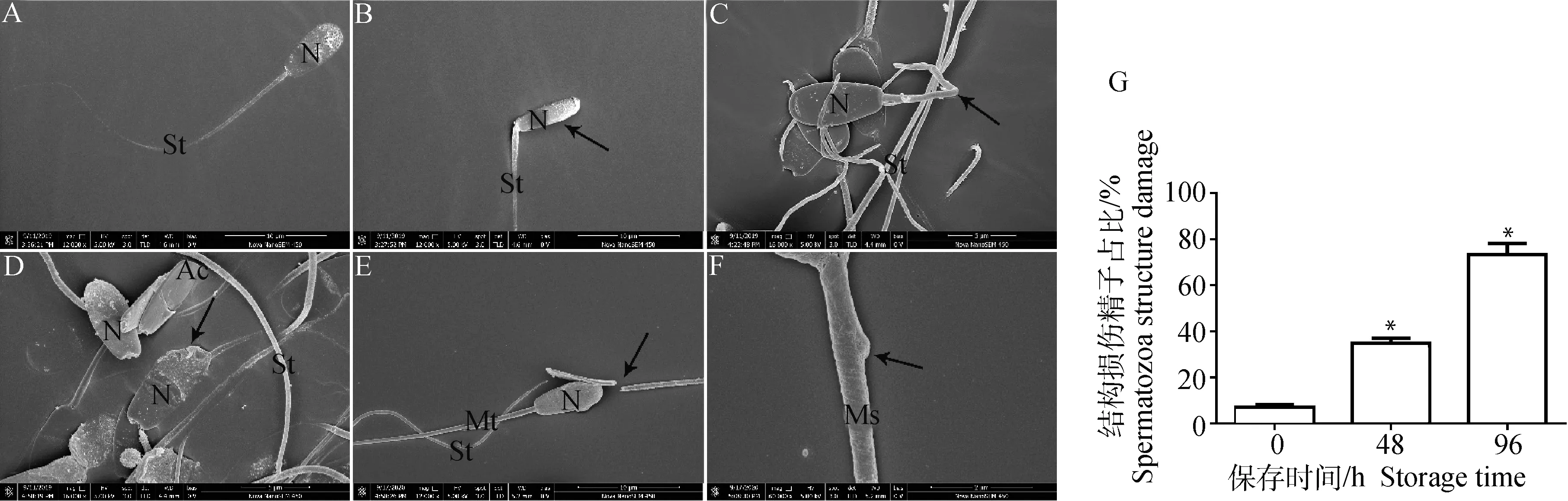
A.0 h,形態正常精子,比例尺=10 μm;B.48 h精子形態,箭頭指向窄頭,比例尺=10 μm;C.48 h精子形態,箭頭指向尾部斷裂卷曲,比例尺=5 μm;D.96 h精子形態,箭頭指向頂體破損,比例尺=5 μm;E.96 h精子形態,箭頭指向主段斷裂,比例尺=10 μm;F.96 h精子形態,箭頭指向線粒體鞘腫脹,比例尺=2 μm;G.結構損傷精子所占比例,* P<0.05與0 h對比。N.核,Ac.頂體,St.精子尾部,Ms.線粒體鞘。下同
2.3 TEM觀察4 ℃液態保存中奶山羊精子超微結構變化
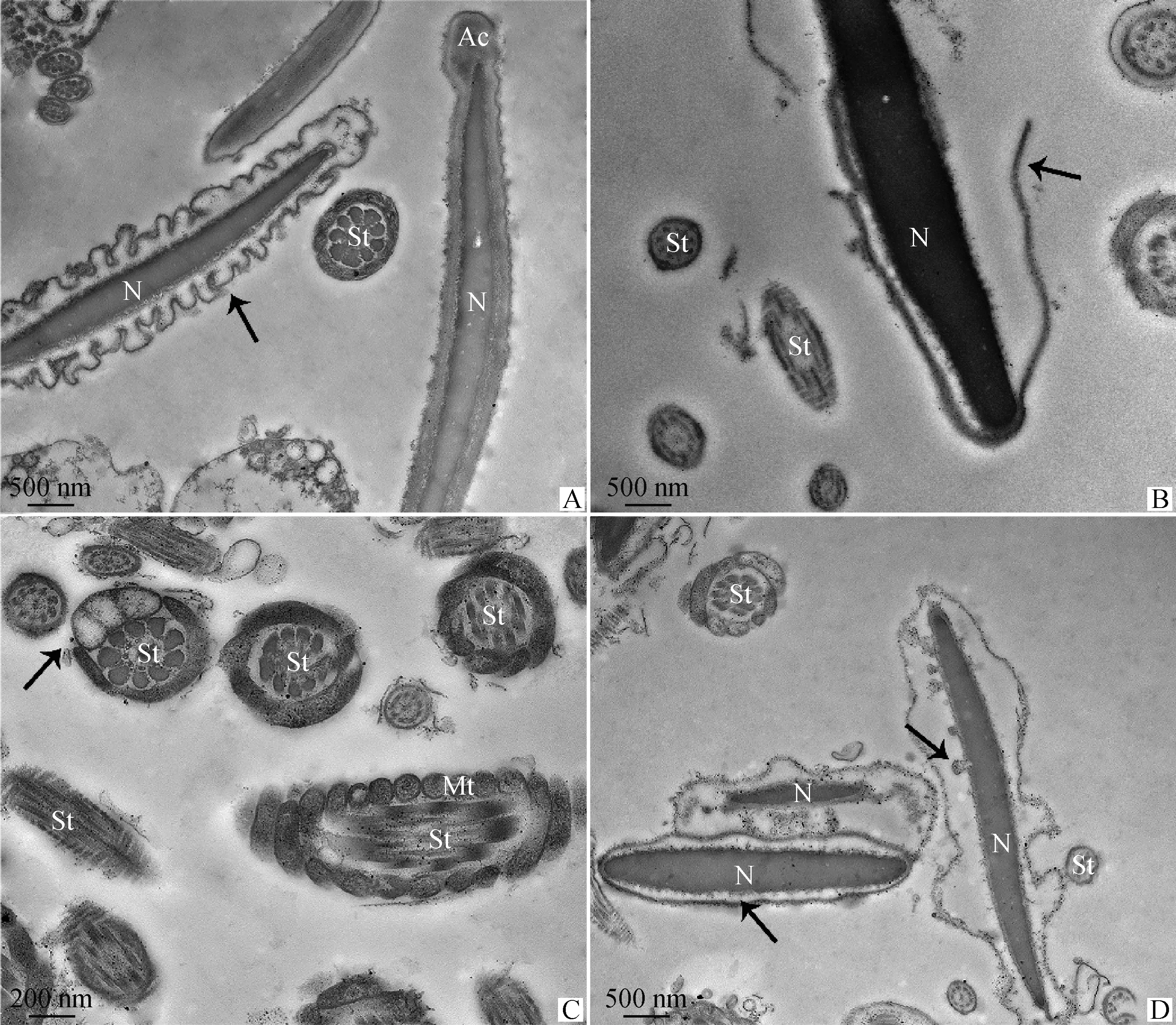
TEM觀察4 ℃液態保存中奶山羊精子超微結構變化(圖3~5)。0 h時奶山羊精子形態結構正常(圖3),頭部質膜完整光滑,頂體內膜與核膜緊密結合,核染色質電子密度均勻(圖3A、3B)。精子尾部結構完好,中段線粒體鞘結構完整,包裹的軸絲清晰可見,外包質膜,線粒體排列規則、分布均勻、形態大小正常(圖3C)。保存至48 h,結構損傷精子所占比例為41.3%(圖6),部分精子核膜膨脹折疊呈花環狀(圖4A),質膜破損(圖4B),核表面形成針狀突起(圖4D),線粒體腫脹、形態大小不一(圖4C)。保存至96 h,60.7%精子出現結構損傷(圖6),部分精子表現為核電子密度減低并崩解碎裂(圖5A、5B),核畸形(圖5D),線粒體缺失、排列混亂或位置異常(圖5B、5C)。部分精子出現典型凋亡形態特征,如:核表面形成針狀突起(圖4D),核周出現囊性空泡和凋亡小體(圖4D、5D)。

A.0 h,形態正常精子;B~C.0 h,形態正常精子
A.48 h精子形態,箭頭指向核膜膨脹折疊;B.48 h精子形態,箭頭指向質膜破損;C.48 h精子形態,箭頭指向線粒體腫脹;D.48 h精子形態,箭頭指向核表面針狀突起,囊性空泡和凋亡小體
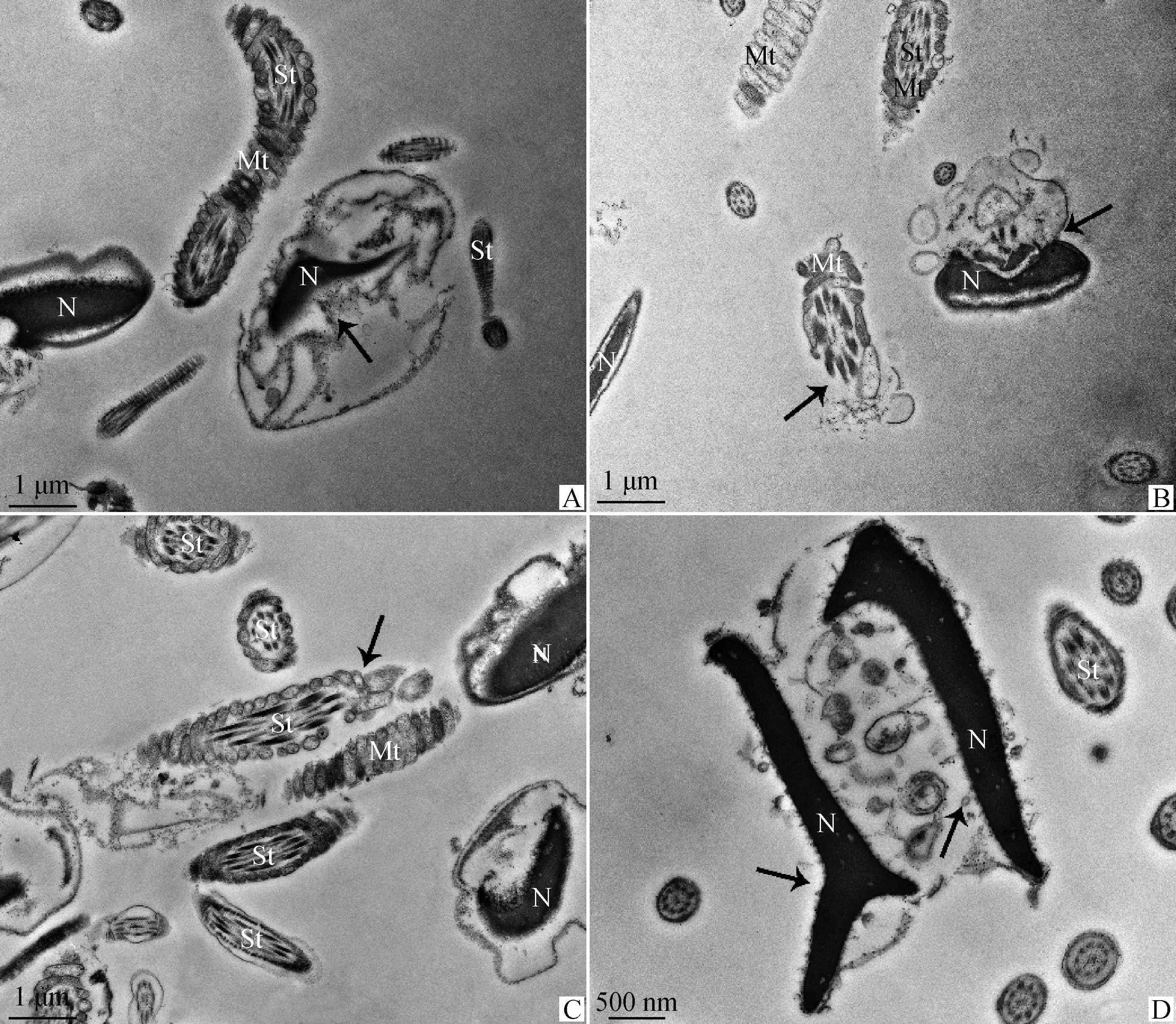
A.96 h精子形態,箭頭指向核崩解碎裂;B.96 h精子形態,箭頭指向核崩解碎裂,線粒體缺失,排列混亂;C.96 h精子形態,箭頭指向線粒體缺失,排列混亂;D.96 h精子形態,箭頭指向核畸形,囊性空泡和凋亡小體

*P<0.05與0 h對比
3 討 論
精液保存是加速奶山羊良種擴繁的關鍵技術,4 ℃液態保存精液可避免凍融過程對精子造成的損傷,同時抑制精子代謝速率,可有效提高精子存活率和體外受精能力。目前,國內采用人工授精技術的山羊養殖場應用的精液主要以液態保存為主[11]。本試驗采用4 ℃液態保存關中奶山羊精子,發現其活率呈時間依賴性逐漸下降,保存至第6天時活率已小于50%,表明4 ℃液態保存下奶山羊精子活率下降快,保存時間較短。
精子結構完整性是評估精液質量的重要指標之一[12]。本研究通過電子顯微鏡觀察4 ℃液態保存中奶山羊精子超微結構變化,奶山羊正常精子結構與之前報道的綿羊、山羊精子形態結構一致[13-14]。4 ℃液態保存條件下,大量精子出現質膜不完整、頂體破損,尤其是頭部質膜明顯損傷。質膜和頂體是精子結構的重要組成部分,對精子受精過程至關重要。研究表明,精子獲能和頂體反應過程中質膜損傷會造成精子活率和受精能力下降,進而導致奶山羊受胎率降低[15]。頂體完整性是評價精子質量的另一個重要指標,是成功受精的先決條件[11]。精子頂體破損導致頂體內容物喪失,進而影響精子獲能、頂體反應和受精能力[16]。同時,本研究發現精子線粒體結構損傷明顯。線粒體作為精子能量代謝的調控中心,是精子運動的能量來源。線粒體結構損傷不僅影響精子尾部運動和受精過程的能量供給,而且會降低精子活率[17],導致精子質量下降,影響液態保存效果。值得注意的是,部分精子出現典型凋亡形態特征。凋亡是細胞自主的程序化死亡過程,是生殖細胞死亡的主要方式之一[18]。大量研究表明,人[19]、兔[20]和綿羊[21]等精子在保存過程中會發生凋亡,凋亡是影響精液保存質量的一項關鍵生理機制。由此可見,4 ℃液態保存中奶山羊精子發生凋亡,其可能是影響液態保存效果的關鍵因素之一。綜上所述,4 ℃液態保存中奶山羊精子活率顯著下降,同時伴隨著明顯的結構損傷,部分精子出現典型的凋亡形態特征,以上形態學研究結果為后續深入研究奶山羊精子液態保存奠定形態學基礎。
4 結 論
4 ℃液態保存過程中,大量精子出現結構損傷,部分精子具有典型的凋亡形態特征,同時精子活率逐漸降低,提示液態保存中奶山羊精子結構損傷導致活率下降。

