鴨干擾素誘導的跨膜蛋白抑制基因3型鴨甲型肝炎病毒的增殖
王一丹,陳弟詩,向 華,張煥容,任玉鵬*
(1.西南民族大學畜牧獸醫學院,成都 610041;2.四川省動物疫病預防控制中心,成都 610041)
鴨甲型肝炎病毒(duck hepatitis A virus, DHAV)是小RNA病毒科家族成員,以引起鴨肝腫大、彌漫性出血和壞死為主要特征,對3周齡內雛鴨易感性和致死率最高,也是目前OIE規定需要法定報告的疾病之一[1]。根據DHAV的基因序列特征和遺傳進化分析,可將DHAV分為DHAV-1、DHAV-2和DHAV-3三個亞型,其中DHAV-3型首次發現于韓國[2]。據調查,在2010-2015年,我國遼寧、山東、浙江、江蘇、福建、廣西、湖北和四川等多省來源樣本中,DHAV-1和DHAV-3總陽性率高達91.4%(320/350);而2013年后的流行毒株以DHAV-3為主(占比達57.1%)[3]。當前對DHAV的防控主要依賴于對母鴨開產前的免疫接種和出殼雛鴨卵黃抗體注射,但現有商品化的疫苗或抗體僅針對DHAV-1,對DHAV-3感染的保護效果不佳[4],這使得養殖場鴨群一旦暴發病毒性肝炎將遭受經濟損失。因此,對DHAV-3新型有效防治方法的研究具有必要性。
干擾素誘導的跨膜蛋白(interferon-induced transmembrane proteins, IFITMs)是近年來發現的位于多種組織細胞膜中,由膜蛋白受體CD225基因家族編碼的具有免疫調節和廣譜抗病毒效應的蛋白家族[5]。IFITMs主要由機體免疫系統在病原模式分子刺激下產生的Ⅰ型干擾素通過JASK-STAT信號通路誘導產生[6]。已有研究表明,IFITMs可抑制正黏病毒、副黏病毒(如禽流感病毒)的復制[7],阻止絲狀病毒和冠狀病毒(如COVID-19)的吸附入侵,抑制黃病毒的膜融合和內吞作用[8]。此外,IFITMs對口蹄疫病毒和柯薩奇病毒等[9]小RNA病毒的復制也具有類似的抑制作用。因此,IFITMs有望成為一類新型、高效的抗病毒藥物。但目前國內外關于duIFITMs 是否對DHAV也具有抑制作用尚不清楚,因而深入探討duIFITMs對DHAV-3感染的抑制作用和揭示其分子機制可以為duIFITMs成為一種新型有效的抗病毒分子奠定理論基礎。
本研究以DHAV-3毒株對 3日齡 SPF雛鴨攻毒,通過對雛鴨肝組織中mRNA進行高通量測序分析,并結合Real-time PCR檢測duIFITMs的表達水平變化,篩選出可能具有抗病毒作用的duIFITM家族成員,進一步在DELC中驗證其對DHAV-3的抑制作用,為DHAV新型防治藥物的研發奠定基礎。
1 材料與方法
1.1 動物和毒株
用于攻毒的3日齡雛鴨由SPF櫻桃谷鴨胚孵化,購自中國農業科學院哈爾濱獸醫研究所,并在西南民族大學動物醫學實驗室動物房飼養至適齡。DHAV-3 SWUNC4 株(TCID50: 10-5.34·0.2 mL-1)由西南民族大學動物醫學實驗室分離、保存[10]。
1.2 主要試劑材料
PrimescriptTM反轉錄試劑盒、限制性內切酶HindⅢ、SacⅡ和pEGFP-N1購自寶生物工程(大連)有限公司;Gel Extraction Kit和Endo-Free Plasmid Mini Kit I購自美國Omega Bio-Tek 公司;Applied BiosystemsTMPowerTMSYBRTMGreen預混液和PageRulerTMPrestained Protein Ladder 購自賽默飛世爾科技(中國)有限公司;FuGENE? HD Transfection Reagent 購自美國 Roche Applied Science 公司;Anti-GAPDH Monoclonal Antibody 購自艾美捷科技有限公司;辣根過氧化物酶標記的山羊抗鼠 IgG 購自安諾倫(北京)生物科技有限公司;鼠抗 duIFITM1 由西南民族大學動物醫學實驗室制備并保存。
1.3 動物分組及攻毒
將3日齡雛鴨按每組9羽隨機分成攻毒組和對照組。將經過0.22 μm濾器處理后的 DHAV-3 SWUNC4 株病毒尿囊液稀釋至100 TCID50,按每羽 200 μL劑量由胸部多點肌肉注射方式攻毒。分別于感染后12、24和36 h剖殺攻毒組和對照組雛鴨各3只,無菌采集肝組織塊,并立即浸泡在液氮中迅速冷凍,再轉入DEPC處理且滅菌EP管,轉入-80 ℃冰箱備后續研究使用。
1.4 基于RNA-Seq技術的轉錄組測序分析
以Trizol regeant法提取肝組織樣本中的總RNA。用核酸蛋白儀 Nanodrop 2000 測定并計算提取的核酸的OD260 nm/OD280 nm比值,驗證RNA樣品純度和完整性。分別將感染DHAV-3 12、24 h雛鴨肝的RNA樣本送深圳華大基因科技有限公司,用Illumina MiseqTM2000技術平臺對樣本進行轉錄組測序。
用Albacore軟件將通過RNA-seq技術得到的測序數據轉化和處理;用Soapnuke軟件以默認參數對獲取片段堿基組成和質量分析以確定原始數據的質量,濾除reads中的測序接頭和低質量堿基,獲得clean reads用于信息分析。與參考基因組進行比對和分析。用NOISeq統計差異表達基因。并設置閾值log2fold change≥-1或>1,probability>0.8 得到樣本之間的表達差異基因。GO富集分析和差異基因的KEGG pathway分析采用超幾何檢驗和FDR矯正,FDR<0.05被認為屬于顯著富集,使用Omicshare在線分析繪圖。根據pathway分析結果,重點篩選出免疫與炎癥相關通路上的基因。用Cytoscap軟件對所有的候選基因進行pathway富集和圖形化分析。
1.5 差異表達基因的熒光定量PCR驗證
根據轉錄組數據處理和生物信息學分析結果,篩選與雛鴨抗病毒免疫和炎癥反應相關分子(IFN-α、IFN-β、RIG-I、MDA5、IFITM1、IFITM5、IRF1、IRF3、IL-8和IL-10等)。用 Real-time PCR法分別對攻毒后12、24和36 h肝組織樣本中相關分子的mRNA含量進行驗證。所用引物都參考GenBank上登錄的綠頭鴨相關基因序列,利用 oligo 7軟件設計篩選,并以GAPDH基因作內參,詳細信息見表1。

表1 熒光定量PCR驗證所用引物信息
Real-time PCR反應體系:2×SYBR Green I PCR Mix 8 μL,上下游引物(10 μmol·L-1)各1 μL,cDNA 模板 1 μL,ddH2O 5 μL;反應條件:95 ℃ 2 min;94 ℃ 10 s,60 ℃ 10 s,72 ℃ 20 s,40個循環。并根據GAPDH基因擴增結果的Ct值計算2-△△Ct值,分析基因表達的倍數差異,同時結合轉錄組測序比較分析。
1.6 pEGFP-duIFITM1在DELC 中的過表達
根據NCBI上綠頭鴨 IFITM1(AnasplatyrhynchosIFIM1, duIFITM1)cDNA序列作為參考(Accession number: NM_001310823.1),在基因兩端引入HindⅢ和SacⅡ限制性內切酶識別位點和 Kozak 序列(GCCACC),由武漢金開瑞生物工程有限公司進行基因合成,片段大小為 450 bp,預測其表達蛋白大小約 15.8 ku。合成的基因連入 pMD19-T,并測序驗證其正確性。分別對 pMD19-T-duIFITM1 和 pEGFP-N1 載體進行雙酶切驗證,反應體系均為質粒 8 μL,HindⅢ 1.5 μL,SacⅡ 1 μL,1.5×T+BSA Buffer 33 μL,ddH2O 6.5 μL,總體積 50 μL。將目的基因亞克隆至pEGFP-N1載體,構建pEGFP-duIFITM1重組質粒,并測序驗證其正確性。
按照OMEGA公司的Endo-Free質粒提取試劑盒相關指南提取重組質粒。用 FuGENE? HD Transfection Reagent 脂質體轉染試劑盒將pEGFP和pEGFP-duIFITM1分別轉入生長良好,密度約80%的DELC單層細胞,每個試驗組設三個重復,同時將脂質體直接加入細胞孔作對照。轉染前測定質粒濃度,將2 μg(200~400 ng·μL-1)質粒樣本同 100 μL DMEM 混勻;用無菌Hank’s 液漂洗細胞數次,按2∶5比例,把脂質體與質粒混勻感作20 min,按100 μL·孔-1緩慢加入細胞培養板;培養 5~6 h后將培養基更換為含10%小牛血清的無抗生素DMEM;轉染 24~48 h 后通過倒置熒光顯微鏡觀察細胞孔中的熒光。用MTT法檢測過表達duIFITM1對DELC細胞活力的影響。
1.7 siRNA干擾 DELC中 duIFITM1的表達
用生長至80%的DELC細胞進行轉染,按照FuGENE? HD Transfection Reagent說明書進行操作,將轉染試劑與siRNA按照 3∶2比例混合,以Opti-MEM 培養基補足至體積55 μL,同時設置空白對照組。以上溶液輕輕混勻,室溫放置15 min,將脂質體/siRNA復合體加入各細胞孔內,放入37 ℃ 5% CO2培養箱中培養48 h后,收集細胞,利用 Real-time PCR檢測duIFITM1蛋白的mRNA表達水平,篩選有效的siRNA干擾片段。duIFITM1-siRNA序列由InvitrogenTM公司合成,序列見表2。通過MTT法測定siRNA 干擾對DELC細胞活力的影響。

表2 duIFITM1基因的siRNA序列
1.8 熒光定量PCR驗證DELC中duIFITM1轉錄情況
用 Real-time PCR 分別對轉染過表達質粒和siRNA 48 h的DELC 中,duIFITM1 mRNA 進行檢測,驗證其轉錄情況,所用引物和反應條件同“1.5”。
1.9 Western blot驗證DELC中duIFITM1表達情況
將轉染48 h的DELC用無菌PBS漂洗3次,加入RIPA裂解液作用5 min;用橡膠刮刀把瓶壁細胞刮落;將細胞懸液冰浴30 min;離心收集上清液,用BCA蛋白質定量試劑盒測定濃度和確定上樣量為 50 μg·孔-1。將待測樣本進行SDS-PAGE電泳后轉入PVDF膜上,用5%的脫脂奶封閉3 h;用TBST 洗滌3次;分別用鼠抗 duIFITM1(1∶400)和鼠抗 GADPH(1∶2 000)作為一抗,4 ℃孵育過夜;再次TBST漂洗后,加入HRP標記的二抗羊抗鼠 IgG(1∶2 000),室溫孵育30 min,用 TBST清洗4次,用 ECL試劑顯色成像。
1.10 duIFITM1過表達和敲減對DELC中DHAV-3增殖的影響
按前述試驗方法和條件將pEGFP-duIFITM1和duIFITM-siRNA分別轉染 DELC 細胞,轉染24 h棄去DMEM,用Hanks 液清洗2次,按100 TCID50接種DHAV-3 SWUNC4 株感作1 h后棄去病毒液,并用 Hanks 液清洗3次,加入維持液放入CO2培養箱連續觀察。分別收集接毒后24、36、48和60 h的DELC樣本并抽提 RNA。參考文獻中的Taqman熒光定量方法[11]檢測各時間點樣本中病毒拷貝數。同時,分別測定 48和60 h的duIFITM1過表達和敲減組樣本中 DHAV-3 的 TCID50以確定病毒滴度。將DELC細胞按104每孔鋪于96孔板中,培養24 h。將DHAV-3用DMEM按10倍倍比稀釋法稀釋(10-2~10-9),各稀釋度按 0.2 mL·孔-1接入微孔板中,以Reed-Muench法計算TCID50。
2 結 果
2.1 測序結果與參考基因組的比對
對轉錄組測序數據過濾處理后,總共得到300 M reads。通過將clean reads定位到北京鴨基因組之后,發現基因組的比對率為68.22%~78.24%;其中,unique 比對率為53.90%~61.25%(表3)。此外根據統計,所有reads的基因比對率為42.64%~49.38%。根據基因區的比對結果,作者通過RESM軟件進行了基因的定量處理,標準化方法采用FPKM,總共檢測出14 175個編碼基因具有表達,其中,13 279~13 597個基因在單樣本中都有表達。
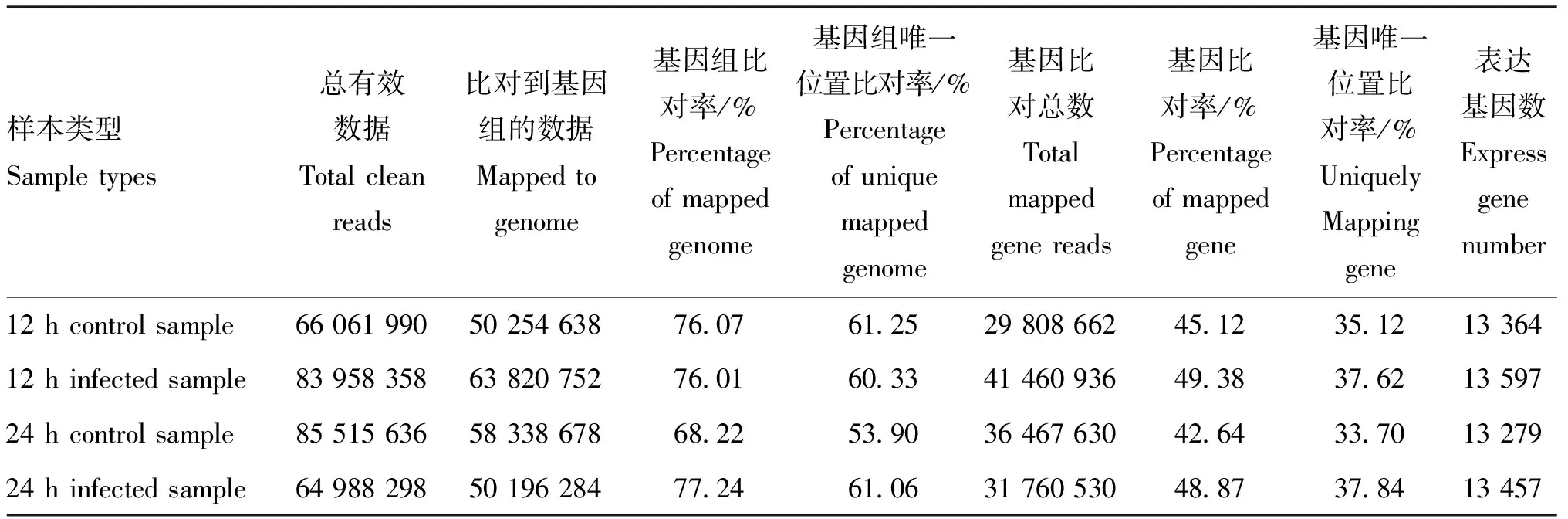
表3 轉錄組測序結果和參考基因的比對
2.2 差異表達基因的pathway分析
對各時間點表達水平有顯著差異的基因進一步作 KEGG pathway 富集分析(圖1)。其中,感染 DHAV-3 后12 和24 h 雛鴨肝中的差異表達基因相關通路數量分別為250和195條,兩個時間點樣本中顯著富集的通路分別為54和20條(FDR<0.05)。此外12 h富集的通路主要集中在TNF 信號通路、NF-κB 信號通路、細胞因子互作、A型流感相關通路和TLRs相關通路等。感染24 h樣本中差異表達基因則主要富集在A型流感相關通路、氧化磷酸化過程、趨化因子相關信號通路、NF-κB 信號通路、RLRs相關通路、JAK-STAT 信號通路和TLRs相關通路等。根據KEGG pathway富集分析結果進一步分析抗病毒免疫反應和炎癥反應相關分子,從感染12和24 h表達差異基因中分別篩選出147個和64個關鍵基因。其中,duIFIITM1 和duIFITM5在12 h的log2FC值分別為5.452 669 1(P<0.05)和 3.921 245 889(P<0.05), 在24 h的log2FC值分別為10.464 801(P<0.05)和 1.793 824,這提示duIFIITM 可能在雛鴨早期感染DHAV-3過程中發揮重要作用。
2.3 抗DHAV-3感染免疫相關分子的Real-time PCR驗證
通過對duIFITM1和duIFITM5兩個家族成員的real-time PCR驗證結果分析發現,duIFITM1在DHAV-3感染后的24和36 h分別達到對照組的4.42倍和7.14倍(P<0.01),但 duIFITM5 的水平變化并不明顯。另外,對其他感染與免疫相關細胞因子的 Real-time PCR 法檢測結果與RNA-seq技術檢測分析結果基本相符(圖2)。對上述關鍵分子的進一步分析發現,在 DHAV-3 感染后的 12~24 h 與小RNA病毒識別相關的部分 PPRs 表達水平未發生顯著變化,如:RIG-I 和MDA5在 DHAV-3感染后的12和24 h樣本中始終保持在較低水平的表達,且與對照組無顯著差異,但在36 h后mRNA水平迅速上調到 4.23 倍(P<0.01)和3.61 倍(P<0.05);對兩種Ⅰ型干擾素的檢測也發現,IFN-α 和 IFN-β 在12和24 h的表達量與對照組相比無顯著差異,直至 36 h 才分別達到對照組的 5.37 倍(P<0.01)和 2.45倍(P<0.05)。
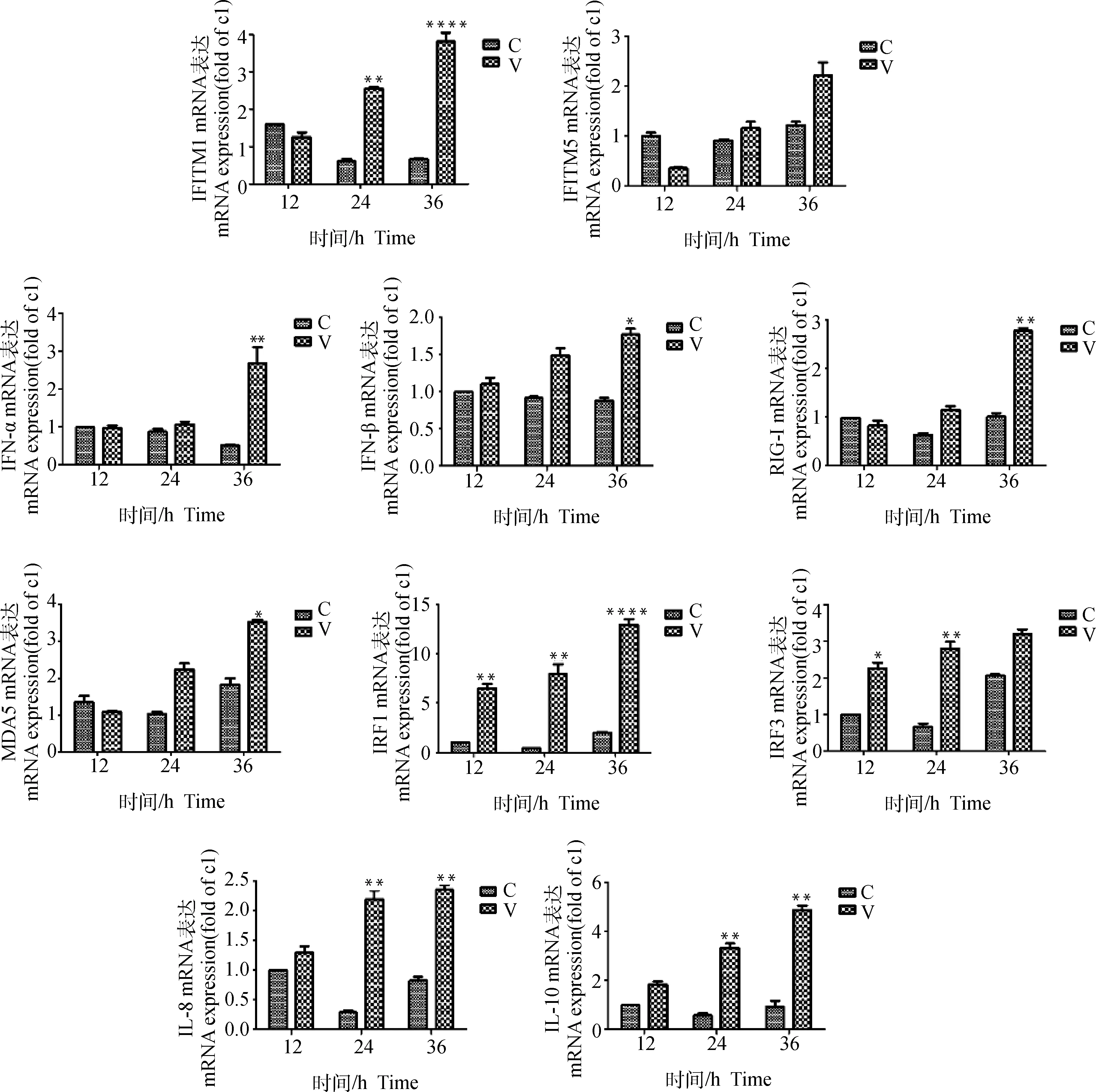
C.對照組; V.攻毒組。*.P<0.05; **.P<0.01; ****.P<0.000 1
此外,IRF1和IRF3在介導TLRs和RLRs識別病原相關分子產生干擾素過程和抗病毒免疫相關的信號通路交互作用中發揮著重要作用[12]。本次熒光定量PCR驗證結果顯示,在DHAV-3感染12 h后,IRF1和IRF3的表達水平都顯著持續上升,表明二者在病毒感染和免疫相關的分子機制中發揮重要作用。
在本次驗證過程中發現,感染后的24 h雛鴨肝中,與炎癥反應和組織損傷程度相關的IL-8和IL-10的mRNA水平均顯著上調(分別為對照組的6.47倍和5.69倍),可能提示病毒感染造成的肝損傷程度在24 h即可達到較高水平,這與朱玉東等[13]對DHAV-3人工感染雛鴨誘導表達的細胞因子檢測結果相符。
2.4 duIFITM1對DHAV-3 SWUNC4株在DELC中的抑制作用
2.4.1 pEGFP-duIFITM1重組真核表達載體的鑒定 對構建好的重組pEGFP-duIFITM1質粒進行雙酶切鑒定,經電泳觀察結果發現在4 700和450 bp處出現了與預測大小相一致的亮帶(圖3)。對重組質粒序列分析并與參考基因序列(NM_001310 823.1)進行比對,結果核苷酸相似性為100%,表明pEGFP-duIFITM1 構建成功。
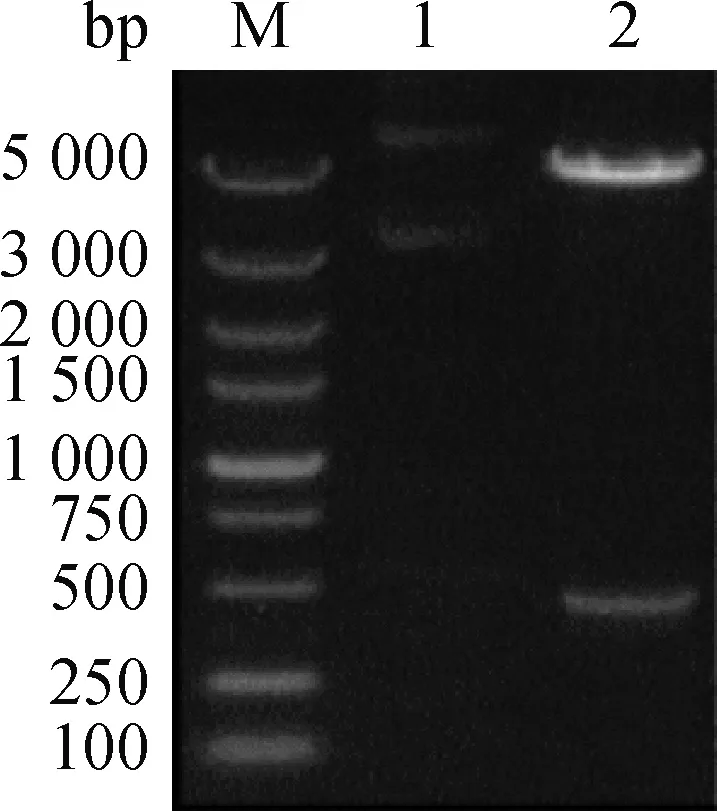
M.DL5000 DNA相對分子質量標準; 1.pEGFP-N1空質粒對照; 2.pEGFP-duIFITM1
2.4.2 重組真核表達質粒轉染DELC細胞 將pEGFP-duIFITM1通過脂質體法導入DELC細胞中,分別在24和48 h于倒置熒光顯微鏡觀察。結果在pEGFP和pEGFP-duIFITM1轉染組均可觀察到清晰的綠色熒光蛋白出現,且duIFITM1基因的引入對pEGFP綠色熒光的強度沒有明顯的影響,由此間接證明重組質粒被成功轉入DELC細胞,同時載體蛋白在細胞中獲得良好的表達(圖4)。
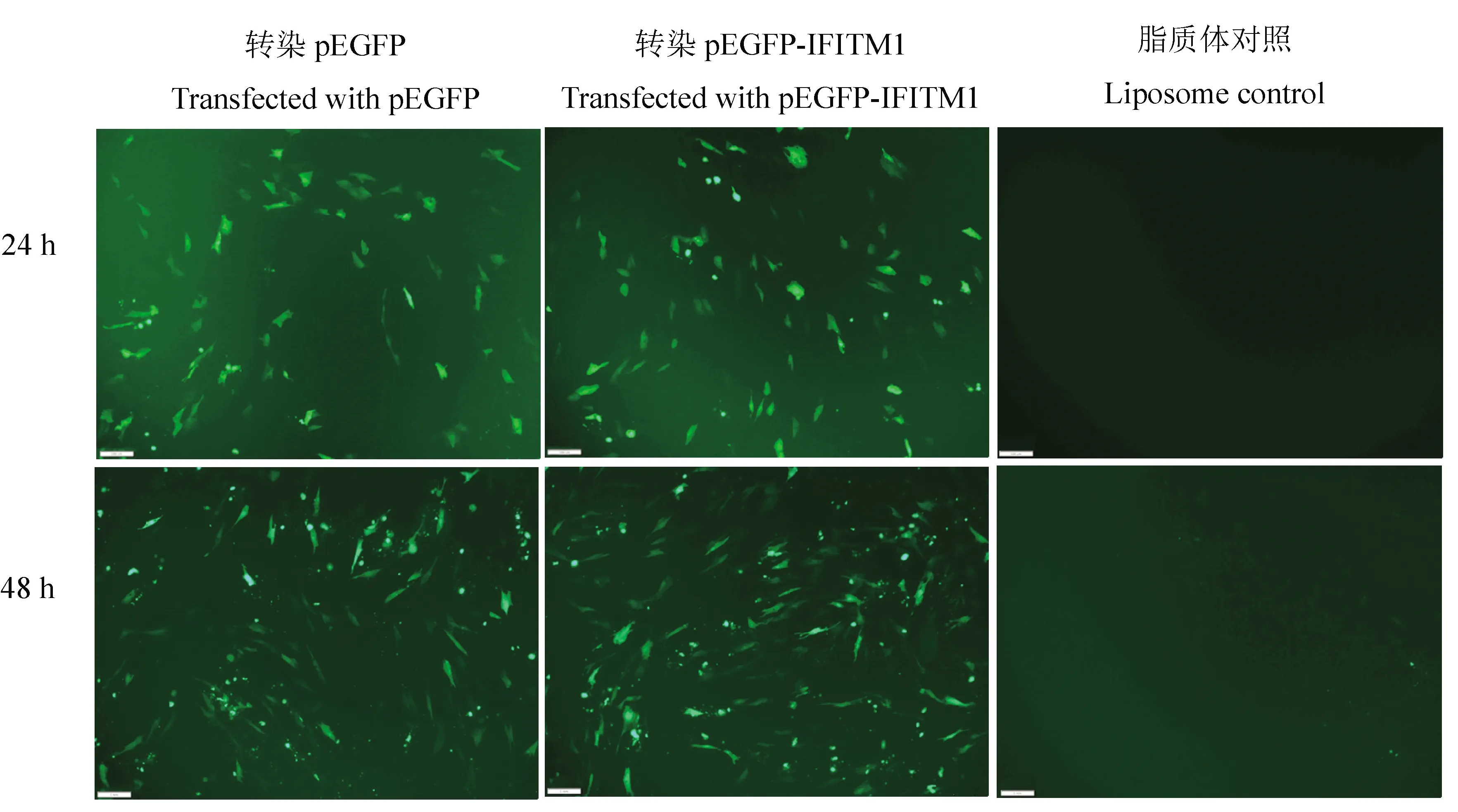
圖4 pEGFP-IFITM1在DELC中的表達(bar=100 μm)
2.4.3 duIFITM1過表達和siRNA干擾的熒光定量PCR驗證 分別收集轉染 pEGFP-N1 和 pEGFP-duIFITM1 后 48 h 的 DELC,反復凍融3次后,Real-time PCR檢測。結果顯示,轉染重組質粒后的DELC樣本中,duIFITM1蛋白的mRNA水平顯著高于pEGFP-N1空質粒組(P<0.01),pEGFP-duIFITM1 被成功轉入鴨胚肝原代細胞且高效表達(圖5A)。
以GAPDH為內參基因,Real-time PCR檢測結果表明,與對照組相比duIFITM1-siRNA1、duIFITM1-siRNA2和duIFITM1-siRNA3下調duIFITM1表達量分別為 60.6%、55.0%和54.4%,因此,duIFITM1-siRNA1干擾效果更好(P<0.01)(圖5B),后續研究選用duIFITM1-siRNA1作為干擾片段。
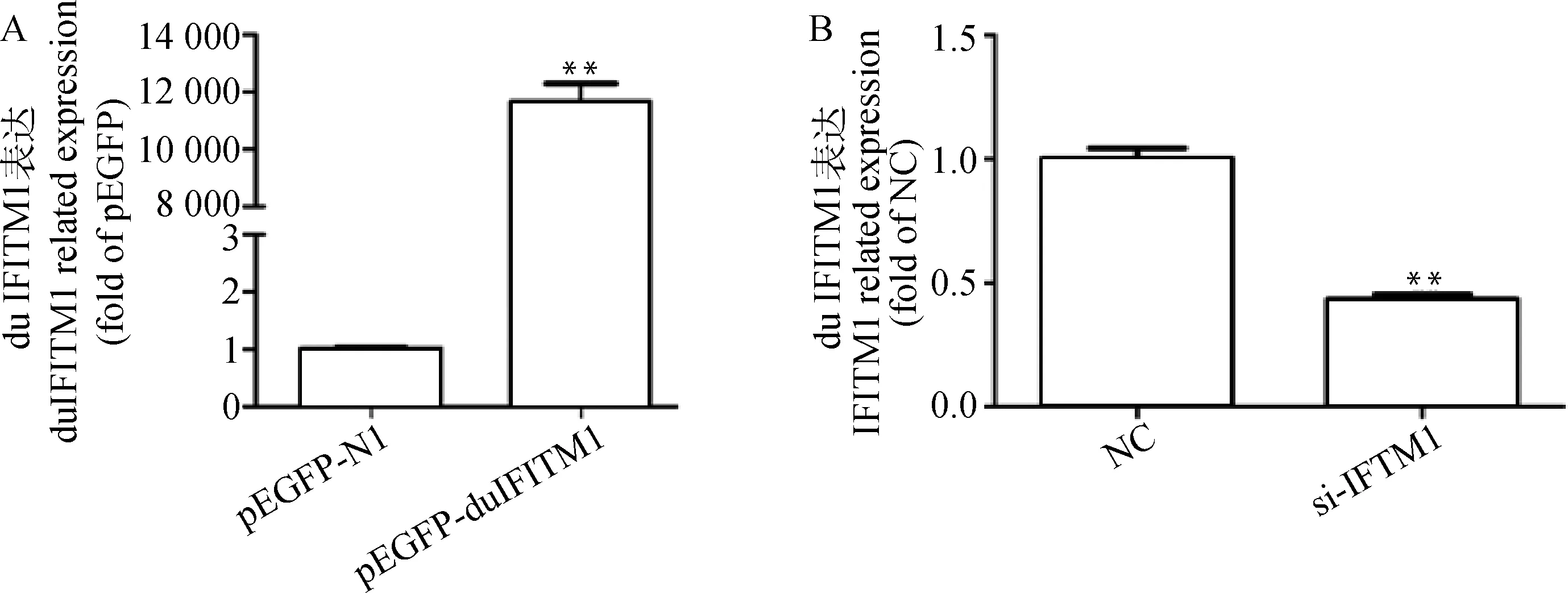
A.過表達;B.siRNA干擾; **.P<0.01
2.4.4 duIFITM1過表達和siRNA干擾的Western blot驗證 分別刮取轉染空載體和 pEGFP-duIFITM1后48 h的DELC細胞進行 SDS-PAGE和Western blot驗證,以GADPH 蛋白為內參。在 pEGFP-duIFITM1 轉染組樣品泳道出現與預期大小相符的條帶(15.8 ku),同時GADPH內參蛋白(36 ku)條帶也清晰可見,且表達量相對穩定。上述結果進一步驗證了duIFITM1在DELC中的成功表達(圖6A、B)。
用Western blot法檢測轉染duIFITM1-siRNA1對DELC細胞中duIFITM1蛋白表達情況的影響。結果顯示,相比于對照組,siRNA片段可以有效降低duIFITM1蛋白表達水平。同時GADPH內參蛋白穩定表達(圖6C、D)。

A、B.過表達;C、D.siRNA干擾;A.pEGFP-IFITM1組出現目的條帶;B.GADPH內參蛋白;C.si-IFITM1 干擾組目的蛋白表達量下降;D.GADPH內參蛋白
2.4.5 過表達和干擾duIFITM1對DELC活力的影響 細胞活力測定結果顯示,與對照組相比,轉染 duIFITM1-siRNA、pEGFP-N1和pEGFP-duIFITM1的DELC細胞在12、24、48、60和72 h等5個時間點的OD值均未出現明顯變化,表明上述轉染過程不會抑制DELC細胞的活力(圖7)。
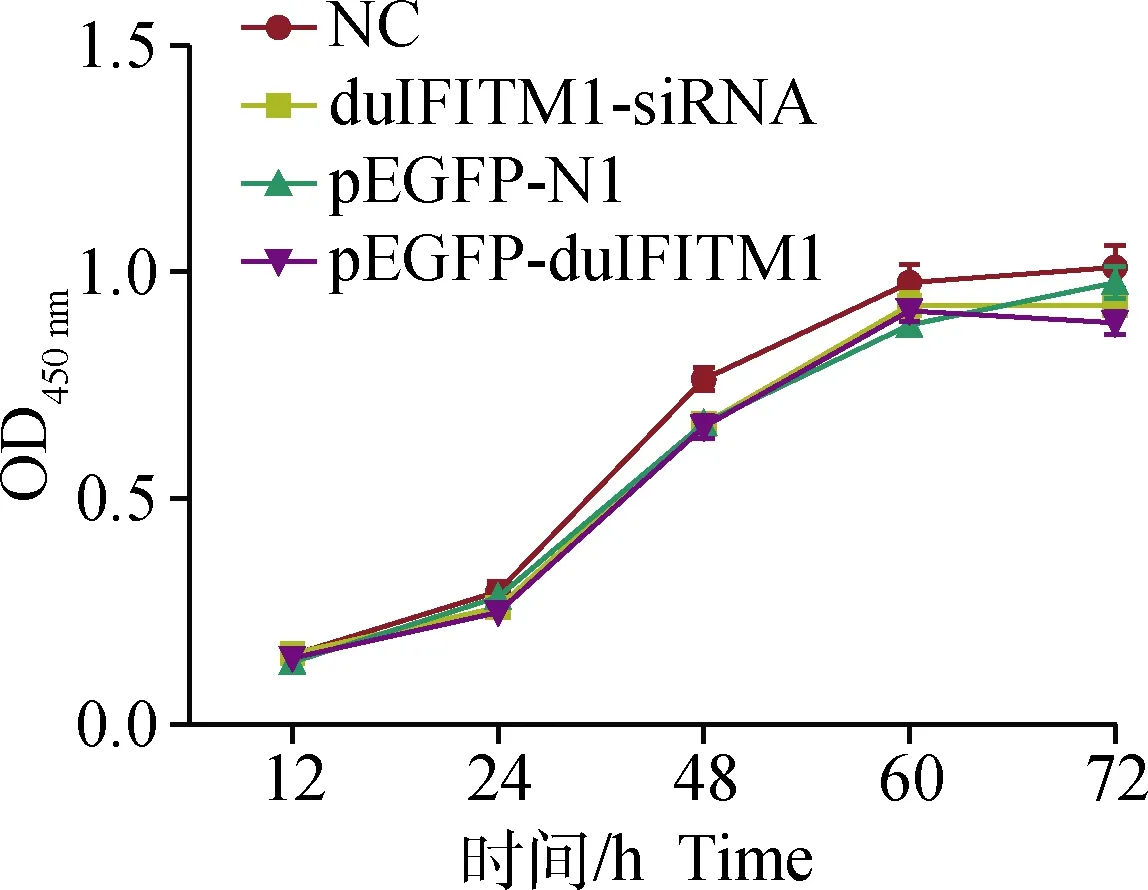
圖7 DELC細胞轉染后的活力測定
2.5 duIFITM1對DHAV-3 SWUNC4株在DELC中的抑制作用
分別在過表達和siRNA干擾duIFITM1的DELC中接種DHAV-3 SWUNC4株,對接毒后24、36、48和60 h的細胞樣本中的病毒核酸含量進行檢測,結果見表4。在接毒后48和60 h,pEGFP-N1組和duIFITM1-siRNA組病毒含量均顯著高于pEGFP-duIFITM1轉染組(P<0.01);同樣,對48和60 h樣本中病毒滴度進行測定,結果顯示,過表達duIFITM1組病毒lgTCID50·0.2 mL-1值顯著高于pEGFP-N1對照組(圖8A)。上述結果證明過表達duIFITM1對DHAV-3在DELC增殖具有明顯的抑制作用。但duIFITM1-siRNA組各時間點病毒核酸拷貝數和滴度均與NC組相比沒有顯著差異(圖8B),表明降低duIFITM1表達量不能直接影響DHAV-3在宿主細胞中的增殖,這也可能與DELC中duIFITM1本底表達水平較低有關。
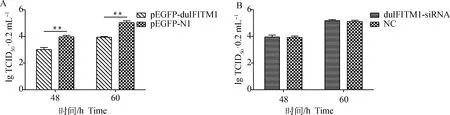
A.duIFITM1過表達細胞中病毒滴度變化;B.duIFITM1干擾細胞中病毒滴度變化。**.P<0.01

表4 duIFITM1過表達和干擾細胞中DHAV-3含量的變化
3 討 論
根據IFITMs家族蛋白基因的分子特征及相關功能目前主要被劃分成了三個亞家族[14]。第一個亞家族主要包含在人類發現的所有與免疫相關的IFITMs家族蛋白(IFITM1、IFITM2和IFITM3)以及和人IFITMs直系同源的鼠IFITM6和IFITM7[15]。IFITM2和IFITM3基因具有高度的相似性,IFITM1則獨立形成一個小分支[16]。IFITM5和IFITM10分別屬于IFITMs的第二個亞家族和第三個亞家族,IFITM5在成骨細胞、巨噬細胞和脾細胞中產生[17]。近年研究發現IFITMs多個家族成員對不同的病原具有抑制作用[18],且對某些病毒的抑制過程十分迅速,但具體分子機制尚未明確。如:IFITM1、IFITM2、IFITM3、IFITM5和IFITM6可通過與病毒包膜蛋白或入侵相關蛋白相互作用有效抑制IAV、MARV、EBOV和SARS病毒的入侵[19-20]。IFITM1可抑制HCV在細胞內的復制[21]。而IFITM1可以在膜融合、內吞和核內體等多環節介導宿主抗CSFV反應[22]。部分IFITMs還可能通過與氧固醇結合蛋白結合調節膽固醇運輸作用,使膽固醇遷入晚期內體進而阻斷病毒的融合[18]。上述研究表明,IFITMs可能成為新型高效的抗病毒分子。基于這一思路,本研究采用RNA-seq技術對DHAV-3 SWUNC4株感染雛鴨肝臟中mRNA進行高通量測序,并結合相關生物信息學軟件對獲得的所有轉錄本進行了系統分析,發現感染早期雛鴨肝中的duIFIITM1 和duIFITM5轉錄水平明顯升高,這提示duIFIITM 可能在雛鴨早期感染DHAV-3過程中發揮重要作用。經Real-time PCR驗證結果表明,duIFITM1在DHAV-3感染后的24和36 h顯著上調,分別為對照組的4.42倍和7.14倍(P<0.01),而duIFITM5在24和36 h表達量沒有明顯變化,這一趨勢與轉錄組測序結果相符,提示duIFITM1是DHAV-3感染早期發揮抗病毒作用的主要干擾素誘導蛋白家族成員之一。隨后,本研究在DELC細胞中分別轉染pEGFP-duIFITM1和duIFITM1-siRNA,構建duIFITM1過表達和敲減細胞模型,以驗證duIFITM1對DHAV-3可能存在的抑制作用。結果顯示,經Real-time PCR和Western blot試驗驗證表明duIFITM1在DELC中獲得穩定高效表達;又分別測定過表達和敲減duIFITM1的DELC中,不同時間點病毒滴度和核酸含量變化。結果表明,在接毒后48和60 h,在duIFITM1過表達細胞中DHAV-3滴度及核酸量與pEGFP-N1對照組和duIFITM1-siRNA組差異顯著(P<0.01),證明過表達 duIFITM1 對DHAV-3 在DELC 增殖具有明顯的抑制作用。
此外,本研究通過高通量測序分析共獲得多個與抗DHAV-3免疫反應相關分子和信號通路;其中TLRs分子表達上調和相關通路的富集出現在感染后12 h,RLRs信號通路相關分子的富集出現在24 h。目前,TLRs、RLRs和NLRs三類家族蛋白已被證實為小RNA病毒分子識別的主要PPRs[23];據此推測在感染早期 DHAV-3可能存在某種分子逃避機制使病毒相關PAMPs在感染初期不能大量激活RLRs,從而為病毒在宿主機體的潛伏和增殖創造條件;另一種可能是,病毒采取了某種干擾策略抑制了除 TLRs 外的其他兩種 PRRs 的識別或相關通路的激活,從而增強病毒對宿主的侵襲力。類似的抑制作用在 DHAV-1 的感染分子機制研究中已被證實,如:DHAV-1 感染 24 h后 RIG-I 和 MDA5 的表達水平均顯著下調,提示病毒對 RLRs 具有抑制作用[24]。本研究進一步對表達差異顯著的12個免疫和炎癥反應的關鍵分子進行了Real-time PCR驗證發現,在 DHAV-3 感染12~24 h 樣本中RIG-I 和 MDA5 的mRNA維持在較低水平,但36 h的表達量顯著上升,這間接印證了關于病毒早期感染過程中存在逃避RLRs識別機制的假設,也表明DHAV-3對宿主的感染過程更傾向于選擇免疫逃避策略而非類似 DHAV-1的免疫抑制。通過Real-time PCR檢測還發現感染早期 RIG-I 和 MDA5 的表達水平較低與 IFN-α/IFN-β 早期表達滯后的變化趨勢一致。目前研究已表明,RLRs 對 PAMP的識別后激活 IRF3 和 NF-κB 的磷酸化過程是Ⅰ型干擾素產生的重要分子機制之一,結合本研究結果,作者認為 DHAV-3感染早期IFN-α 和 IFN-β 的產生相對滯后與 RIG-I 和 MDA5 分子保持較低的表達水平有關。另一方面,兩種干擾素表達水平變化與duIFITM1顯著上升的趨勢并不一致,這提示DHAV-3感染早期duIFITM1可能還受到其他細胞因子或蛋白的調節。當前已有研究發現,除干擾素外,IL-6和抑癌蛋白M也可誘導部分IFITMs的表達上調[25]。進一步深入探索duIFITM1誘導因子類型及其水平變化可能為以其作為新型抗病毒分子提供幫助。
4 結 論
首次證實duIFITM1抑制DHAV-3在DELC增殖,豐富了IFITMs抗病毒研究的相關資料,為以此開發新型抗病毒藥物奠定了基礎。同時,對雛鴨機體早期抗病毒免疫的多個關鍵分子的表達水平變化規律進行了系統研究和分析,為DHAV-3感染與免疫的分子機制深入探索提供重要參考。

