AgSb2O5.18/Ag/Ag2S 等離子體-Z 型異質結構造及氧化還原性能
劉浩梅,郝喜海,劉躍軍
(湖南工業大學 包裝與材料工程學院,湖南 株洲 412007)
充分利用太陽光能和室內常規光源,在可見光光譜范圍內高效催化分解污水中的有機質,是光催化材料研究的重要領域[1-3]。半導體光催化材料是目前應用最廣泛的光催化材料,包括氧化物[4]、硫化物[5-7]、氮化物[8]、硼化物[9]等。單一半導體材料容易發生光生電子和空穴復合現象,性能不穩定,對其進行摻雜[10]、負載金屬[11]、構造異質結[12]等,是研究者目前實現光生電子-空穴對有效分離的主要手段。Z 型異質結半導體一般是在兩種半導體材料之間引入一種導電性能優良的金屬(如Au,Ag 等)構造而成的[13]。以TiO2-Au-CdS 為例,Au 納米粒子首先沉積在TiO2表面,形成TiO2-Au 顆粒,再以Au 顆粒為反應位點分步沉積S2-和Cd2+,形成TiO2-Au-CdSZ 型異質結半導體,它的光催化性能比兩個單一半導體均有明顯增強[14]。大量新型Ag 基光催化材料被合成,包括單一Ag 化合物等;金屬Ag-半導體復合材料等。有研究者將金屬Ag 引入Z 型異質結,制備出Ag 基Z 型異質結半導體催化劑,如等。Ag2S 是一種熱不穩定型半導體,在高溫時Ag2S 易部分轉化為金屬Ag[5],而金屬Ag 顆粒的生成增加了Ag2S 顆粒與Ag 顆粒的接觸面,為構建性能優良的Ag 基Z 型異質結提供了良好基礎。Sadovnikov 等[23]利用化學沉積法合成了Ag2S/Ag 異質結,并對其性能進行了研究。但關于以Ag2S 為基礎構建等離子體-Z 型異質結半導體復合材料的報道較少。
本工作以可溶性AgNO3為Ag 源、以L-半胱氨酸為S 源、以焦銻酸鉀(KSbO6H6)為Sb 源,通過水熱法一步合成了AgSb2O5.18/Ag/Ag2S 粉末材料,并在250 ℃下進行焙燒,利用Ag2S 易轉化為Ag 的性能,構造了AgSb2O5.18/Ag/Ag2S-250Ag 等離子體-Z 型異質結模型,并基于該模型闡述了電子-空穴轉移規律以及氧化還原性能規律,為開發更多高性能光催化材料提供了借鑒。
1 實驗部分
1.1 主要試劑及原料
L-半胱氨酸、KSbO6H6、AgNO3、尿素、十二烷基磺酸鈉:分析純,國藥集團化學試劑有限公司。去離子水由Millipore Milli-Q 型超純水儀(上海西格瑪奧德里奇公司)制備。
1.2 試樣的制備
分別將L-半胱氨酸(2.0 mmol)、KSbO6H6(2.0 mmol)和AgNO3(6.0 mmol)依次加入30.0,30.0,20.0 mL 去離子水中,得到溶液A,B,C;將溶液A緩慢引流到溶液B并置于磁力攪拌器中,在80 ℃下攪拌30 min,得溶液D;將溶液C 引流到溶液D 中,恒溫80 ℃攪拌30 min,形成反應前體混合物;將該混合物全部倒入100.0 mL 反應釜中,在180 ℃下恒溫反應24 h。反應物冷卻后,洗滌所得粉末(三次去離子水洗+三次無水乙醇洗),然后在80 ℃下干燥10 h 得到AgSb2O5.18/Ag/Ag2S 產物。稱取0.200 0 g 該產物,放入干凈的瓷舟,在馬弗爐中以2 ℃/min 的升溫速率升溫到250 ℃,焙燒3 h 得到試樣AgSb2O5.18/Ag/Ag2S-250。
將8.0 mmol KSbO6H6加入70.0 mL 去離子水中,在80 ℃下恒溫攪拌0.5 h,得溶液A;將1.0 mmol 的十二烷基磺酸鈉加入溶液A 中;將8.0 mmol AgNO3溶解在10.0 mL 去離子水中,室溫下攪拌得均勻溶液B;并將溶液B 緩慢加入溶液A中形成大量黑色混合物,再將其倒入100.0 mL 反應釜中,于120 ℃下恒溫反應24 h。產物經6 次洗滌(去離子水和無水乙醇各3 次)后,在70 ℃下干燥3 h,得到AgSb2O5.18。
將AgNO3(4.0 mmol)加入80.0 mL 去離子水中,在室溫下攪拌均勻,再將3.0 mmol L-半胱氨酸和2.0 mmol 的尿素加入上述溶液中攪拌,超聲3 min。將溶液倒入100.0 mL 反應釜中180 ℃下恒溫反應24 h,冷卻后將沉積物洗滌6 次(去離子水和無水乙醇各3 次),在60 ℃的干燥箱中干燥6 h,得到Ag2S。
1.3 性能測試
采用德國Bruker 公司Bruker D8 Advance 型X射線衍射儀對試樣物相進行表征;采用美國FEI 公司FEI Inspect F50 型掃描電子顯微鏡對試樣形貌進行表征;采用日本電子株式會社JEOL JEM2010 型場發射透射電子顯微鏡對試樣組成進行表征;采用美國Thermo Fisher公司ESCALAB 250Xi 型X 射線光電子能譜儀對試樣結構進行表征;采用日本島津公司UV-2600 CH 型紫外-可見漫反射分光光度計對粉體材料的光學性能進行表征;采用德國Bruker 公司Bruker A300 型電子自旋共振(ESR)光譜測定儀對試樣進行表征。
2 結果與討論
2.1 結構、形貌和組成表征結果
圖1 為四個粉末試樣的XRD 譜圖。由圖1可知,AgSb2O5.18的特征衍射峰符合標準數據庫中JCPDS No.00-052-0263 空間群為Fd-3m(227),屬于立方晶型AgSb2O5.18;Ag2S 的特征衍射峰符合標準數據庫中JCPDS No.00-009-0422,屬于單斜晶系Ag2S;AgSb2O5.18/Ag/Ag2S 和AgSb2O5.18/Ag/Ag2S-250 的特征衍射峰均顯示含有單斜晶系Ag2S 和立方晶型AgSb2O5.18。
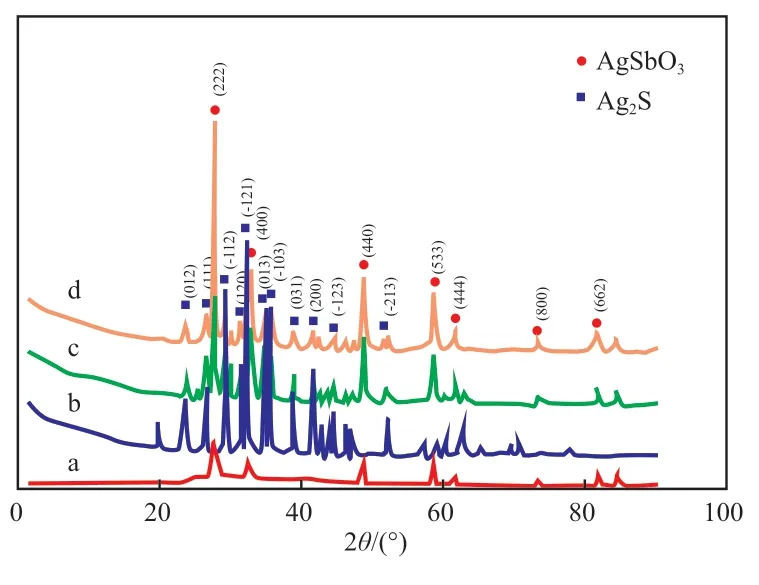
圖1 試樣的XRD 譜圖Fig.1 XRD spectra of the samples.
本課題組[24]在前期研究中探討了Ag-H2O 水熱體系中金屬Ag 的形成機理,并根據熱力學計算結果作出了Ag-H2O 水熱體系中部分化學反應的電勢圖,得出的反應機理(400 K,pH ≥6.8 時)見式(1)。

即水溶液中Ag+/Ag 電勢對中的Ag+可與H+/H2電勢對中的H2反應,生成金屬Ag,這一研究表明,從水熱路線中合成的AgSb2O5.18復合物中一定含有金屬Ag。
在標準壓力下,Ag 單質能與O2發生潛在反應,熱化學反應方程見式(2)。

根據Gibbs-Helmholtz 方程[25](式(3)):



式中,vB為組分B 的化學反應計量系數;298 K)為組分B 在298 K 時的標準摩爾生成Gibbs自由能變,kJ/mol;為組分B 在298 K 時的標準摩爾熵,J/(mol·K)。
綜上所述,試樣AgSb2O5.18/Ag/Ag2S 在250 ℃焙燒時,反應式(2)不會正向發生,即其中的單質Ag 不會轉化成Ag2O。但是,由于金屬Ag 的含量很少,故在XRD 譜圖中均未發現Ag 的衍射峰,這種現象在其他研究中也有發現[22]。
圖2 為試樣AgSb2O5.18/Ag/Ag2S 和AgSb2O5.18/Ag/Ag2S-250 的SEM 照片。由圖2a 可知,AgSb2O5.18/Ag/Ag2S 顆粒為不規則球形,粒徑在50 nm 左右,粒徑分布較均勻,團聚較少;由圖2b 可知,AgSb2O5.18/Ag/Ag2S-250 顆粒的主要變化為:1)顆粒形貌更不規則,有一些球形顆粒分布在一些更大的顆粒表面;2)顆粒團聚較多;3)顆粒粒徑更大,分布不均勻;4)有一些柱狀物從基底長出(紅色箭頭指示),這可能是Ag2S 熱穩定性差,在焙燒時生成了金屬Ag[5]。
模擬焙燒環境(密閉空間下,加溫至250℃),將純Ag2S 進行了SEM 條件(真空條件下將電子束集中打到硅片上的Ag2S 顆粒表面,溫度也在250 ℃左右)下的反應。圖3 為不同電子束聚焦時間下Ag2S 顆粒的SEM 照片及EDS 譜圖。由圖3a 可知,在電子束聚焦時間為5 s 內的SEM 照片中Ag2S 顆粒表面多處出現了小的芽苗狀突起;試樣中僅有Ag 和S,原子百分比為73.36∶26.64。由圖3b 可知,同一試樣在電子束照射了30 s 時,顆粒表面有大量柱狀體從試樣基體中長出;Ag 和S 的原子百分比為75.70∶24.30,要高于照射5 s 的試樣。試樣中Ag 和S 的原子百分比均大于Ag2S 的化學計量數比2∶1,表示均有單質Ag 存在。這一模擬焙燒實驗,既印證了Ag2S 具有熱不穩定性的結論,也與圖2b 中AgSb2O5.18/Ag/Ag2S-250 復合材料中出現柱狀Ag 的現象相吻合。

圖2 AgSb2O5.18/Ag/Ag2S(a)和AgSb2O5.18/Ag/Ag2S-250(b)試樣的SEM 照片Fig.2 SEM images of the AgSb2O5.18/Ag/Ag2S(a) and AgSb2O5.18/Ag/Ag2S-250(b) samples.

圖3 Ag2S 顆粒的SEM 照片(a)及EDS 譜圖(b)Fig.3 SEM images(a) and EDS spectra(b) of Ag2S particles.Voltage 15.00 kV.
圖4 為試樣AgSb2O5.18/Ag/Ag2S-250 的HRTEM 照片和元素能譜圖。

圖4 試樣AgSb2O5.18/Ag/Ag2S-250 的HRTEM 照片(a)和元素能譜圖(b~f)Fig.4 HRTEM image(a) and elemental energy spectra(b-f) of the AgSb2O5.18/Ag/Ag2S-250 sample.
由圖4a 可知,復合顆粒中緊密堆積或摻雜了AgSb2O5.18晶體(晶面間距0.6 nm,與Sb2O5.18(111)晶面吻合,也與前面的XRD 表征結果吻合)、金屬Ag(晶面間距0.23 nm,與Ag(111)晶面吻合)、Ag2S 晶體(晶面間距0.221 nm,與Ag2S(031)晶面吻合)、AgSbO3晶體(晶面間距0.3 nm,與AgSbO3(222)晶面吻合)。由圖4b~4f 可知,Sb 和O 分布高度一致,分布區域密度大;Ag 分布最廣,一些突出部位的小顆粒僅有Ag 元素,沒有其他元素,表明是金屬Ag;S 分布密度較弱,分布范圍小于Sb 和O,更小于Ag。上述表征結果進一步證明了復合顆粒中有Ag 顆粒存在,且Ag 顆粒與AgSb2O5.18顆粒和Ag2S 顆粒呈緊密聚集狀態。
圖5 為試樣AgSb2O5.18/Ag/Ag2S-250 的XPS譜圖。由圖5 可知,Ag 3d譜圖包含了Ag 3d3/2和Ag 3d5/2兩個主峰,在367.9,373.9 eV 處的峰對應Ag+,而在 367.4,373.5 eV 處的峰對應Ag0,表明試樣中包含了Ag0和Ag+兩種化學態,所制備的試樣中存在單質Ag[26],這與前面SEM 和HRTEM表征結果一致;S 2p譜圖包含了S 2p3/2和S 2p1/2兩個主峰,S 元素僅有S2-這一化學態,表明試樣中Ag+和S2-結合形成了Ag2S,這一結果與XRD表征結果一致;Sb 4d譜圖包含了Sb 4d3/2和Sb 4d5/2兩個主峰,擬合結果顯示,Sb 在試樣中僅存在一種化學態;O 1s譜圖在529.9 eV 處僅有一個峰,歸屬于AgSb2O5.18的晶格氧[27]。因此,可以說明AgSb2O5.18,Ag 和Ag2S 成功復合。

圖5 AgSb2O5.18/Ag/Ag2S-250 試樣的XPS 譜圖Fig.5 XPS spectra of the AgSb2O5.18/Ag/Ag2S-250 sample.
2.2 光學性能
圖6 為試樣的UV-Vis 譜圖及能量帶隙(Eg)曲線。由圖6A可知,AgSb2O5.18的吸收帶邊為460 nm,位于可見光區;而Ag2S 及其復合物AgSb2O5.18/Ag/Ag2S,AgSb2O5.18/Ag/Ag2S-250的吸收帶邊分別為272,260,245 nm,已遷移到了紫外光區。由圖6B 可知,AgSb2O5.18和Ag2S 的Eg應該為表觀Eg,按式(7)[28]計算,結果分別為2.60 eV 和4.95 eV。

圖6 試樣的UV-Vis 譜圖(A)及Eg 曲線(B)Fig.6 UV-Vis spectra and energy band gap(Eg) curves of the samples.

式中,α為吸收系數;A為常數。
2.3 ESR 表征結果
半導體中的光生電子和空穴能分別與有機廢水中的O2分子和H2O 分子反應生成自由基和OH·,和OH·是將有機廢水中的高分子物質分解為短鏈小分子的關鍵自由基,因此,衡量半導體光催化能力的標準是生成和OH·數量的多少。一般而言,生成越多,半導體的還原性越強;生成OH·越多,半導體的氧化性越強[29]。
為了探索試樣AgSb2O5.18/Ag/Ag2S-250 在可見光條件下的氧化還原能力,采用5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)為捕捉劑進行ESR 表征,驗證可見光照射下和OH·自由基的生成。圖7 為不同試樣的和DMPO-OH·的ESR譜圖。由圖7A 可知,AgSb2O5.18試樣沒有峰信號,顯示AgSb2O5.18試樣的還原能力不足以產生;Ag2S,AgSb2O5.18/Ag/Ag2S,AgSb2O5.18/Ag/Ag2S-250 試樣在磁場強度為3 485,3 493,3 500,3 508,3 513,3 522 G 處均出現強峰,各試樣的峰強度順序由大到小為AgSb2O5.18/Ag/Ag2S-250>AgSb2O5.18/Ag/Ag2S>Ag2S,表明AgSb2O5.18/Ag/Ag2S-250 的還原能力最強。由圖7B 可知,Ag2S 試樣只有微弱的峰信號,表明氧化能力很弱;試樣AgSb2O5.18,AgSb2O5.18/Ag/Ag2S,AgSb2O5.18/Ag/Ag2S-250 在3 482,3 498,3 513,3 527 G 處均有峰信號,各試樣的DMPO-OH·峰強度順序由小到大為AgSb2O5.18<AgSb2O5.18/Ag/Ag2S< AgSb2O5.18/Ag/Ag2S-250,表明試樣AgSb2O5.18/Ag/Ag2S-250的氧化能力最強。

圖7 不同試樣的DMPO-·(A)和DMPO-OH·(B)的ESR 譜圖Fig.7 ESR spectra of DMPO-·(A) and DMPO-OH·(B) for different samples.
2.4 AgSb2O5.18/Ag/Ag2S 等離子體-Z 型異質結模型
結合前人的研究[30],本工作提出了AgSb2O5.18/Ag/Ag2S 及其焙燒產物AgSb2O5.18/Ag/Ag2S-250 的等離子-Z 型異質結模型,并在此基礎上對光催化過程中的電子-空穴轉移機制進行了研究。圖8 為AgSb2O5.18/Ag/Ag2S 等離子體-Z 型異質結光催化劑的電子-空穴分離示意圖。由圖8 可知,AgSb2O5.18半導體、Ag2S 與夾在兩者之間的金屬Ag 顆粒構成等離子體-Z 型異質結復合材料。在光的照射下,由于AgSb2O5.18的Eg=2.60 eV,可以吸收光子產生電子和空穴,形成光生電子-空穴對;而Ag2S 的Eg=4.95 eV,不能吸收光子產生光生電子和空穴;夾在兩者之間的金屬Ag 顆粒,由于具備表面等離子效應,能產生等離子激發電子和空穴。Ag 顆粒的等離子激發電子可以傳導到Ag2S 的導帶(CB)上,與有機廢水中的O2分子生成·;匯聚在AgSb2O5.18中價帶(VB)上的空穴,能與H2O 形成OH·。由于金屬Ag 具有優良的電子傳導性,且內部有電場存在,AgSb2O5.18中CB 上的電子可以快速傳導到Ag,與Ag 的等離子體激發空穴復合,從而使得AgSb2O5.18中的光生電子和空穴難以復合,因此,AgSb2O5.18/Ag/Ag2S 具有較強的和DMPO-OH·信號峰。試樣AgSb2O5.18/Ag/Ag2S-250 由于從Ag2S基體中長出更多的金屬Ag,能形成更多的Z 型異質結復合體,或增加更多的反應位點,形成Ag 增強型(AgSb2O5.18/Ag/Ag2S-250)等離子體-Z 型異質結,表現在ESR 表征中就是試樣AgSb2O5.18/Ag/Ag2S-250 比AgSb2O5.18/Ag/Ag2S 有更強的DMPO-和DMPO-OH·信號峰。

圖8 AgSb2O5.18/Ag/Ag2S 等離子體-Z 型異質結光催化劑的電子-空穴分離示意圖Fig.8 Schematic diagram of electron-hole separation of AgSb2O5.18/Ag/Ag2S plasma-Z-type heterojunction photocatalyst.
3 結論
1)采用水熱法一步制備了AgSb2O5.18/Ag/Ag2S粉末材料,顆粒為不規則球形,粒徑在50 nm 左右,粒徑分布較均勻;在250 ℃下對該粉末進行焙燒處理,得到了AgSb2O5.18/Ag/Ag2S-250 粉末材料,焙燒工藝會使新的柱狀Ag 顆粒從Ag2S 基體長出。
2)AgSb2O5.18的吸收帶邊為460 nm,位于可見光區;而Ag2S 及其復合物AgSb2O5.18/Ag/Ag2S,AgSb2O5.18/Ag/Ag2S-250 的吸收帶邊分別為272,260,245 nm,已遷移到了紫外光區。AgSb2O5.18和Ag2S 的Eg應該為表觀Eg,分別為2.60 eV 和4.95 eV。
4)提出了AgSb2O5.18/Ag/Ag2S 等離子體-Z 型異質結模型,并基于模型解釋了AgSb2O5.18/Ag/Ag2S 的電子-空穴轉移規律,合理地解釋了ESR表征結果。

