“自主漫步”DNA機器人,可精準調控細胞行為,轉化工作已提上日程
2021年9月,湖南大學聶舟團隊開發出了一種“自漫步”的DNA分子機器人,其能夠在DNAzyme(DNA酶)的催化驅動下在細胞膜表面自主移動,從而控制細胞的遷移行為。研究表明,DNA機器人在細胞膜表明的連續行走能夠超靈敏調控MET/AKT信號以及細胞骨架重建,以此增強細胞遷移。這項研究有望為在納米尺度分辨率下精確調控細胞行為提供了一種新方法。
“在這項研究中,我們首次將分子機器人與生物學功能結合在一起,實現分子機器人對細胞的行為調控。”據聶舟介紹,論文中開發的DNA分子機器人是首個在活細胞的細胞膜表面行走的機器人,而此前的大部分DNA分子機器人是在體外給定路徑行走。

相關論文
聶舟是湖南大學化學化工學院教授,還是生物大分子化學生物學湖南省重點實驗室主任。他本人擁有生物化學、分子生物學、物理化學、分析化學等多學科交叉科研背景,曾獲中國化學會青年化學獎,主持國家自然科學基金杰出青年基金以及國家重點研發計劃等項目課題。聶舟課題組的科研方向包括通過非遺傳改造方式調控細胞功能、RNA成像以及CRISPR/Cas檢測工具。

湖南大學聶舟教授
除了編碼遺傳物質的能力以外,近年來不斷發展的功能核酸和核酸納米技術等領域使得DNA還具有分子識別與催化、納米精準自組裝、動態可調自組裝等一整套非遺傳功能。利用DNA納米工具基于非遺傳改造方式調控細胞行為是聶舟實驗室的一大重要研究方向。
“與傳統的基因工程和合成生物學思路不同,我們的思路是通過非遺傳學方式賦予細胞新的特征和表型,精確控制細胞的遷移、增殖和分化等行為,而無需改造或者導入基因。”聶舟說。
例如,細胞遷移是細胞行為中的一種重要類型。如何讓細胞能對特定化學物質具有定向遷移性,即實現人工定制的化學趨向性,聶舟實驗室的策略是為細胞安裝一個基于DNA納米裝置的“化學雷達”,從而使細胞能夠對特定的化學分子進行遷移。“我們通過利用DNA納米裝置,把細胞膜受體原有的識別界面屏蔽掉,然后再生成一個新的小分子識別界面,從而利用小分子介導受體激活引起化學趨向性調控此前對這些小分子無法進行遷移的細胞。”
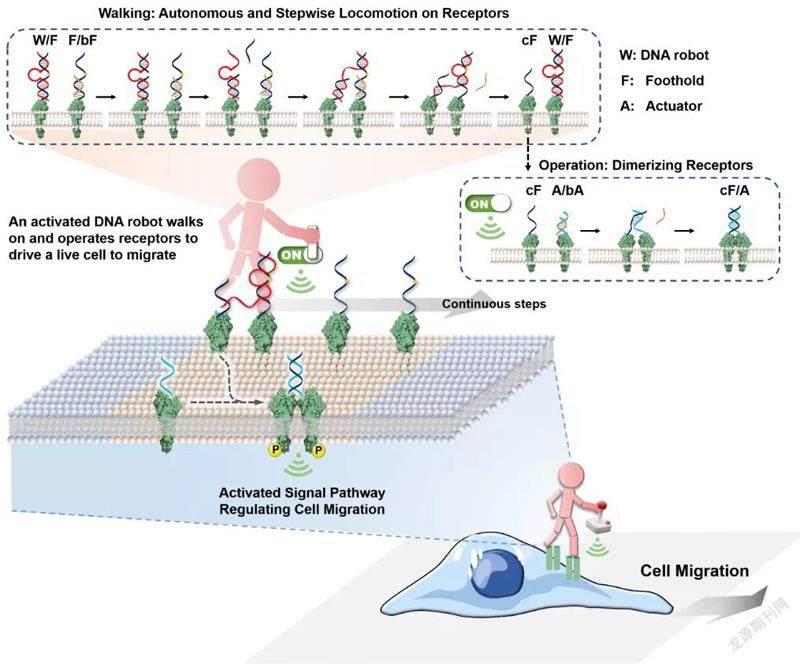
基于以上思路,該團隊通過設計不同的DNA納米裝置,采用非遺傳的方式特異性調節細胞膜表面的受體,從而改變細胞的基本行為和命運。最新的嘗試是他們近期設計的“可自主漫步”的DNA分子機器人,這種機器人可通過持續激活細胞膜上的受體信號來控制細胞行為。
研究中的操作系統由一個能夠單腳行走的DNA分子機器人、多個受體上行走位點以及多個受體激活執行器組成。機器人的主體是DNA酶,這是一種功能核酸,具有酶催化的功能。以DNA酶催化行為為動力,機器人能夠不斷從一個細胞膜表面受體上的行走位點移動到下一個受體行走位點上,同時機器人每走一步還將通過與受體激活執行器反應觸發細胞膜表面受體的二聚化過程,從而激活受體。
據聶舟透露,整個DNA分子機器人行走的過程是一個連續催化的過程,在這個過程中機器人會不斷激活細胞膜上的受體,從而實現對相關受體的超靈敏激活。
在研究中,團隊通過合作采用了突破成像極限的超分辨率技術監測細胞膜上DNA分子機器人的行走數據。根據推算,DNA分子機器人每一步的運動范圍大約2納米~10納米,能夠驅動細胞每小時行走87微米。“無論對受體的激活,還是細胞行為的表征,每個分子機器人在1小時內可激活細胞膜表面約20對受體,產生近40倍的激活增強。”
精確調控細胞行為不僅可以通過受體精準調控來實現,聶舟團隊也關注細胞受體識別的配體對象一一例如細胞因子。細胞因子是由多種細胞分泌的小分子多肽或糖蛋白,這是一類生物信息分子,通過與細胞表面的相應受體結合發揮其生物學作用。細胞因子作為藥物的治療的局限性在于其對靶細胞調節的選擇性不高,可能脫靶激活其他細胞,引起毒副作用。如何發展智能化的細胞因子是細胞精準調控的一道“必答題”。
據聶舟介紹,DNA納米裝置可以實現“升級版”的細胞因子,即根據不同疾病情況,設計更智能的細胞因子,從而更精準激活受體、調控細胞行為。
具體來說,聶舟實驗室提出的是一種類似智能手機“掃碼—開鎖”一樣的策略,也就說通常情況下,通過DNA納米裝置給細胞因子上鎖,使其失去活性,然后通過掃描細胞膜上的多種膜蛋白靶標構成的“細胞身份碼”,準確鑒定細胞并開鎖釋放細胞因子,然后選擇性激活受體并調控靶細胞功能。
目前,該團隊正在嘗試多種選擇性調控細胞行為的方式,其中包括疾病靶標、生理分子、光控等。在研究中,團隊為多種不同類型的細胞安裝上了DNA分子機器人裝置,并發現可以在活體層面選擇性觸發細胞行為。當研究人員把近紅外光響應DNA裝置放入試驗動物體內,通過近紅外光照后,他們觀察到該納米裝置可以驅動內源肌肉干細胞定向遷移到肌肉的損傷部位,進一步分化成肌肉細胞修復受損肌肉組織。
據悉,聶舟團隊調控的受體主要以受體酪氨酸激酶為主,這是一類感知細胞因子、生長因子等信號分子的跨膜蛋白受體分子,在蛋白酪氨酸激酶家族中占比較高。多項研究顯示,受體酪氨酸激酶在多種細胞的生長、分化、血管生成以及癌變過程中發揮著重要的作用。

RTK家族

需要注意的一點是,聶舟團隊設計的這種DNA分子機器人與傳統載藥機器人不同,載藥機器人作為載體遞送藥物,需要通過攜帶的藥物發揮殺傷腫瘤或者治療疾病的作用,而這種分子機器人調控細胞受體功能本身就是藥物形式,調控細胞行為的過程就是發揮治療效果過程。
據聶舟介紹,團隊正在通過調控受體酪氨酸激酶精準調控細胞行為,實現治療效果。他認為,該機器人有潛力應用于腫瘤免疫治療、糖尿病、創口、組織修復等多種疾病治療中。
這種調控細胞行為的觸發因子也可以擴展為不同的對象,包括離子、小分子以及核酸、蛋白質等生物大分子,從而實現對細胞的正交控制。
據悉,該裝置還包括多個不同模塊,比如DNA-抗體偶聯模塊,DNA-蛋白偶聯模塊,也就是說可以利用不同的元件滿足不同的需求。細胞有其天然配體蛋白,這些蛋白配體可以通過與DNA-蛋白偶聯模塊結合,從而調控多種細胞類型。
不過,聶舟也指出當前DNA分子機器人真正落地也還面臨兩個難點,即如何在活體環境中穩定執行調控功能以及如何集成多種復雜功能。他告訴生輝,這兩個角度也是團隊開發出的DNA分子機器人的轉化落地方向,短期來看可以開發受體激活劑或者抑制劑,更長遠的目標是集成更復雜的功能實現對細胞行為的精準調控。
目前,該團隊已經開展了受體激活劑的轉化工作,且正在初步進行臨床前相關試驗。
聶舟是一名“八零后”博導,其父母也都是化學教授,耳濡目染之下,從小與化學結下不解之緣。他的教育背景涵蓋了生物、生物化學、物理化學以及分子生物學等多學科,聶舟課題組同樣是一支多學科交叉的研究小組,該實驗室的科研工作正是建立在多學科交叉基礎之上。
“我們的工作涵蓋了多門學科,我希望這些工作能夠真正對其他學科的研究有一定的幫助和意義。長遠來看,希望我們實驗室能夠為解決其他學科特別是生物學、醫學等相關問題提供更多真正有意義的研究。”聶舟說。
談及自己的科研之路,聶舟告訴生輝,自己從事科研工作的初心想做一些自己真正感興趣且不一樣的工作。從興趣出發,站在不同的角度,做出一些具有特色且有望解決臨床需求的工作。
事實上,上文提及DNA分子機器人的靈感就來自于他在工作中的不走尋常路。他在泰國看到騎象人的時候,就在想能不能開發出一種分子機器人,讓它帶著細胞行走;看到人們喜歡用激光筆逗貓,貓也喜歡追著光點跑,他想是否也能讓細胞像貓一樣追著光跑……
他實驗室的研究項目可以簡單總結為三個方向,通過非遺傳改造方式調控細胞功能、RNA成像、CRISPR/Cas檢測工具。
在實驗室開展基礎研究的同時,他對研究項目的轉化工作也有自己的見解。“轉化的一個關鍵在于降低領域內知識壁壘和使用的門檻,可以方便非本領域的專家使用。”聶舟繼續說。
病毒RNA成像是其實驗室的重要研究方向同時也是轉化落地進展比較快的研究項目。病毒RNA成像是通過小分子探針直接在活細胞中觀察病毒RNA的時空動態分布信息,這就像是給RNA貼上了一個“熒光標簽”。這種方式以病毒基因組上特定二級結構(G-四聯體)為靶點,開發小分子熒光探針,探針本身不會發光,不過一旦與病毒基因組特異性結合后能夠成像和發光,成像方式更為簡便。這樣就可以幫助研究人員實時觀察病毒在細胞里面的復制以及細胞間相互感染的過程。
據悉,2019年他們在RNA成像上的工作首次證明了利用病毒RNA本身固有的結構特征實現成像的可能性。這項研究中發展的新型G-四聯體熒光探針ThT-NE已經由全球最大的化學試劑公司Sigma-Aldrich公司(現已被默克收購)實現了商業化,已經面向市場銷售。
聶舟還提到轉化工作的最終目的就在于相關研究能夠真正解決一些生物學領域的問題。“我們不斷向其它領域的底層思路進行學習,包括合成生物學、生物化學等,希望不斷發展新的化學工具來嘗試解決生物學問題,為生物學問題提供真正有用的方法。從這個角度出發,才能有條不紊地加快真正推向應用的步伐。”聶舟總結道。(綜合整理報道) (編輯/諾伊克)
