CHD5在肺腺癌中的表達及與患者預后的相關性
欒艷超 韓青松 劉佳坤 馬靜
肺癌作為危害人類健康最常見的惡性腫瘤,近年來發病率呈快速上升的趨勢,肺癌是目前全球患病率和死亡率均排第1位的肺部惡性腫瘤性疾病,值得注意的是,我國已經成為全球肺癌發病率最高的地區[1]。肺腺癌是最常見的肺癌亞型,也是非吸煙肺癌患者中最常見的肺癌組織學類型[2]。預計2018年全球將有新發肺癌病例210萬,新發死亡病例180萬,死亡人數占癌癥總體死亡人數的18.4%[3]。盡管近些年來由于靶向治療等新的治療方式的飛速發展使得肺癌的治療取得重大進展,但是由于約70%的患者在診斷為肺癌時就已經出現遠處轉移或為局部晚期[4]。因此,繼續深入研究新的肺癌治療靶標和預后生物標志物顯得尤為迫切。CHD5基因(染色質解旋酶DNA結合蛋白5) 定位于人染色體1p36(1號染色體短臂3區6帶)上,最新的研究表明,在惡性腫瘤細胞調控中的抑癌基因作用已引起廣泛關注[5]。Bagchi等[6]對小鼠模型的研究證實CHD5基因通過p19Ar/p53通路發揮作用,具有調控細胞過度增殖、分化障礙或凋亡抑制,參與腫瘤的發生和發展。動物實驗也表明多種腫瘤組織基因組1p36片段常伴有缺失[7,8],且越來越多的研究表明,CHD5因在腫瘤組織中表達下調,從而加速腫瘤進展[9,10]。而隨后的功能性研究也提示CHD5是位于1p36的基因片段內的一個強有力的腫瘤抑制因子,且在多種惡性腫瘤中異常表達與腫瘤的發生、侵襲轉移和預后密切相關;然而,有關CHD5與肺腺癌關系的研究還少有報道。基于以上研究背景,本研究旨在通過檢測LUAD組織中CHD5表達情況,并結合患者臨床病理特征和預后資料分析其與預后的關系,以期為尋找肺腺癌臨床生物靶點的開發提供理論依據,報告如下。
1 資料與方法
1.1 一般資料 收集2013年1月至2014年12月在我科進行手術切除的肺腺癌患者組織標本130例。選取標準:所有入組患者為術前未接受抗腫瘤治療的初診患者,且均排除既往惡性腫瘤病史。所有患者隨訪截止時間2019年12月,且均已經簽署知情同意書,并通過我院倫理委員會審核、批準。130例納入研究的患者中,男63例,女67例;年齡45~81歲,平均年齡(60.4±9.2)歲;其中≥60歲74例,<60歲56例;腫瘤直徑<3 cm 70例,≥3 cm 60例;淋巴結轉移69例,無淋巴結轉移61例;存在遠處轉移9例,不存在遠處轉移121例;未接受術后治療54例;而接收術后治療76例(其中接受單純化療46例,接收單純放療5例,接收單純靶向治療10例;同時接受放化療10例,同時接受放化療和靶向治療2例,同時接受化療和靶向治療2例,同時接受放療和靶向治療1例)。
1.2 試劑 Trizol試劑購自USA Invitrogen,逆轉錄試劑盒(High-Capacity cDNA Reverse Transcription Kit with RNase Inhibitor),實時定量PCR( qPCR) 試劑盒上海Promega公司,AGAP2-AS1購自美國CST公司,內參GAPDH 引物購自上海生工生物工程有限公司。
1.3 總RNA提取和qPCR 向100 mg 組織中加入1 ml TRIzol,離心后用氯仿異丙醇提取RNA,DEPC 水重懸后經3∶1苯酚/氯仿萃取和乙醇純化,取1 μg 總RNA 采用High-Capacity cDNA Reverse Transcription Kit with RNase Inhibitor 合成cDNA,使用SYBR Premix ExTaq 試劑盒內試劑按操作說明進行實時熒光定量PCR方法檢測CHD5的表達量,并以GAPDH為內參基因,通過2-△△Ct法計算倍數變化。實時熒光定量PCR所用的CHD5上游引物為:5’-F-GCCCGTGAGCCTTCCTAAG-3’,下游引物為:5’-GGGGAGTAGTCACTGCCTTC-3’。GAPDH的上游為:5’-GGCTGTATTCCCCTCCATCG-3’,下游引物為5’-CCAGTTGGTAACAATGCCATGT-3’。并通過Cutoff Finder[11]篩選出CHD5表達水平的最佳分界值,該程序可基于對數秩檢驗(Log-rank test)計算最佳分界值。
1.4 隨訪 通過常規門診復查、電話回訪等形式隨訪,隨訪截止時間為2019年12月。隨訪內容及記錄情況包括:病情、病史詢問、專科查體、腫瘤標志物檢驗、胸部CT檢查等。患者術后的治療方案、復發及死亡等。

2 結果
2.1 CHD5在LUAD組織中的表達情況 qRT-qPCR結果顯示,與癌旁組織相比,130例LUAD組織中CHD5表達水平顯著降低 (P<0.001)。見表1。

表1 LUAD與癌旁組織CHD5表達情況
2.2 CHD5表達與LUAD患者的臨床病理特征關系 以130例癌組織中CHD5表達的中位數作為分界點,將患者分為高表達組65例和低表達組65例,兩組相比存在顯著差異(P<0.01)。進一步分析CHD5表達與LUAD臨床病理特征的關系,結果顯示CHD5表達與臨床分期、淋巴結轉移、遠處轉移和術后治療顯著相關(P<0.05),與年齡、性別、吸煙和腫瘤直徑無關。見表2、3。
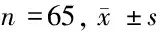
表2 LUAD組織中CHD5高表達組與低表達組表達情況
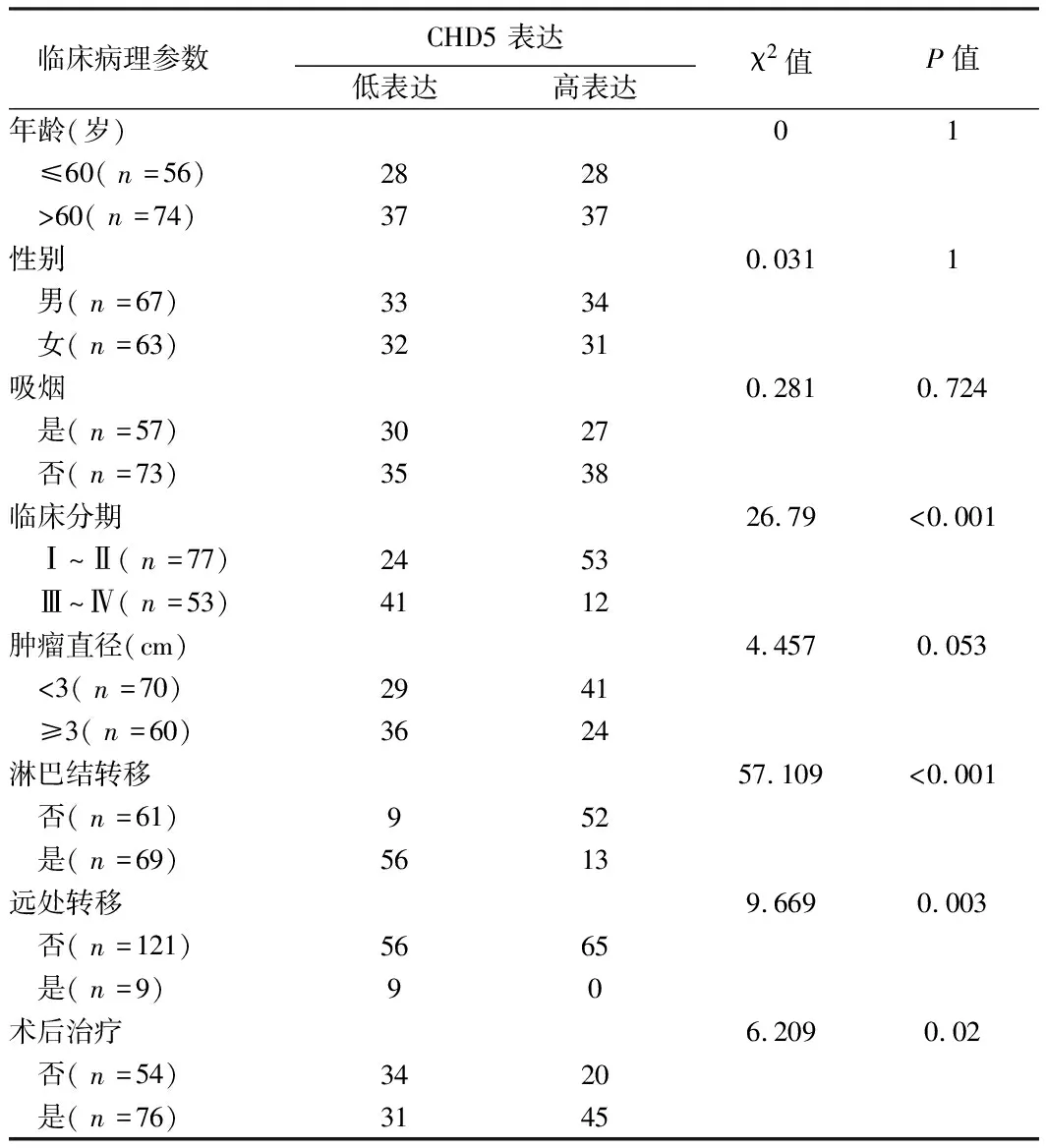
表3 130例LUAD組織中CHD5的表達與臨床病理特征關系 例
2.3 CHD5的表達水平與LUAD患者預后的關系 至隨訪截止日期,生存分析結果顯示, CHD5高表達患者的中位DFS為49.8個月,長于65例低表達患者的30.9個月(P<0.01),其中臨床分期(Ⅲ~Ⅳ期)、腫瘤直徑(≥3 cm)、有淋巴結轉移、未術后治療的患者預后較差(P<0.01)。見表4。

表4 130例LUAD患者的DFS情況
2.4 LUAD患者DFS的單因素和多因素分析 單因素生存分析結果顯示,臨床分期、腫瘤直徑、淋巴結轉移、遠處轉移、術后治療和CHD5表達水平與LUAD患者的DFS有關(P<0. 01);進一步將上述因素納入多因素Cox比例風險回歸模型,結果顯示,術后治療(HR=0.290,95%CI:0.129~0.652)和CHD5表達水平(HR=0.181,95%CI:0.073~0.447)為影響DFS的獨立因素(P<0. 01)。見表5,圖1、2。
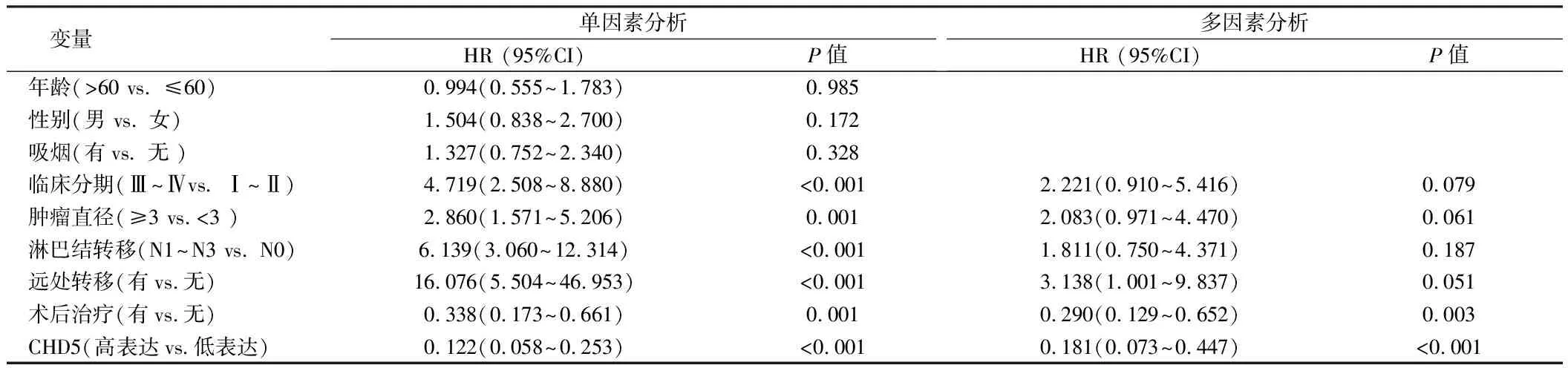
表5 LUAD患者DFS的單因素和多因素Cox比例風險模型分析

圖1 肺腺癌患者總生存的單因素Cox比例風險模型分析
3 討論
最新的研究發現,肺癌已發展成為全球發病和死亡率最高的惡性腫瘤之一,因其局部侵襲、遠處轉移及耐藥等原因,每年因肺癌死亡的患者約占所有癌癥死亡患者總數的1/5,居癌癥之首[12]。肺癌相關基因的研究一直是全世界關注的熱點,然而,肺癌的發生和發展機制并未完全闡明。據報道生存時間超過5年的患者僅有13%,且其死亡率與發病率的比值為0.87[13]。因此,眾多研究人員希望通過肺癌的發病機制出發,不僅尋找新的微創的生物標志物來提高早期診斷的準確性,研制出新的化療藥物及分子靶向藥物,還可以減少不必要的創傷性的診療并改善預后。

圖2 肺腺癌患者總生存的多因素Cox比例風險模型分析
隨著分子生物學飛速發展,越來越多的研究表明,肺癌的形成是一個常伴有多種基因功能失常的過程,包括抑癌基因的滅活和原癌基因的激活等,并促進腫瘤惡性化,進一步增強了癌細胞的遷移和侵襲能力[14]。研究發現,當惡性腫瘤組織內CHD5缺失或是表達下降時,導致抑制腫瘤細胞發展、發生的調控系統出現功能降低,進一步提示CHD5為抑癌基因[15]。Brodeur等[16]通過對神經母細胞瘤組織及其相應細胞系中CHD5基因表達水平的檢測,發現CHD5表達水平較正常組織均顯著降低,且神經母細胞瘤患者的臨床及預后與CHD5表達水平也顯著相關。最近研究發現CHD5基因突變也存在于成神經細胞瘤、乳腺癌中[17,18]。而在LUAD組織中的表達情況少有報道。
在本研究中,通過RT-PCR檢測我院130例肺腺癌組織中CHD5的表達情況;同時借助Cutoff Finder程序將130例LUAD患者分為70例高表達組和60例低表達組,結果顯示,2組間比較有顯著的統計學差異,且CHD5低表達的患者預后較差。統計學分析進一步證實CHD5表達與LUAD組織的腫瘤大小、淋巴結轉移、遠處轉移和術后治療顯著相關,這也提示CHD5基因很可能成為肺腺癌的一個潛在的抑癌基因提供了有力證據。此外本研究通過單因素Cox比例風險模型分析發現,腫瘤大小(P<0.01)、腫瘤分期(P<0.01)、淋巴結轉移(P<0.01)、腫瘤的遠處轉移(P<0.01)和術后治療(P<0.01)和CHD5表達水平(P<0.01)與患者的總生存相關。進一步通過多因素Cox比例風險模型分析,發現腫瘤分期(P<0.01)、術后治療(P<0.01)和CHD5表達量(P<0.01)是影響患者總生存的獨立預測因,進一步提示其可能是LUAD預后不良的因素。同時,Kaplan-Meier生存分析發現CHD5表達水平與LUAD患者的總生存期呈正相關(P<0.01),提示CHD5在LUAD中可能發揮著抑癌基因的作用。但是,CHD5在LUAD中具體的機制及生物學功能尚不清楚,亟需進一步闡明。如果CHD5的生物學作用能在體內外實驗中得到進一步驗證,那么其將有助于LUAD的檢測與治療。本研究由于是回顧性分析,且樣本量較小(130例),無法充分控制混雜因素的影響,尚不足以指導臨床實踐,但卻為后續的臨床和基礎研究提供了有意義的參考。
綜上所述,CHD5表達量與LUAD的腫瘤分期、術后治療和預后顯著相關,可能是LUAD診斷與預后的標志物,為靶向治療腫瘤提供重要參考價值。同時我們的研究提示,CHD5低表達組患者的總生存顯著低于CHD5高表達組患者,因此,是否可以通過上調CHD5表達來抑制LUAD細胞的增殖與侵襲將是我們進一步研究的課題。

