高血壓病氣虛血瘀證患者血清對CRL-1730線粒體細胞色素C凋亡途徑的影響?
胡小勤,蒙 丹,付 蓉,郝二偉,2,段慧明,曾學文,3△
1廣西中醫藥大學,廣西 南寧 530022;2廣西中藥藥效研究重點實驗室;3金華高等研究院
高血壓病是臨床常見的一種心血管疾病[1],氣虛血瘀證是高血壓病的常見中醫證型[2],高血壓病[3]及氣虛血瘀證[4]的形成都與血管內皮細胞損傷存在密切的關系,也都具有細胞凋亡的病理生理學特征。在前期研究中,采用流式細胞儀檢測了高血壓病氣虛血瘀證患者的血清作用于內皮細胞后的細胞凋亡率,發現高血壓病氣虛血瘀證組細胞凋亡率明顯升高;并發現透射電鏡下細胞線粒體腫脹或空泡變,管網狀結構碎裂,嵴消失,證實了高血壓病氣虛血瘀證患者血清可以誘導血管內皮細胞凋亡[5],但誘導凋亡的具體機制尚不明確。有研究表明[6],線粒體在細胞凋亡中起著中心調控作用,細胞色素C(cytochrome-c,Cyt-C)是線粒體介導的細胞凋亡途徑中不可缺少的重要因子,在凋亡過程中起著關鍵作用。線粒體Cyt-C途徑主要由Bcl-2、Bax、Cyt-C、Apaf-1、Caspase-9、Caspase-3等分子組成[7]。本實驗以體外培養的人臍靜脈血管內皮細胞株(CRL-1730)為觀察對象,主要觀察高血壓病氣虛血瘀證患者的血清對內皮細胞線粒體Cyt-C途徑的影響,進一步闡明高血壓病氣虛血瘀證患者血清誘導血管內皮細胞凋亡的機制。
1 材料與方法
1.1 實驗材料人臍靜脈內皮細胞株CRL-1730,由復旦生物醫學研究院細胞資源中心提供,批號:CP-H082。
1.2 實驗動物60只SPF級SD大鼠,雌雄各30只,體質量180~210 g,由廣西醫科大學實驗動物中心提供,實驗動物生產許可證號:SCXK(桂)2014-0002。飼養條件:大鼠每天喂養一次飼料,兩天更換一次墊料與水。
1.3 實驗試劑胎牛血清(fetal bovine serum,WS500T)、青霉素(penicillin,I9532-10MG)、鏈霉素(streptomycin,批 號:57-92-1);高 糖DMEM(Gibco,批號:PM150210);0.25%胰酶-0.02%EDTA(北京索萊寶,批號:03-050-1A/B);一抗Cyt-C(Sant Cruz,YT154)、Apaf-1(Sant Cruz,EK-R38301)、Caspase-9(Sant Cruz,批號:BS6444);二抗Cy-3羊抗鼠(Abgree,批號:BHR102);正常熔點瓊脂糖(normal melting point agarose,NMA)、低熔點瓊脂糖(low melting point agarose,LMA)(TAKARA,批號:6132-04-3);Cyt-C、Apaf-1、Caspase-9引物(上海康成生物科技有限公司,批號:HZ-2654);溴化乙錠(ethidium bromide,EB)(Sigma,批號:1239-45-8);三(羥甲基)胺基甲烷[tris(hydroxymethyl)amine methane,Tris](南京凱基,批號:KGF019-1);RIPA組織細胞快速裂解液(Boster,批號:08J15B02);乙二胺四乙酸二鈉(ethylenediamine tetraacetic acid disodium,Na2EDTA)(上海前尖生物科技有限公司,批號:13254-36-4)。
1.4 實驗儀器1000 μL移液器(Eppendorf公司);TGL型臺式低溫離心機、CO2培養箱(Thermo公司);DYY-6C型電泳儀水平、XCell SureLock Mini-Cell型電泳槽(美國BIO-RAD公司);MA-688型實時熒光定量PCR儀(Thermo Fisher Scientific公司)。
1.5 實驗方法
1.5.1 臨床資料 選擇2016年7月至2017年1月在廣西中醫藥大學附屬瑞康醫院心血管內科就診的高血壓病[8]患者80例,分為高血壓氣虛血瘀證[9-10]組和高血壓非氣虛血瘀證組,每組40例;健康體檢者20例為健康對照組。3組基線資料比較,差異無統計學意義(P>0.05),具有可比性。
1.5.2 人血清采集 空腹狀態下,取每人外周血約8 mL,放入帶帽無菌不抗凝試管,自凝后,以4℃,離心半徑10 cm,3000 r/min離心15 min,取上清液置于無菌EP管,混合均勻,滅活,過濾除菌,置于-80℃,備用。每組血清混合后用于細胞學實驗。
1.5.3 動物分組及處理1)將60只SD大鼠隨機分為空白對照組(30只)和補陽還五湯高、中、低劑量組(各10只)。2)補陽還五湯原方劑量進行水煎提取(生黃芪120 g,當歸尾6 g,赤芍5 g,地龍3 g,川芎3 g,紅花3 g,桃仁3 g)。按照體表面積換算用藥量,補陽還五湯高、中、低劑量組大鼠分別用等效劑量的24、12、6 g/(kg·d)灌胃,每日2次,兩次間隔12 h,連續3天。空白對照組以等體積的生理鹽水灌胃。
1.5.4 動物血清采集1)含藥血清:于末次灌胃1 h后頸動脈放血,自凝后以4℃,離心半徑10 cm,3000 r/min離心15 min,取上清,將同組血清混合,放入無菌EP管,混勻,滅活,過濾除菌,-80℃凍存備用。2)空白血清:空白對照組以同法取血清。
1.5.5 混合血清培養液制備 各組混合血清培養液制備:高血壓病氣虛血瘀證組、高血壓病非氣虛血瘀證組、健康對照組分別以各組10%血清+10%空白血清+80%的高糖DMEM培養基,補陽還五湯各劑量組分別以10%補陽還五湯高、中、低劑量含藥血清+10%高血壓病氣虛血瘀證患者血清+80%高糖DMEM培養基。
1.5.6 細胞培養 取對數生長期內皮細胞,消化、傳代后,按1×105/mL密度,接種于25 mL培養瓶,4 mL/瓶,每組6瓶,共36瓶,每2瓶為一個樣品。先用含10%胎牛血清的高糖DMEM培養基培養24 h后,在再換無血清培養液同步化以后,分為6組,繼續培養24 h。
1.6 觀察指標
1.6.1 激光共聚焦顯微鏡檢測內皮細胞Cyt-C蛋白的表達和分布 取生長良好的人臍靜脈內皮細胞對數生長期細胞,消化、傳代,以3×105/mL接種于6孔板,按上述實驗分組分為6組,每組設置6個復孔,每孔2 mL的培養液,培養24 h后,換無血培養液使細胞同步化24 h,再用混合血清培養液培養24 h。再進行以下操作:棄細胞上清液;PBS洗2次;每孔加入4%多聚甲醛,室溫固定細胞,10 min;PBS洗5 min,3次;TritonX-100(0.3%)通透細胞,20 min;PBS洗5 min,3次;每孔加2%BSA封閉液,37℃30 min;加一抗:4℃孵育過夜;PBS洗5 min,3次;加二抗:37℃避光孵育60 min;PBS洗5 min,3次;甘油:PBS=1∶1封片,避光,上機檢測。
1.6.2 蛋白免疫印跡法(Western Blot)檢測內皮細胞Cyt-C、Apaf-1、Caspase-9蛋白的表達 細胞接種于25 mL培養瓶中,按上述分組和處理,隨機分為6組,每組3瓶。棄培養液,冰上裂解10 min(裂解液∶NaF∶PMSF=100∶5∶1);細胞刮離并收集細胞;4℃,離心半徑10 cm,12 000 r/min離心15 min,多功能酶標儀測定總蛋白含量,調整上樣孔濃度為80 μg進行電泳。電泳完備后轉膜;50 g/L脫脂牛奶封閉1 h;各蛋白單抗和β-actin 4℃孵育過夜;5 g/L TritonX-100洗 膜3次;IRDyeTM 800標記的山羊抗小鼠二抗(1∶2000)孵育2 h;1 g/L Tween-20洗膜3次;Odyssey雙紅外成像系統掃描成像,即可獲得結果圖像。各蛋白條帶灰度值與β-actin灰度值相比作為各蛋白相對表達量。
1.6.3 酶聯免疫法(ELISA)檢測內皮細胞Cyt-C、Apaf-1、Caspase-9細胞培養上清液蛋白的含量 取生長良好的對數生長期CRL-1730,消化、傳代以1×105/mL種24孔板,共分6組,每組設置6孔,每孔各500 uL的培養液,培養24 h后,換無血培養液使細胞同步化24 h,最后再用混合血清培養液培養24 h,再換無血培養液使細胞同步化24 h,然后取細胞培養上清液于4℃,離心半徑10 cm,1000 r/min離心15 min,取上清液,凍存待測。按ELISA試劑盒說明檢測細胞培養上清液蛋白含量。
1.7 統計學方法采用SPSS 24.0軟件進行數據統計分析,計量資料以±s表示,采用t檢驗,多組間比較采用單因素方差分析,以P<0.05表示差異有統計學意義。
2 結果
2.1 激光共聚焦顯微鏡檢測內皮細胞Cyt-C蛋白表達和分布情況高血壓病氣虛血瘀證組及高血壓病非氣虛血瘀證組與健康組比較,Cyt-C的表達均明顯升高(P<0.01);補陽還五湯各劑量組明與高血壓病氣虛血瘀證組比較,Cyt-C的表達顯降低(P<0.01或P<0.05)。見圖1、表1。
表1 激光共聚焦顯微鏡下各組內皮細胞Cyt-C蛋白表達比較(±s)
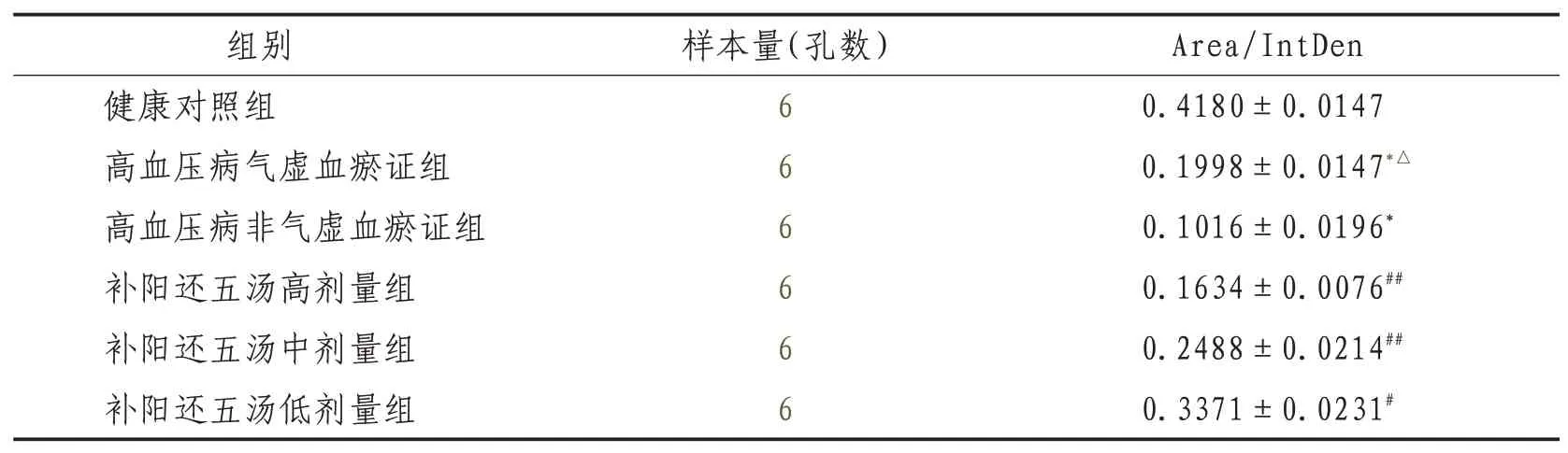
表1 激光共聚焦顯微鏡下各組內皮細胞Cyt-C蛋白表達比較(±s)
注:與健康對照組比較,*表示P<0.01;與高血壓病非氣虛血瘀證組比較,△表示P<0.05;與高血壓病氣虛血瘀證組比較,#表示P<0.05,##表示P<0.01
?

圖1 激光共聚焦顯微鏡觀察各組Cyt-C的分布(×400)
2.2 Western Blot檢測內皮細胞Cyt-C、Apaf-1、Caspase-9相關蛋白表達高血壓病氣虛血瘀證組及高血壓病非氣虛血瘀證組與健康組比較,Cyt-C、Apaf-1、Caspase-9的表達均明顯升高(P<0.01或P<0.05);補陽還五湯各劑量組與高血壓病氣虛血瘀證組比較,Cyt-C、Apaf-1、Cas-pase-9的表達明顯下降(P<0.01或P<0.05)。見表2、圖2。
表2 Western Blot檢測各組內皮細胞Cyt-C、Apaf-1、Caspase9蛋白表達量比較(±s)
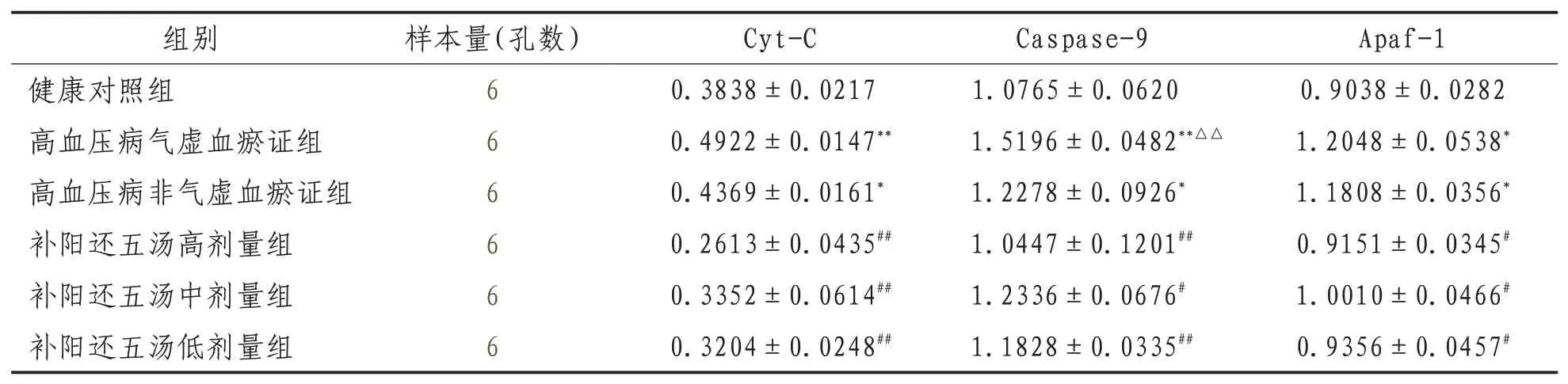
表2 Western Blot檢測各組內皮細胞Cyt-C、Apaf-1、Caspase9蛋白表達量比較(±s)
注:與健康對照組比較,*表示P<0.05,**表示P<0.01;與高血壓病非氣虛血瘀證組比較,△表示P<0.05,△△表示P<0.01;與高血壓病氣虛血瘀證組比較,#表示P<0.05,##表示P<0.01
?
2.3 ELISA檢測內皮細胞Cyt-C、Apaf-1、Caspase-9細胞培養上清液中蛋白表達高血壓病氣虛血瘀證組及高血壓病非氣虛血瘀證組與健康組比較,Cas-pase-9、Apaf-1、Cyt-C表達均明顯升高(P<0.01或P<0.05);高血壓病氣虛血瘀證組與高血壓病非氣虛血瘀證組比較,表達明顯升高(P<0.01或P<0.05);補陽還五湯各劑量組與高血壓病氣虛血瘀證組比較,表達明顯降低 (P<0.01或P<0.05)。見表3。??
表3 ELISA檢測各組細胞培養上清液中Cyt-C、Apaf-1、Caspase9蛋白含量比較(±s)
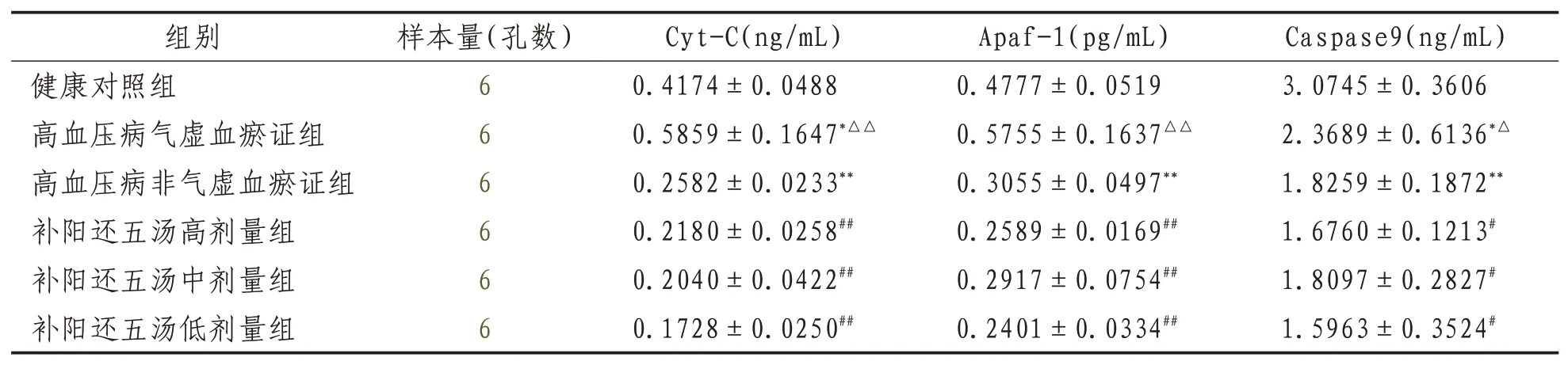
表3 ELISA檢測各組細胞培養上清液中Cyt-C、Apaf-1、Caspase9蛋白含量比較(±s)
注:與健康對照組比較,*表示P<0.05;**表示P<0.01;與高血壓病非氣虛血瘀證組比較,△表示P<0.05,△△表示P<0.01;與高血壓病氣虛血瘀證組比較,#表示P<0.05,##表示P<0.01
?
3 討論
細胞凋亡通過細胞內的遺傳機制使細胞走向死亡,最終整個細胞的成分被消化降解[11]。經典的細胞凋亡途徑有兩條,分別為細胞表面死亡受體途徑(或稱細胞外途徑)和線粒體引發途徑(或稱細胞內途徑)[12]。
在細胞凋亡過程中,線粒體膜通透性轉換孔(mitochondrial permeability transition pore,MPTP)過度開放,線粒體跨膜電位降低,導致一些相關的促凋亡因子,如細胞色素C(Cytochrome C)、凋亡誘導因子(apoptosis inducing factor,AIF)等從線粒體釋放到細胞質中[13]。目前,Cyt-C和Caspase-9是線粒體凋亡信號通路的關鍵調節因子已得到證實[14]。實驗研究表明,Cyt-C不僅可以直接介導細胞凋亡,還可以通過干擾呼吸鏈電子傳遞的運輸、促進活性氧自由基的產生、阻斷能量合成等方式間接參與細胞凋亡過程[15-16],確定細胞色素C是線粒體啟動凋亡程序的關鍵物質[17]。此外,以Caspase-9為核心的線粒體凋亡途徑是WNT通路下游的一個凋亡通路,Caspase-9是線粒體凋亡信號通路的關鍵調節因子也已得到證實[14]。
凋亡蛋白酶活化因子1(apoptosis protease activating factor-1,Apaf-1)是細胞質中的一種蛋白質,其氨基端有半胱氨酸蛋白酶募集域,可促進多個Caspase家族成員前體活化[18]。有研究表明,細胞線粒體中的細胞色素C通過線粒體外膜,大量釋放到胞液中,與Apaf-1在ATP作用下促使Apaf-1激活,活化的Apaf-1依次激活Caspase-9和Caspase-3,最終導致細胞凋亡的發生[19]。說明Apaf-1是線粒體凋亡信號通路中關鍵調節因子。
目前,對Cyt-C釋放后作用的機制已經較為清楚[20],線粒體釋放Cyt-C分兩步,即先從呼吸鏈上游離出來,而后才被釋放入胞漿。入胞漿的Cyt-C與Apaf-1羧基端的WD重復序列結合,誘導Apaf-1變構并進一步結合Caspase-9前體,使Caspase-9復合體自發激活。Cyt-C、Apaf-1與Caspase-9復合物就是凋亡體,凋亡體繼續激活下游的Caspase-3,引發級聯反應,從而導致凋亡。
實驗結果表明,與健康組比較,高血壓病氣虛血瘀證組及高血壓病非氣虛血瘀證組Cyt-C、Apaf-1、Caspase-9蛋白表達均明顯升高;與高血壓氣虛血瘀證組比較,補陽還五湯各劑量組Cyt-C、Apaf-1、Caspase-9蛋白表達明顯降低。
結合前期實驗結果及本次的實驗結果,我們認為:高血壓病氣虛血瘀證患者血清存在細胞凋亡,且凋亡過程中Caspase-3、Bax、Cyt-C、Apaf-1、Caspase-9的表達量均升高。說明高血壓病氣虛血瘀證患者血清誘導內皮細胞凋亡的機理與線粒體Cyt-C途徑密切相關。本課題對凋亡機制的研究現停留在蛋白層次,下一步擬從mRNA及非編碼RNA層次開展研究。

