褪黑素對牦牛黃體細胞生長及功能影響的研究
程華琴,袁鈺潔,羅 文, 3,高紹帥,葉林霞,3,李 鍵, 2*,殷 實, 2, 3*
(1.西南民族大學畜牧獸醫(yī)學院,成都610041; 2.西南民族大學 青藏高原動物遺傳資源保護與利用國家教育部重點實驗室,成都610041; 3.西南民族大學 現(xiàn)代生物技術(shù)國家民委重點實驗室,成都 610041)
牦牛(Bosgrunniens)主要生活在青藏高原及其毗鄰的高海拔地區(qū),是當?shù)啬撩竦闹饕?jīng)濟收入來源之一。但因高原地區(qū)寒冷,營養(yǎng)不足等,導致牦牛性成熟晚、受孕率低且犢牛死亡率高[1],嚴重限制了高原畜牧經(jīng)濟的發(fā)展。黃體(corpus luteum, CL)是哺乳動物卵巢排卵后形成的一種臨時性的內(nèi)分泌腺,其主要功能是分泌孕酮(progesterone, P4),而孕酮是妊娠建立和維持的重要調(diào)節(jié)激素,因此,黃體功能的正常發(fā)揮與母畜受孕率及生產(chǎn)率息息相關(guān)。機體有氧代謝過程中產(chǎn)生的活性氧(reactive oxygen species, ROS)對動物繁殖具有重要影響。在大鼠卵巢中,生理水平的ROS能夠促進卵母細胞減數(shù)分裂的恢復(fù)和成熟[2-4]。然而,ROS的大量積聚則會引起氧化應(yīng)激,從而導致細胞衰老、凋亡,甚至發(fā)生炎癥反應(yīng)[5-6]。研究發(fā)現(xiàn),ROS會導致卵母細胞質(zhì)量下降及黃體期缺陷[7],黃體細胞發(fā)生氧化應(yīng)激時,孕酮分泌水平受到嚴重影響[8]。
抗氧化劑是一類能幫助捕獲并中和自由基的物質(zhì),在正常生理條件下,機體內(nèi)存在的超氧化物歧化酶(superoxide disnutase, SOD)、谷胱甘肽過氧化物酶(glutathione peroxidase, GPX)、過氧化物酶(peroxidase, POD)、過氧化氫酶(catalase, CAT)等,可以保護機體不受活性氧和自由基損害,部分抗氧化劑還可以促進孕酮的分泌[9]。褪黑素(melatonin, MT)是由松果體分泌的具有多種生物活性的神經(jīng)內(nèi)分泌激素,具有抗炎、抗衰老、抗凋亡及強效抗氧化作用[10-13]。既往研究表明,褪黑素可降低多種細胞的凋亡和氧化應(yīng)激水平[13-17],Zhang等[18]發(fā)現(xiàn),褪黑素可以促進小鼠卵巢顆粒細胞的有絲分裂以及卵泡發(fā)育,提高卵母細胞質(zhì)量,并對豬卵母細胞成熟過程中馬拉硫磷引起的細胞缺陷有一定保護作用[19]。褪黑素具有分解多種氧化自由基的特性[20],其可以通過受體介導和自生活性這兩種途徑發(fā)揮抗氧化作用,降低體內(nèi)氧化應(yīng)激水平。有研究表明,褪黑素能通過與褪黑素Ⅰ型受體(MT1)和褪黑素Ⅱ型受體(MT2)結(jié)合,促進抗氧化基因的表達及抗氧化酶的合成,減輕順鉑誘導的小鼠卵巢氧化損傷[21]。此外,褪黑素能夠通過減少人卵母細胞的氧化應(yīng)激來提高受精率[22],受精后人體內(nèi)高濃度的褪黑素能促進黃體細胞分泌孕酮[23],對胚胎健康發(fā)育具有重要意義。關(guān)于褪黑素對動物生殖方面影響的文獻眾多,但其對黃體細胞功能影響方面的研究較少,本研究成功分離培養(yǎng)了牦牛黃體細胞,在細胞層面探討了褪黑素對牦牛黃體細胞命運、抗氧化性及孕酮分泌的影響,并初步討論了其對黃體細胞影響的作用機制,為在細胞層面使用褪黑素提高牦牛繁殖性能提供了理論依據(jù)。
1 材料與方法
1.1 主要儀器與設(shè)備
二氧化碳培養(yǎng)箱(Thermo,美國),低溫高速離心機(Thermo,美國),超純水系統(tǒng)(MILLI-Q,法國),熒光定量PCR儀(Bio-Rad,美國),渦旋振蕩儀(Stuart,英國),紫外可見分光光度計(島津,日本);DMEM/F-12 培養(yǎng)基(Gibco公司),胎牛血清(Gibco公司),Ⅳ型膠原酶(BioFroxx),胰蛋白酶-EDTA 消化液(索萊寶),青霉素-鏈霉素溶液(索萊寶),TRIzol(Invitrogen)、PrimeScriptTMRT Reagent Kit 反轉(zhuǎn)錄試劑盒(TaKaRa),ChamQ Universal SYBR qPCR Master Mix(諾唯贊生物科技有限公司),褪黑素(上海麥克林生化有限公司),Cell Counting Kit-8(MCE)、Luzindole(MCE),牛活性氧(ROS)ELISA 試劑盒(睿信生物科技有限公司),牛孕酮(PROG)ELISA試劑盒(睿信生物科技有限公司)。
1.2 牦牛黃體細胞的分離與培養(yǎng)
牦牛卵巢采自四川成都周邊屠宰場,健康成年雌性牦牛被屠宰后,立即用無菌的剪刀和鑷子取下牦牛卵巢組織,經(jīng)含雙抗的磷酸緩沖鹽溶液(PBS)清洗后,放入加有雙抗的生理鹽水保溫盒中帶回實驗室處理。牦牛黃體細胞的分離培養(yǎng)參照張文華[24]的操作方法并進行優(yōu)化。在超凈工作臺內(nèi),用PBS清洗后將黃體組織剪碎,加入約為黃體組織體積4~8倍的0.2% Ⅳ型膠原酶溶液在培養(yǎng)箱中消化。將消化液1 500 r·min-1離心5 min,吸棄上清后用DMEM/F-12 懸起沉淀,先后通過200和400目過濾篩,收集濾液再次離心,棄上清后,用含血清和雙抗的培養(yǎng)液制成單細胞懸液,接種于細胞培養(yǎng)皿,在38 ℃、5% CO2的培養(yǎng)箱中培養(yǎng)。待細胞生長融合度達到80% 以上時,消化細胞接種至新的培養(yǎng)皿中繼續(xù)培養(yǎng)。
1.3 黃體細胞增殖、活力檢測
將原代黃體細胞密度調(diào)整為1×104個·mL-1,接種于96孔板,38 ℃、5% CO2培養(yǎng)14 h后,更換無血清培養(yǎng)基再培養(yǎng)10 h。更換新的無血清培養(yǎng)基并添加不同濃度的MT,使其終濃度為0(Control)、25、125、250、500 pg·mL-1,并設(shè)置空白調(diào)零組。分別培養(yǎng) 1、2、3、4、5 d后取出96孔板,每孔添加10 μL CCK-8 溶液后孵育2 h,用酶標儀測定在450 nm處的吸光度。根據(jù)說明書公式計算細胞活力,以吸光度為縱坐標,培養(yǎng)天數(shù)為橫坐標,繪制細胞生長曲線。
1.4 細胞總RNA提取、cDNA制備及熒光定量PCR
用胰蛋白酶消化細胞轉(zhuǎn)移至無酶EP管中,離心,棄上清后向EP管中加入TRIzol溶液,在渦流儀上劇烈振蕩以利于破壁。向EP管中加入氯仿,振蕩混勻后于冰上靜置15 min。4 ℃、12 000 r·min-1離心15 min,吸取200 μL上清液轉(zhuǎn)移到新的無酶EP管中,加入等體積異丙醇,振蕩混勻。冰上靜置15 min,4 ℃、12 000 r·min-1離心10 min,棄上清留沉淀,用75% DEPC乙醇洗滌沉淀物,4 ℃、7 500 r·min-1離心5 min,再次洗滌獲得RNA沉淀,風干后,用DEPC水將其溶解,紫外分光光度計測定RNA的濃度及純度。按照PrimeScriptTMRT Reagent Kit反轉(zhuǎn)錄試劑盒操作說明書對合格RNA樣品進行反轉(zhuǎn)錄,反應(yīng)條件:37 ℃ 15 min,85 ℃ 5 s,并對cDNA進行濃度和純度檢測,以合格樣品為模板進行qRT-PCR。根據(jù)NCBI公布家牛(BosTaurus)的基因序列,用Primer Premier 5.0 進行引物設(shè)計(表1),采用ChamQ Universal SYBR qPCR Maste Mix試劑盒檢測黃體細胞中各基因的表達情況,包括:與增殖相關(guān)的增殖細胞核抗原(prolifeiating cell nuclear antigen,PCNA)、與凋亡相關(guān)的B淋巴細胞瘤-2(B-cell lymphoma-2,BCL-2)、Bcl-2相關(guān)X蛋白(Bcl-2 Assaciated X,BAX)、FAS細胞表面死亡受體(Fas cell surface death receptor,FAS),抗氧化相關(guān)基因SOD1、SOD2、GPX1、CAT以及孕酮合成相關(guān)基因3β羥基類固醇脫氫酶(3β-hydroxysteroid dehydrogenase,HSD3β)、類固醇急性調(diào)節(jié)蛋白(steroid acute regulation protein,STAR)及膽固醇側(cè)裂分解酶(P450 cholesterol side-chain cleavage enzyme,CYP11A1)。qRT-PCR反應(yīng)體系為cDNA 1 μL,上、下游引物各 0.5 μL,ddH2O 5.5 μL,SYBR Premix Ex TaqTMⅡ 7.5 μL。反應(yīng)條件為:95 ℃ 預(yù)變性 4 min;95 ℃ 變性10 s;60 ℃ 退火30 s,72 ℃ 延伸35 s,共40個循環(huán)。所有qRT-PCR反應(yīng)至少做3次重復(fù)試驗,所得目的基因Ct值用2-△△Ct法計算其相對表達量,并使用SPSS 21.0 進行方差分析。
1.5 MT及MT受體抑制劑Luzindole對黃體細胞ROS水平及抗氧化相關(guān)基因的影響
二代黃體細胞先后經(jīng)含血清的培養(yǎng)基和無血清培養(yǎng)基分別培養(yǎng) 14及10 h,更換無血清培養(yǎng)基并添加不同濃度的MT,使其終濃度為0(Control)、125、250、500 pg·mL-1,38 ℃、5% CO2培養(yǎng)。采集培養(yǎng)8 h后的細胞培養(yǎng)液,通過牛活性氧(ROS)ELISA試劑盒(靈敏度:最低檢測濃度小于1.0 IU·mL-1,檢測范圍12.5~400 IU·mL-1)檢測黃體細胞ROS水平。并進一步比較了不添加褪黑素(Control)、添加250 pg·mL-1MT 處理(250 pg·mL-1MT)以及250 pg·mL-1MT和250 pg·mL-1MT受體抑制劑Luzindole聯(lián)合處理(250 pg·mL-1MT+Luzindole)對培養(yǎng)了8 h黃體細胞ROS水平及“1.4”中抗氧化相關(guān)基因SOD1、SOD2、GPX1、CAT表達的影響。
1.6 MT及MT受體抑制劑Luzindole對黃體細胞孕酮分泌的影響
二代黃體細胞先后經(jīng)含血清的培養(yǎng)基和無血清培養(yǎng)基分別培養(yǎng)14及10 h,之后更換無血清培養(yǎng)基并添加不同濃度的MT,使其最終濃度為0(Control)、125、250、500 pg·mL-1,置于 38 ℃、5% CO2培養(yǎng)箱培養(yǎng),分別在24及36 h 各采集200 μL細胞培養(yǎng)液,使用牛孕酮(PROG)ELISA試劑盒(靈敏度:最低檢測濃度小于0.1 ng·mL-1)檢測細胞孕酮分泌水平。并進一步比較不添加褪黑素(Control)、添加250 pg·mL-1MT 處理組(250 pg·mL-1MT) 以及250 pg·mL-1MT和250 pg·mL-1MT受體抑制劑Luzindole聯(lián)合處理組(250 pg·mL-1MT+ Luzindole)黃體細胞培養(yǎng)24 h 后的孕酮分泌水平,并檢測3組細胞中的孕酮合成相關(guān)基因HSD3β、STAR和CYP11A1 mRNA的表達情況。
1.7 統(tǒng)計學分析
所有組別的試驗至少設(shè)3個重復(fù),試驗數(shù)據(jù)采用 SPSS 21.0 軟件處理,用 ANOVA 進行顯著性檢驗,SSR法進行多重比較,P<0.05 表示差異顯著,P<0.01 表示差異極顯著。
2 結(jié) 果
2.1 不同濃度MT對牦牛黃體細胞增殖及活力的影響
由圖1A可知,Control組1~4 d OD 值皆極顯著上升(P<0.01),4 d后OD值無明顯變化;而4個MT處理組(25、125、250、500 pg·mL-1MT)第1~2日OD值極顯著上升(P<0.01),2 d后OD值無明顯變化。由此表明,MT對牦牛黃體細胞有促增殖作用,加速細胞進入平臺期。由圖1B可知,25、125、250、500 pg·mL-1MT處理48 h后牦牛黃體細胞的活力與Control組相比分別顯著升高了16.0%、43.7%、64.0%和34.7%。
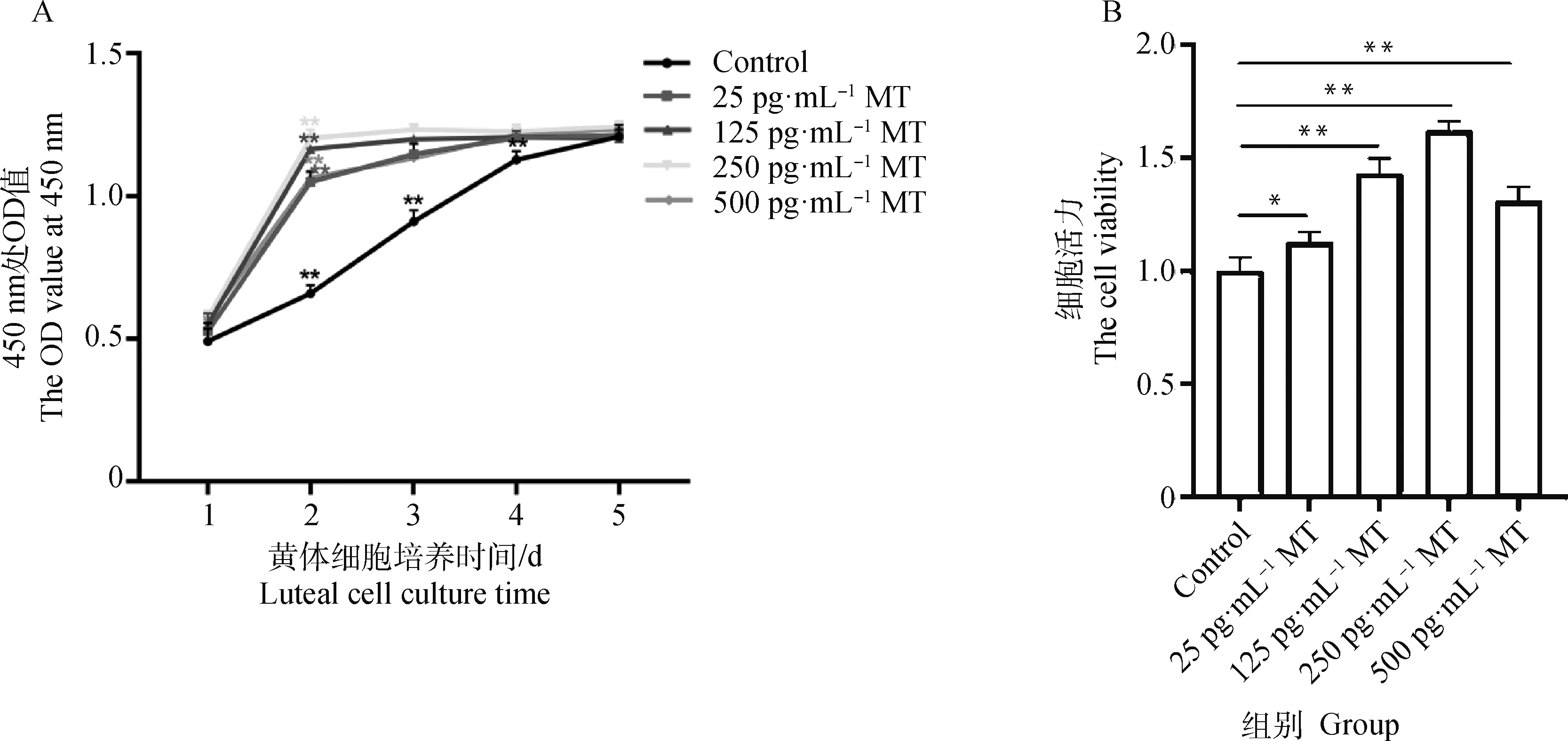
A. 不同濃度MT作用下牦牛黃體細胞生長曲線; B. 不同濃度MT作用48 h后牦牛黃體細胞的活力。*表示差異顯著(P<0.05),**表示差異極顯著(P<0.01),下同A. Growth curves of yak luteal cells treated with different concentrations of MT; B. The viability of yak luteal cells treated with different concentrations of MT for 48 h. * indicates significant difference (P<0.05), ** indicates extremely significant difference (P<0.01), the same as below圖1 不同濃度MT對牦牛黃體細胞增殖及活力的影響Fig.1 The effect of different concentrations of MT on proliferation and viability of yak luteal cells
2.2 不同濃度MT對牦牛黃體細胞增殖和凋亡相關(guān)基因的影響
由圖2可知,由125、250、500 pg·mL-1MT 處理48 h后黃體細胞中增殖相關(guān)基因PCNA、抑凋亡基因BCL-2的表達水平皆顯著上調(diào),而促凋亡基因BAX、FAS的表達水平皆顯著下調(diào)。
2.3 MT及MT受體抑制劑Luzindole對牦牛黃體細胞ROS水平的影響
結(jié)果表明,不同濃度的MT處理牦牛黃體細胞8 h 后,黃體細胞ROS水平在250和500 pg·mL-1MT作用下相較于Control組分別顯著降低了15.7%和12.8%(圖3A)。然而同時添加250 pg·mL-1MT和同濃度Luzindole的聯(lián)合處理組,相較于250 pg·mL-1MT單獨處理組細胞ROS水平顯著升高了13.7%(圖3B)。
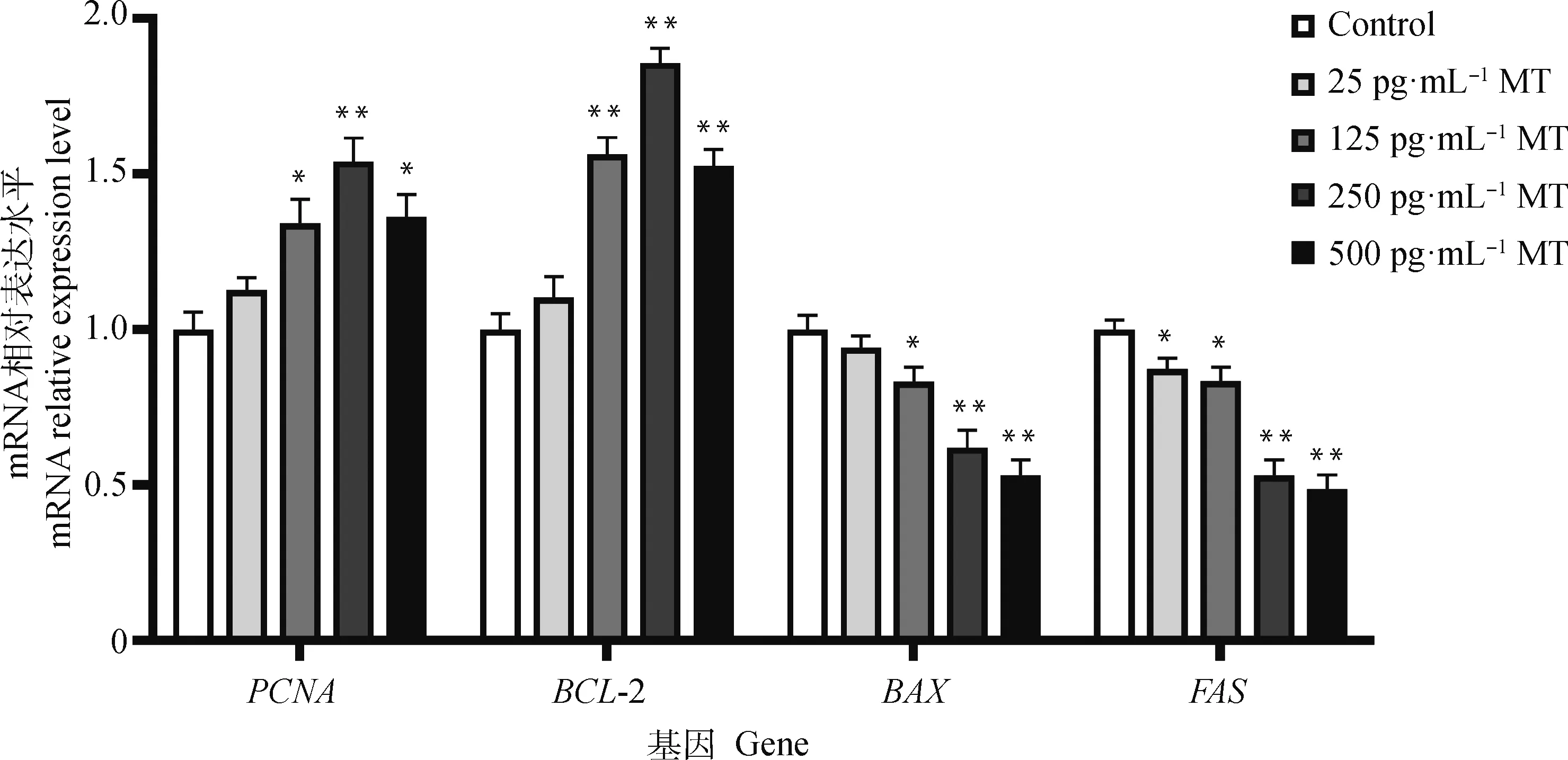
圖2 不同濃度MT作用牦牛黃體細胞48 h后增殖、凋亡相關(guān)基因表達水平Fig.2 The expression levels of proliferation-related gene and apoptosis-related gene in yak luteal cells treated with different concentrations of MT for 48 h
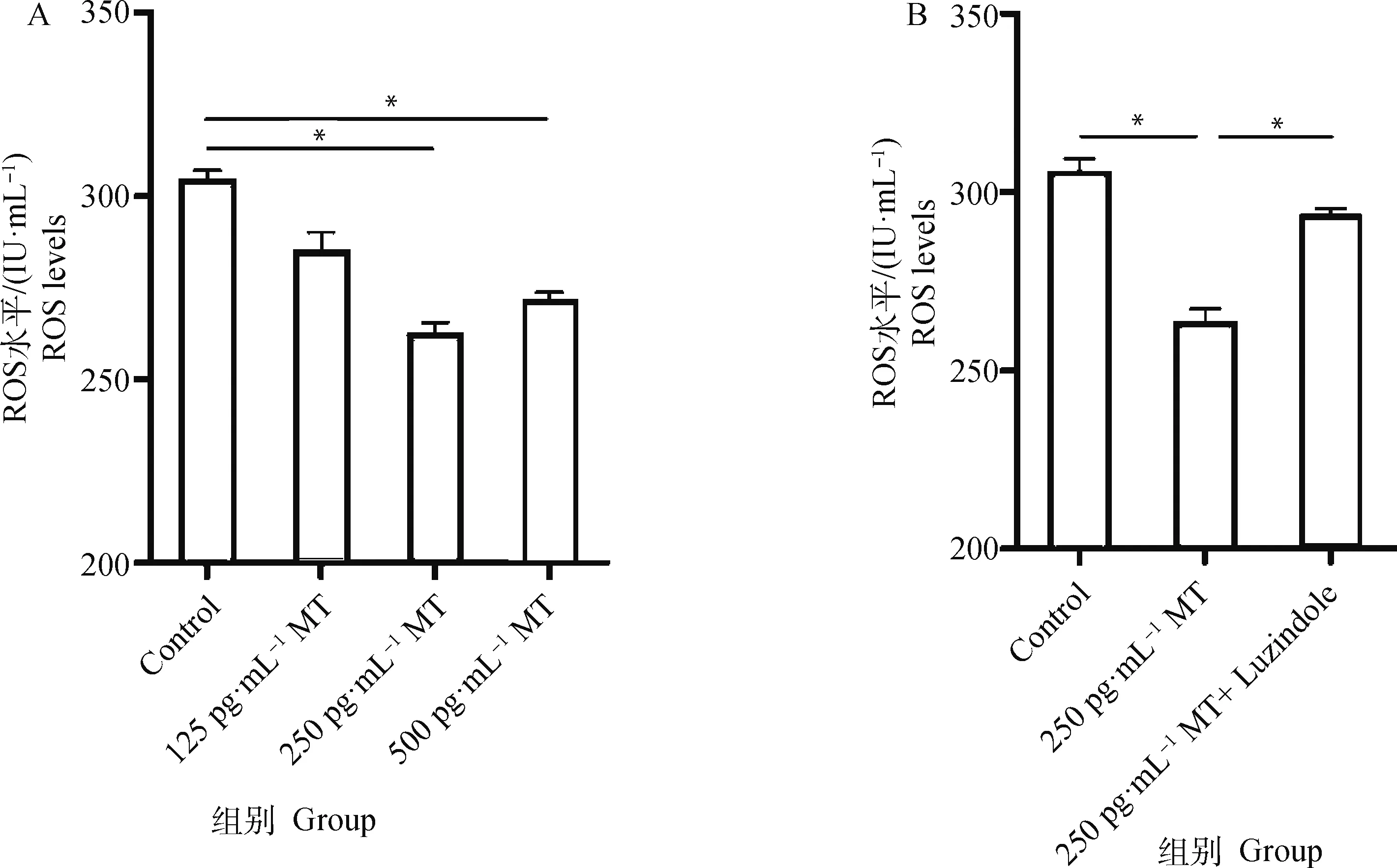
A. 不同濃度MT對黃體細胞ROS水平的影響;B. MT及Luzindole聯(lián)合處理對黃體細胞ROS水平的影響A. The effect of different concentrations of melatonin on the level of ROS in luteal cells; B. Effect of co-treatment with MT and Luzindole on ROS level in luteal cells圖3 MT及MT受體抑制劑Luzindole對牦牛黃體細胞ROS水平的影響Fig.3 Effect of MT and MT receptor inhibitor Luzindole on ROS levels in yak luteal cells
2.4 MT及其受體抑制劑Luzindole對牦牛黃體細胞抗氧化相關(guān)基因的影響
由圖4可知,250 pg·mL-1MT 組與 Control 組相比SOD1表達量無顯著差異,SOD2、GPX1和CAT表達量分別極顯著上調(diào)了41.0%、80.0%和76.2%;250 pg·mL-1MT+Luzindole組與250 pg·mL-1MT組相比,SOD1表達量無顯著差異,SOD2、GPX1和CAT的表達量分別顯著下調(diào)了20.3%、31.7%和 33.2%。
2.5 MT及其受體抑制劑Luzindole對牦牛黃體細胞孕酮分泌水平的影響
由圖5A 可見125、250和500 pg·mL-1MT組在分別作用 24、36 h后黃體細胞孕酮水平皆顯著高于Control組,且250 pg·mL-1MT處理組細胞分泌的孕酮水平顯著高于其他3組。由圖5B可見添加MT處理后黃體細胞的孕酮分泌水平極顯著升高了26.6%。而應(yīng)用Luzindole 聯(lián)合處理時,細胞孕酮水平顯著降低了19.6%。
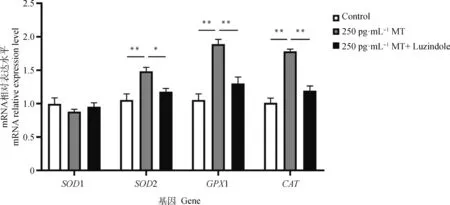
圖4 MT及Luzindole聯(lián)合處理對牦牛黃體細胞中部分抗氧化相關(guān)基因表達的影響Fig.4 The effect of co-treatment with MT and Luzindole on the expression of some antioxidant-related genes in yak luteal cells
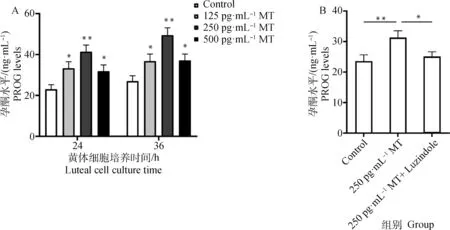
A. 不同濃度MT作用不同時間后黃體細胞分泌孕酮的水平;B. MT和Luzindole聯(lián)合作用對黃體細胞孕酮分泌的影響A. The level of progesterone secreted by the luteal cells after the treatment of different concentrations of melatonin for different time; B. The effect of co-treatment with MT and Luzindole on progesterone secretion in yak luteal cells圖5 MT及其受體抑制劑Luzindole對牦牛黃體細胞孕酮分泌水平的影響Fig.5 Effect of MT and its receptor inhibitor Luzindole on progesterone secretion in yak luteal cells
由圖6可知,添加MT后對孕酮合成相關(guān)基因HSD3β表達量無顯著影響,而STAR和CYP11A1表達量分別極顯著上調(diào)了86.3%和99.7%;用同濃度MT及Luzindole處理后,與MT單獨處理組比較,發(fā)現(xiàn)HSD3β表達量無顯著差異,而STAR和CYP11A1表達量分別極顯著下調(diào)了28.0%和37.0%。
3 討 論
黃體細胞是雌性動物卵巢中重要的細胞之一,對動物的繁殖生理具有重要調(diào)控作用。其主要功能是通過分泌孕酮作用于子宮平滑肌,使子宮肌纖維的興奮性降低,減少收縮,減弱母體的免疫反應(yīng)能力,使胚胎順利著床[25],從而減少母畜發(fā)生流產(chǎn),在維持妊娠方面起到核心作用[26]。因此,維持黃體細胞的正常功能是提高動物生產(chǎn)率的重要手段之一。
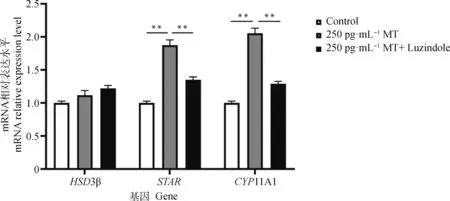
圖6 MT和Luzindole作用聯(lián)合處理對黃體細胞孕酮合成相關(guān)基因表達的影響Fig.6 The effect of co-treatment with MT and Luzindole on the expression of progesterone synthesis-related genes in yak luteal cells
本試驗通過添加不同濃度MT處理黃體細胞,發(fā)現(xiàn)25~500 pg·mL-1的MT均能加速細胞增殖進入平臺期,對細胞活力檢測發(fā)現(xiàn),不同濃度MT處理48 h后黃體細胞活力皆有顯著升高,推測MT對黃體細胞的增殖能力具有促進作用。已有多篇文獻報道了類似的結(jié)果。有研究證實,MT會影響大鼠、倉鼠及山羊等動物支持細胞的生長、增殖、能量代謝和氧化狀態(tài)[27],添加外源性MT通過抑制促凋亡基因BAX的表達而對山羊精原干細胞發(fā)揮抗凋亡作用,且顯著降低了線粒體腫脹和空泡,并抑制了細胞色素C的釋放和caspase-3的活化[28]。此外,MT還可直接作用于睪丸,改善氧化應(yīng)激、細胞凋亡和炎癥引起的睪丸損傷[29-31]。Romeu 等[32]在MT對松果體切除雌性大鼠卵巢組織形態(tài)及PCNA表達的影響研究中發(fā)現(xiàn),MT可能會下調(diào)卵巢間質(zhì)細胞中PCNA的表達,上調(diào)黃體細胞中PCNA的表達,從而促進黃體生成,增加卵巢中黃體的數(shù)量。本研究檢測了不同濃度MT處理牦牛黃體細胞后PCNA、BCL-2及BAX、FAS的表達情況,結(jié)果表明,MT濃度在125~500 pg·mL-1這一范圍內(nèi)能夠顯著促進PCNA、BCL-2并抑制BAX、FAS的表達,因此推測,MT對牦牛黃體細胞的促進作用是通過上調(diào)PCNA、BCL-2的表達以及下調(diào)BAX、FAS的表達實現(xiàn)的。
ROS是機體在有氧代謝過程中產(chǎn)生的一類富含氧的化學活性分子,能夠引起氧化應(yīng)激,導致DNA損傷和細胞凋亡[33-34]。已有多個研究表明,褪黑素能夠有效清除機體內(nèi)的ROS,例如給小鼠長期飼喂MT可降低小鼠卵巢中ROS水平,減緩卵巢的氧化損傷,并能有效提高抗氧化基因CAT、GPX1、GLRX1、SOD2和PRDX3 的表達[35]。Mukherjee等[36]研究發(fā)現(xiàn),MT可以提高金色倉鼠生殖細胞中抗氧化酶SOD、CAT和GPX1的水平,從而減弱地塞米松誘導的睪丸氧化應(yīng)激,此外,MT可以通過降低8-OHdG水平緩解小鼠顆粒細胞的DNA損傷和氧化應(yīng)激[37],本研究發(fā)現(xiàn),MT可以增加SOD、GPX和CAT表達水平,并有效清除牦牛黃體細胞ROS,因此推測,MT能夠通過促進細胞中抗氧化基因的表達進而清除細胞內(nèi)的ROS。據(jù)報道,MT可以通過膜受體MT1和MT2形成同源二聚體和異源二聚體進而增強或抑制下游信號通路的活性[38],例如MT經(jīng)受體介導后,可激活Nrf2信號傳導途徑,從而減輕氧化應(yīng)激和炎癥反應(yīng),對顱腦損傷提供一定的保護作用[39]。為研究褪黑素在黃體功能中的受體依賴性機制,本試驗培養(yǎng)的黃體細胞中使用了針對MT1和MT2受體抑制劑Luzindole,Luzindole是一種競爭性的MT2受體拮抗劑,可同時抑制MT1和MT2的表達[40]。本研究中應(yīng)用MT與Luzindole聯(lián)合處理后發(fā)現(xiàn),相較于MT單獨處理組,聯(lián)合處理組細胞ROS水平回升,同時SOD、GPX和CAT的表達水平顯著下調(diào),表明MT對牦牛黃體細胞的抗氧化作用可能依賴于受體介導,其具體的分子機制有待后續(xù)進一步研究。
黃體分泌的孕酮是維持妊娠的必要物質(zhì),而ROS是影響孕酮分泌的眾多因素之一。在敲除小鼠抗氧化基因SOD1的研究中發(fā)現(xiàn),SOD1缺失小鼠黃體體積顯著減小,且黃體周圍區(qū)域超氧化物生成顯著增加,體內(nèi)孕酮水平降低[41]。Carlson等[42]報道稱,ROS可以在生殖周期中控制黃體細胞產(chǎn)生孕酮,并在周期結(jié)束時抑制孕酮合成。再者,孕酮合成過程受到STAR、HSD3β和CYP11A1等關(guān)鍵蛋白的調(diào)節(jié)作用[43], 例如ROS可以誘導轉(zhuǎn)錄因子GATA4和GATA6的下調(diào)來抑制STAR表達,從而降低孕酮分泌水平[44]。由此可見,降低黃體細胞的ROS水平對黃體功能的維持十分重要。作為一種常見的抗氧化劑,已有多個研究報道MT與孕酮的分泌有關(guān)。有研究發(fā)現(xiàn),MT有促進豬黃體細胞分泌孕酮的作用[45],F(xiàn)ang等[46]研究發(fā)現(xiàn),人卵泡液中的MT水平與血清中的孕酮水平呈正相關(guān),MT通過上調(diào)孕酮合成關(guān)鍵基因STAR的表達進而誘導人顆粒黃體細胞中孕酮的產(chǎn)生。在本研究中,通過添加MT處理牦牛黃體細胞,發(fā)現(xiàn)MT促進了SOD、GPX和CAT的表達,同時降低黃體細胞ROS水平,并且對細胞分泌孕酮有促進作用,說明細胞抗氧化性能的提高對清除ROS有重要意義,而降低細胞ROS水平,減少氧化應(yīng)激發(fā)生有益于細胞分泌孕酮。然而在同一MT濃度下,隨著培養(yǎng)時間的延長,孕酮含量增加,MT對黃體細胞分泌孕酮的促進作用并不呈現(xiàn)劑量依賴性。本研究中,MT還提高了細胞孕酮合成相關(guān)基因STAR和CYP11A1 mRNA的表達量,但對HSD3β mRNA無顯著影響,推測可能是HSD3β的表達不受MT的影響。在同時添加MT及Luzindole處理黃體細胞后,孕酮水平顯著降低,同時STAR和CYP11A1表達量顯著下調(diào),這與Zhang等[47]在豬妊娠黃體中的研究結(jié)果一致。由此說明,MT能促進牦牛黃體細胞分泌孕酮,且MT對孕酮、STAR和CYP11A1表達的影響可能是通過與MT1和MT2受體介導的,因為這種促進作用在添加Luzindole處理后被減弱。
4 結(jié) 論
本研究發(fā)現(xiàn),MT可以通過促進細胞PCNA、BCL-2并抑制BAX、FAS的表達影響牦牛黃體細胞的增殖,MT通過提高細胞抗氧化相關(guān)基因SOD2、CAT及GPX1的表達,從而降低細胞ROS水平,同時提高孕酮分泌水平,且孕酮分泌量的增加與MT促進細胞STAR和CYP11A1的表達有關(guān)。此外,MT對細胞的作用依賴于與細胞膜上的MT1和MT2受體結(jié)合而發(fā)揮其生物學功能。

