右美托咪定基于PI3K/AKT/CREB信號通路對肝臟缺血再灌注損傷大鼠干預作用研究
黃符香, 高長勝, 張 爽, 王文軍, 宋 歌
(海南省儋州市人民醫院麻醉科, 海南 儋州 571700)
肝缺血再灌注(ischemia/reperfusion,I/R)損傷是肝切除或肝臟移植手術期間的常見并發癥,已成為制約肝供體使用和肝切除術發展的瓶頸[1]。肝臟I/R損傷在發病過程中涉及的病理因素/途徑包括無氧代謝、線粒體功能障礙、氧化應激損傷、細胞內鈣超載損傷,以及細胞因子和趨化因子風暴等[2]。但目前尚缺乏有效的預防或治療方法。已有大量文獻報道了與肝臟I/R損傷相關的信號通路,包括磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K) /AKT/環磷腺苷效應元件結合蛋白(cAMP-response element binding protein,CREB)通路、Wnt/β-catenin信號通路、Toll樣受體4(toll like receptor 4,TLR4)/NF-kB信號通路等,其中PI3K/Akt 通路是調控肝臟細胞在應對外界刺激后生存的關鍵信號轉導通路[3]。本研究通過建立大鼠肝臟I/R模型,并給與不同劑量的右美托咪定,探討其是否能夠通過PI3K/AKT/CREB通路減輕肝臟I/R。
1 材料與方法
1.1實驗動物:本研究使用SPF級雄性Sprague Dawley(SD)大鼠,體重為200±20g(8周齡),購自斯貝福(北京)實驗動物科技有限公司,生產許可證號:(SCXK(京)2019-0004)。大鼠飼養于標準溫濕度、光照(12h光照/12h黑暗)環境中,自由飲水取食,適應性喂養一周后進行試驗。
1.2I/R損傷模型大鼠的建模及分組:大鼠腹腔注射戊巴比妥(40mg/kg)進行麻醉,然后常規手術備皮并用酒精消毒后,沿腹中線開腹,血管夾夾閉肝臟左側和中側門脈三合體(portaltriads)[4],造成70%的肝臟缺血,觀察到肝正中葉和左側葉顏色由紅變灰白為缺血成功。缺血30min后取夾,分別再灌注6h或12h,至灰白的肝臟組織顏色變紅。再灌注完成后,腹主動脈取血處死大鼠,收集血液和肝臟左側或正中葉組織,保存于液氮或多聚甲醛固定后進行后續實驗。采用隨機數字法將80只SD大鼠分為8組(每組20只)為假手術組(Sham)、模型組(Model)、右美托咪定低劑量組(Dex-L)、右美托咪定高劑量組(Dex-H);每組再灌注6h和12h分別各處死10只。假手術組大鼠僅麻醉后開腹,不阻斷肝臟血流,其余三組均建立I/R損傷模型。Dex-H組腹腔注射100μg/kg右美托咪定,Dex-L組腹腔注射50μg/kg右美托咪定,假手術組和模型組僅注射溶劑。
1.3大鼠血清ALT和AST的檢測:再灌注結束后,麻醉大鼠,腹主動脈取血并獲得血清。使用全自動血液生化分析儀檢測大鼠血清谷丙轉氨酶(Alanine aminotransferase,ALT)和谷草轉氨酶(Aspartate aminotransferase,AST)水平。
1.4HE染色:中性多聚甲醛固定肝臟組織,并用石蠟包埋,酒精梯度脫水,二甲苯透明、浸蠟、包埋、切片。將切片進行粘片、烤片,再放入二甲苯中脫蠟,依次放在100%酒精(5min),95%酒精(5min),85%酒精(5min),75%酒精(5min),蒸餾水中復水(5min)。并用Harris蘇木精液使細胞核著色,1%鹽酸分色5s,清水浸洗,10min;后放入伊紅溶液中5min染色使胞質著色。再次脫水、二甲苯透明、封片,于光學顯微鏡下觀察肝臟組織病理形態學改變。
1.5氧化應激指標檢測:檢測大鼠血清氧化應激相關指標,包括谷胱甘肽(glutathione,GSH)、丙二醛(Malondialdehyde,MDA)及超氧化物歧化酶(Superoxide dismutase,SOD),檢測試劑盒均購自南京建成公司,嚴格按照試劑盒說明書進行操作。
1.6Western Blot 檢測:取適量大鼠肝臟左側或正中葉組織,加入RIPA裂解液充分裂解組織制備蛋白均漿,BCA法測定蛋白濃度。加入5×SDS蛋白上樣緩沖液,煮沸后備用進行聚丙烯酰胺凝膠電泳,濃縮膠電壓100V,分離膠電壓150V,后轉至PVDF膜, 5%BSA封閉。加入特異性一抗PI3K(1∶1000,EPR18702,abcam,英國),pAKT(1∶1000,EP2109Y,abcam,英國),CREB(1∶1500,ab32515,abcam,英國),β-actin(1∶2000,ab8827,abcam,英國)于4℃冰箱過夜。TBST洗膜3次,加入山羊抗兔二抗(1∶2000),孵育1h。TBST洗膜3次,采用ECL化學發光液曝光顯影,使用Image J軟件系統進行半定量分析。
1.7qPCR檢測方法:取不同時間點大鼠肝臟左側或正中葉組織進行qPCR的檢測。Trizol法提取肝臟總RNA,Nanodrop測定RNA濃度后按照反轉錄試劑盒說明合成cDNA。qPCR反應體系為20μL;上游和下游引物各(10μmoL/L),1.0μL,cDNA 2.0μL,SYBRTM Premix Dimer Eraser(2×)10μL,ddH2O 4.0μL。反應條件:95℃-10min,95℃-10s,55℃-20s,35個循環。熔解曲線:95℃ 1min,55℃ 1min,95℃ 10s,每個樣品設3個技術重復,結果采用2-△△Ct法分析mRNA相對表達量,引物序列見表1。

表1 qPCR引物
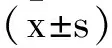
2 結 果
2.1不同時間點大鼠血清AST和ALT變化:不同時間點大鼠血清AST和ALT變化結果見表2。與Sham組比較,Model組大鼠血清AST和ALT水平在6h和12h均顯著升高(P<0.05);與Model比較,不同劑量的右美托咪定給藥后AST和ALT水平在6h和12h均顯著降低(P<0.05);與Dex-L組相比,Dex-H組在6h和12h時,AST和ALT水平均更低,差異具有統計學意義(P<0.05)。組內比較,Model組AST和ALT水平12h較6h進一步升高(P<0.05),Dex-L組AST水平12h較6h升高(P<0.05),Dex-H組ALT水平12h較6h升高(P<0.05)。

表2 不同組大鼠血清AST和ALT在6h和12h的水平(U/mL)
2.2大鼠心肌組織病理形態學變化:HE染色后不同組別大鼠的肝組織病理學特征見圖1,結果顯示不同時間點,Sham組大鼠肝臟組織結構完全保持有序,小葉結構完整、清晰,肝細胞以中央靜脈為中心呈放射狀排列,形成肝細胞索,細胞結構正常;而Model組在6h觀察到小葉結構紊亂,肝細胞呈現明顯腫脹變性,壞死明顯,多形核細胞浸潤,小葉內可見炎性細胞散在或灶狀浸潤,血管充血明顯,至12h肝細胞大片壞死,壞死區紅細胞堆積、炎細胞浸潤明顯。不同劑量的右美托咪定給藥后,在不同時間點均明顯緩解了肝小葉結構的紊亂、肝細胞的腫脹變性及炎細胞浸潤等病理改變。
2.3不同時間點大鼠肝臟氧化應激指標變化:不同時間點大鼠肝臟氧化應激指標變化如表2。與Sham組相比,在不同時間點,Model組的SOD和GSH水平顯著降低(P<0.05),MDA水平升高,差異有統計學意義(P<0.05)。與Model組相比,不同劑量右美托咪定干預后大鼠肝臟的SOD和GSH水平顯著升高(P<0.05),MDA水平顯著降低(P<0.05)。與Dex-L組比較,Dex-H組MDA在各個時間點均更低(P<0.05),SOD在各個時間點更高(P<0.05)。組內比較,在12h時,Model大鼠肝臟中的GSH水平較6h時顯著降低(P<0.05),MDA水平升高(P<0.05);不同劑量右美托定組大鼠GSH水平,12h較6h時顯著升高(P<0.05),MDA顯著降低(P<0.05)。

表2 各組大鼠GSH MDA SOD的對比
2.4大鼠肝臟PI3K/AKT/CREB信號通路比較:Western Blot檢測不同組別大鼠的肝組織PI3K/AKT/CREB蛋白水平見圖2,結果表明Model組6h時,PI3K蛋白量較Sham組顯著增高( P<0.05),12h時PI3K,pAKT和CREB蛋白水平均顯著增高( P<0.05)。與Model組比較,6h和12h時,不同劑量右美托咪定干預后PI3K,pAKT和CREB蛋白水平均顯著增高( P<0.05)。與Dex-L組比較,Dex-H組的PI3K蛋白量12h時更高( P<0.05);pAkt和CREB蛋白量在6h和12h均顯著增高( P<0.05)。

圖1 各組大鼠肝臟HE染色(200×)

圖2 各組大鼠肝臟PI3K/AKT/CREB信號通路比較
2.5大鼠BAX、Bcl2相對表達量比較:PCR檢測大鼠肝臟組織BAX、Bcl2相對表達量,結果如圖3。與Sham組相比,模型組BAX和Bcl2的表達量明顯升高,差異有統計學意義(P<0.05)。與Model組相比,不同劑量右美托咪定干預后BAX表達量明顯降低,Bcl2表達量明顯升高,差異有統計學意義(P<0.05)。Dex-H組與Dex-L組比較,6h時,Dex-H組 Bcl2表達量較高(P<0.05);12h時,Dex-H組BAX表達量較低,Bcl2表達量較高,差異有統計學意義(P<0.05)。

圖3 各組大鼠BAX、Bcl2相對表達量比較
3 討 論
肝I/R損傷是肝切除術或肝移植中的一種常見并發癥,與術后肝臟無功能、肝衰竭發病率,以及死亡率密切[1]。由于肝I/R損傷導致的不良結局一直是臨床實踐中一個未解決的難題,嚴重制約了肝移植和肝切除術的發展。肝I/R損傷可分為三個不同的病理時間節點,首先是缺血階段:肝細胞的損傷程度在此階段不斷累及擴大;其次是再灌注階段:當供體恢復血液循環,甚至暴露于常氧條件下可迅速發生,此階段炎性因子及過氧化物大量釋放進一步加重肝細胞損傷;最后是后損傷階段:在此階段發生原位巨噬細胞激活及循環炎細胞浸潤,加劇了肝臟的炎癥反應及凋亡[5]。
右美托咪定是一種高度選擇性α2-腎上腺素受體激動劑,主要用于麻醉后監護室和神經重癥監護室的鎮靜和鎮痛[6]。右美托咪定對幾種重要器官,如肝臟、心臟、大腦和腎臟的缺血再灌注損傷均具有保護作用[7]。近來的研究表明,在肝臟I/R損傷中,右美托咪定可以降低炎性因子水平,上調Bcl2表達抑制肝細胞凋亡[8]。本研究通過建立大鼠肝臟I/R損傷模型觀察右美托咪定的干預作用,結果表明I/R損傷6h時既出現小葉結構紊亂,肝細胞明顯壞死;隨著時間的推移,肝臟病理程度逐漸加重,而使用不同劑量的右美托咪定干預后,肝臟病理特征在不同時間點均有所改善;此外右美托咪定也可以降低大鼠血清中ALT、AST的水平,以上結果從病理學和血清學兩個方面證明了右美托咪定對肝臟I/R損傷的保護作用。
文獻報道了右美托咪定可以通過α2-腎上腺素受體激活PI3K/Akt通路,降低靶器官的氧化應激水平,抑制細胞凋亡,參與缺血/再灌注的保護過程[9]。本研究結果顯示右美托咪定干預后顯著降低了大鼠血清中的氧化應激相關指標,但其保護肝臟I/R損傷是否通過PI3K/Akt通路尚不明確,因此本研究檢測了PI3K和Akt的蛋白磷酸化水平,結果表明右美托咪定干預不同時間點后,PI3K和Akt的蛋白磷酸化水平顯著升高,證明了PI3K/Akt通路的激活。PI3K/Akt 通路是參與調節細胞存活、增殖和分化的最重要通路之一,可被包括生長因子、激素、藥物等所激活,CREB是PI3K/Akt通路的下游靶點,也是調控氧化應激水平和細胞凋亡的關鍵轉錄因子[10]。以往的數據表明,Akt是參與肝臟I/R損傷的關鍵分子,通過藥物干預PI3K/Akt通路可以在一定程度上緩解肝臟I/R的病理表現[11]。本研究結果表明,右美托咪定干預不同時間點后CREB的蛋白水平均有不同程度的升高。此外,本研究進一步檢測了凋亡信號標記物BAX,Bcl2的基因表達水平,結果表明右美托咪定干預不同時間點BAX mRNA水平顯著降低,Bcl2 mRNA水平顯著升高,說明凋亡信號受到了抑制。
綜上所述,右美托咪定可顯著改善肝臟I/R損傷模型大鼠的肝臟病理學和血清學指標,抑制氧化應激反應和凋亡標記物,其作用機制可能與激活PI3K/AKT/CREB信號通路有關。本研究為肝臟I/R損傷的機制研究和臨床治療提供了藥理學依據,但肝臟I/R損傷參與的通路眾多,還有待進一步研究。

