ZLN005通過上調PGC-1α表達誘導巨噬細胞的M2型分化減輕膿毒癥引起的急性肺損傷
張 昊, 譚 赟, 楊璐瑜
(湖北省武漢市第三醫院, 湖北 武漢 430060)
膿毒癥是一種由感染引起的潛在致命性的全身炎癥反應綜合征,是世界范圍內的一個重要公共衛生問題[1]。而肺臟極易受到膿毒癥的影響,其功能障礙最終可導致急性肺損傷(acute lung injury,ALI),甚至急性呼吸窘迫綜合征[2]。盡管近年來抗菌藥物和器官功能支持技術有了快速的發展,但膿毒癥誘導ALI的死亡率仍然居高不下[3]。這可能與與膿毒癥誘發的ALI的免疫紊亂與失衡炎癥反應相關。巨噬細胞作為先天性免疫系統的重要組成部分,在炎癥反應中起著關鍵作用。眾所周知,巨噬細胞具有顯著的異質性,其極化狀態在ALI的發病進展中具有重要地位,如M1型巨噬細胞能促進自由基和促炎細胞因子的表達,誘導ALI進一步步加重,而M2型巨噬細胞的激活有助于緩解炎癥[4]。因此,研究巨噬細胞的表型分化調控并促進其M2型極化對改善膿毒癥誘導的ALI具有極大的應用價值。過氧化物酶體增殖物激活受體γ共激活因子-1α(Peroxisome proliferator-activated receptor-gamma coactivator-1α,PGC-1α)是調節細胞能量代謝的重要轉錄共激活因子,既往國內的研究均表明在膿毒癥誘導的ALI中PGC-1α的表達呈異常降低現象,推測其可能參與ALI的發生進展[5]。巨噬細胞能量代謝的變化可能會導致其極化狀態的改變,且在乳腺癌中,PGC-1α能通過增強線粒體功能促進腫瘤相關巨噬細胞的M2極化和M2型細胞因子的分泌。這提示PGC-1α可能通過影響線粒體功能參與調控巨噬細胞M2極化[6]。人工合成小分子化合物ZLN005,也被稱為2-(4-叔丁基苯基)苯并咪挫,是PGC-1α的轉錄調控因子,據報道,ZLN005能夠促進PGC-1α的表達。因此,本研究旨在通過體內外實驗進行探究外源性給予ZLN005對膿毒癥誘導的ALI的作用及其相關機制,以期為其作為臨床治療膿毒癥ALI的潛在藥物研發提供新的思路及依據。
1 材料與方法
1.1主要材料與試劑:6~8周齡SPF級雄性C57BL/6小鼠60只(武漢大學動物實驗中心),體重20~25g。所有小鼠實驗前在室溫25~28℃,自由攝食及飲水的環境中適應性飼養一周。小鼠巨噬細胞系RAW264.7(中國細胞資源上海細胞庫);胎牛血清(FBS)(美國Gibco公司);100U/mL與100μg/mL的青鏈霉素混合液、DMEM培養基(美國Hyclone公司);胎牛血清(FBS)(杭州四季青);兔抗PGC-1α、p-AMPK-α、AMPK-α抗體(美國Cell Signaling Techenology公司);兔抗NRF1、NRF2及mtTFA抗體(武漢三鷹生物技術有限公司);脂多糖(lipopolysaccharide,LPS)(美國Sigma公司);兔抗GAPDH抗體(美國Abcam公司);OPTI-MEM、TRIzol試劑、RNAiMAX(美國Invitrogen公司);SYBR Green RT-PCR試劑盒(美國Thermo公司);逆轉錄試劑盒(日本Takara公司);ZLN005(美國Selleck Chemicals公司);檢測TNF-α、IL-1β及IL-6的ELISA試劑盒、ECL發光液(武漢博士德生物技術公司);辣根過氧化酶標記的山羊抗兔二抗、Alexa Fluor 647標記的山羊抗兔IgG(江蘇碧云天生物科技股份有限公司);靶向沉默PGC-1α的siRNA及對照siRNA(si-PGC-1α與si-NC)(上海吉瑪生物制藥有限公司);HE試劑盒(南京建成生物科技有限公司);RT-PCR引物序列由上海生工合成。
1.2方 法
1.2.1ALI的小鼠模型構建及動物實驗分組:使用盲腸結扎穿孔術(cecal ligation perforation)建立小鼠急性肺損傷模型。簡述如下:1%戊巴比妥按50 mg/kg麻醉小鼠后置于加熱毯上,對腹部手術區域常規備皮、消毒后,沿腹中線作一長約1 cm的縱行切口,充分暴露盲腸,在其2/3處用無菌5-0絲線結扎,然后再用18號針頭貫穿結扎部位的盲腸組織,并擠出少量糞便,回納腸管,5-0絲線逐層縫合關閉腹腔后立即腹腔予以注射37℃預熱的無菌生理鹽水0.5mL進行液體復蘇。動物實驗分組采用隨機數字表法將ALI造模的小鼠分為4組,每組20只,其中假手術(Sham)組為只進行剖腹手術的小鼠,ZLN005組為依照文獻方法[7]在假手術(僅開腹手術)后1h經腹腔注射(20mg/kg),CLP組為CLP術的小鼠,CLP+ZLN005組為CLP術后1h經腹腔注射(20mg/kg),并在Sham組與CLP組小鼠術后1h注射等體積的DMSO溶液(ZLN005溶劑);將實驗小鼠置于籠中,自由攝食、飲水,觀察并記錄各組小鼠術后狀態,并于造模后24h時處死一批小鼠(每組10只),其余小鼠繼續飼養觀察7d內的死亡情況。
1.2.2支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)的采集及肺組織濕/干(wet/dry,W/D)比重的檢測:各組小鼠處死后進行頸部解剖,充分暴露氣管并進行氣管插管,0.5 mL預冷PBS溶液灌洗雙肺,停留5~8 s后輕輕按摩胸腔,緩慢回抽BALF,上述操作重復3次。將收集的BALF于4℃、3000r/min離心20min,收集上清液保存于-20℃備用。取各組小鼠左肺組織,并用濾紙吸干肺表面水分后稱量濕重(wet),然后將肺組織用錫紙包裹置于80℃恒溫烤箱24h至恒重,稱量干重(dry),并計算干濕比值(W/D)。
1.2.3ELISA檢測炎癥因子TNF-α、IL-1β、IL-6和IL-10:取方法1.3中收集的各組小鼠BALF,根據ELISA試劑盒說明書方法檢測TNF-α、IL-1β、IL-6和IL-10的表達水平。實驗單獨重復3次。
1.2.4組織免疫熒光染色:取各組小鼠肺組織,4%的多聚甲醛溶液中浸泡24h后,石蠟包埋,切片至4μm左右,二甲苯脫蠟至水,梯度酒精脫水,抗原修復并使用PBST溶液充分洗滌后,2%的BSA于37℃下封閉1h,再次洗滌后滴加抗PGC-1α抗體(1∶500),4℃孵育過夜,次日施加Alexa Fluor 647標記的二抗(1∶100)37℃下封閉1h,使用DAPI試劑染核后,加入防熒光猝滅劑,最后使用熒光顯微鏡下觀察拍照。實驗單獨重復3次。
1.2.5實時熒光定量PCR(RT-PCR):使用TRIzol法提取待測的組織或細胞中的總RNA,在Nanodrop 1000上檢測RNA濃度后,使用逆轉錄試劑盒將RNA合成cDNA.在根據SYBR Green試劑盒說明書方法進行RT-PCR,其中引物序列見表1。以GAPDH為待測目標mRNA的內參,采用2-△△Ct方法分析進行定量分析。實驗單獨重復3次。

表1 RT-PCR引物序列
1.2.6細胞培養、轉染與分組:RAW264.7細胞培養于含10%FBS與1%青鏈霉素的DMEM培養基中,并置于含37℃,5%CO2的恒溫恒濕培養箱中。當細胞生長融合達80%時,常規消化細胞,調整細胞密度至5×104/mL,并接種至24孔板中,待細胞生長融合至50%時按RNAiMAX試劑盒說明書方法將10nM的si-PGC-1α與si-NC轉染入RAW264.7細胞中,6h后更換為常規培養基,24h后使用Western blot與RT-PCR檢測轉染效率。按實驗目的將細胞分為五組,對照組(negative control,NC),ZLN005組,使用4μM的ZLN005處理的RAW264.7細胞,LPS組,使用10μg/mL的LPS處理的RAW264.7細胞,LPS+ZLN005+si-NC與LPS+ZLN005+si-PGC-1α分別為聯合使用4μM的ZLN005與10μg/mL的LPS處理的轉染si-NC或si-PGC-1α的細胞。上述各組細胞置于37℃,5%CO2的恒溫恒濕培養箱中培養24h后用于后續相關實驗。
1.2.7Western blot實驗:取待測組織或細胞,使用RIPA蛋白酶抑制劑溶液與于冰上進行提取細胞中總蛋白,4℃,12000 rpm/min 離心15 min后收集上清液,BCA法測定蛋白濃度,并置于沸水中進行加熱變性,然后取等量的蛋白樣品經SDS-PAGE凝膠分離并轉移至PVDF膜上。室溫下,5%BSA進行封閉膜1h后,加入一抗:PGC-1α(1∶800)、p-AMPK-α(1∶1000)、AMPK-α(1∶1000)、NRF1(1∶500)、NRF2(1∶500)和mtTFA(1∶500)、GAPDH(1∶1500),置于4℃搖床中孵育過夜,充分洗滌后,加入過氧化物酶標記的二抗(1∶5000),室溫孵育1h,再次洗滌后,滴加ECL發光液進行曝光拍照,Image J軟件檢測目標蛋白條帶的灰度值,并以GAPDH為內參檢測其相對表達。以上實驗重復3次。
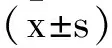
2 結 果

圖1 ZLN005促進大鼠肺組織PGC-1α表達
2.1ZLN005對大鼠肺組織PGC-1α表達的影響:免疫熒光觀察顯示,與Sham組比較,ZLN005組與CLP+ZLN005組的大鼠肺組織中PGC-1α的熒光表達強度顯著增加(P<0.05),CLP組明顯降低(P<0.05),而與CLP組比較,CLP+ZLN005組中PGC-1α的熒光強度明顯增強(P<0.05,圖1A);RT-PCR和Western blot檢測結果同樣表明,與Sham組比較,ZLN005組與CLP+ZLN005組肺組織中PGC-1α的mRNA與蛋白表達水平均顯著升高(P<0.05),CLP組中均明顯降低(P<0.05);而與CLP組比較,CLP+ZLN005組中mRNA與蛋白表達水平均顯著升高(P<0.05,圖1B,C)。
2.2ZLN005上調PGC-1α表達調控膿毒癥大鼠的炎癥反應:ELISA結果顯示,與Sham組或ZLN005組相比,CLP組和CLP+ZLN005組中促炎因子TNF-α、IL-1β和IL-6均明顯升高(P<0.05),抑炎因子IL-10卻顯著降低(P<0.05),前兩組BALF中上述炎癥因子均無明顯差異(P>0.05);其中與CLP組相比,CLP+ZLN005組中TNF-α、IL-1β和IL-6的表達水平明顯降低(P<0.05),而IL-10顯著升高(P<0.05),見表2。

表2 ELISA各組大鼠BALF中TNF-α IL-1β IL-6和IL-10的濃度

圖2 ZLN005上調PGC-1α表達減輕膿毒癥誘導的肺損傷
2.3ZLN005上調PGC-1α表達對膿毒癥誘導的肺損傷影響:HE染色觀察顯示Sham組和ZLN005組大鼠肺組織結構正常,肺泡清晰完整,無滲出或炎性細胞浸潤現象,而CLP組大鼠肺間質和肺泡腔內有大量炎性細胞浸潤,肺泡壁增厚,肺泡內有液體滲出,且間隔斷裂,肺泡呈融合或塌陷狀,CLP+ZLN005組大鼠肺組織損傷介于上述兩者之間(圖2A);肺組織W/D比重分析結果顯示,CLP組與CLP+ZLN005組比值較Sham組或ZLN005組明顯增加(P<0.05),后兩組差異無統計學意義(P<0.05)。且與CLP組相比,CLP+ZLN005組W/D比值顯著降低(P<0.05,圖2B);各組大鼠造模術后7d的生存率分析表明,Sham組與ZLN005組的存活率均為100%,而CLP組與CLP+ZLN005組大鼠生存率均顯著降低(P<0.05),同時在CLP造模后6h,所有動物都出現嗜睡,毛發豎立,腹瀉等臨床癥狀。其中,CLP組術后第2d存活率為50%,第4d為0%,而CLP+ZLN005組大鼠術后第2d存活率為70%,第4d為50%,第7d為30%(圖2C)。

圖3 ZLN005上調PGC-1α表達促進LPS刺激的巨噬細胞M2極化
2.4ZLN005上調PGC-1α表達對LPS處理的巨噬細胞極化的影響:Western blot檢測各組RAW264.7巨噬細胞中PGC-1α的蛋白表達結果顯示,與NC組相比,ZLN005組與LPS+ZLN005組明顯升高(P<0.05),LPS組顯著降低(P<0.05),其中與LPS組比較,LPS+ZLN005組中PGC-1α蛋白表達明顯升高(P<0.05,圖3A);RT-PCR檢測顯示,與NC組相比,LPS組與LPS+ZLN005組中M1型巨噬細胞標記物iNOS與MHC-Ⅱ的mRNA表達明顯升高(P>0.05),而ZLN005組與LPS+ZLN005組中M2型巨噬細胞標記物Arg1與CD206的mRNA表達水平顯著升高(P<0.05);其中較LPS組相比,LPS+ZLN005組中iNOS與MHC-Ⅱ表達明顯降低(P<0.05),而Arg1與CD206表達水平顯著升高(P<0.05,圖3B)
2.5沉默PGC-1α對ZLN005作用下LPS處理的巨噬細胞極化的影響:RT-PCR與Western blot檢測轉染si-PGC-1α后RAW264.7巨噬細胞中PGC-1的mRNA結果表明,與NC細胞相比,轉染si-PGC-1α的細胞中PGC-1 mRNA和蛋白表達水平顯著降低(P<0.05),轉染si-NC的巨噬細胞中無明顯變化(P>0.05,圖4A,B);同時,RT-PCR再次檢測M1型巨噬細胞標記物iNOS與MHC-Ⅱ與M2型巨噬細胞標記物Arg1與CD206的mRNA表達水平的結果顯示,與NC組相比,LPS組、ZLN005+LPS+si-NC組與ZLN005+LPS+si-PGC-1α組中iNOS與MHC-Ⅱ表達明顯升高(P<0.05),且ZLN005+LPS+si-NC組的Arg1與CD206表達亦顯著升高(P<0.05);而與ZLN005+LPS+si-NC組相比,LPS組與ZLN005+LPS+si-PGC-1α中iNOS與MHC-Ⅱ表達明顯升高(P<0.05),Arg1與CD206表達顯著降低(P<0.05),后兩組無明顯差異(P>0.05,圖4C).

圖4 沉默PGC-1α抑制ZLN005作用下LPS處理的巨噬細胞M2極化
2.6ZNL005通過AMPK信號通路促進線粒體生物發生影響LPS誘導的巨噬細胞極化:Western blot檢測AMPK-α的磷酸化水平(p-AMPK-α/AMPK-α)及線粒體生物發生中關鍵蛋白NRF1、NRF2和mtTFA的結果顯示,與NC組相比,ZNL005組AMPK-α的磷酸化水平和NRF1、NRF2和mtTFA蛋白表達均明顯升高(P<0.05),而LPS組、LPS+ZLN005+si-NC與LPS+ZLN005+si-PGC-1α中上述檢測指標均顯著降低(P<0.05);其中與LPS+ZLN005+si-NC組相比,LPS組與LPS+ZLN005+si-PGC-1α中AMPK-α的磷酸化水平,NRF1、NRF2和mtTFA均明顯降低(P<0.05),后兩組無明顯變化(P>0.05,圖5)。

圖5 PGC-1α通過促進AMPK信號通路調節LPS誘導的巨噬細胞極化
3 討 論
本研究結果表明,ZLN005能夠顯著促進ALI小鼠模型肺組織中PGC-1α的mRNA及蛋白表達,并通過降低炎癥反應來改善小鼠肺組織病理損傷,增加存活率,而這可能是通過促進促進巨噬細胞的M2型分化發揮作用。
ZLN005是能上調PGC-1α的轉錄并激活AMPK的激活進而促進及下游相關信號通路表達的小分子化合物。相關研究均表明ZLN005在疾病模型主要是通過促進PGC-1α的表達來保護線粒體功能,從而減輕組織或細胞的氧化應激損傷和炎癥反應。如在腦缺血神經損傷的研究中,靜脈予以缺血模型大鼠ZLN005能顯著減少腦梗死面積并改善神經功能損傷,進一步的體外研究證實,ZLN005能通過促進神經細胞中PGC-1α的表達,從而保護線粒體功能,上調抗氧化劑因的轉錄,最終發揮神經保護作用[8]。在耐藥性非小細胞肺癌中,聯合應用ZLN005能通過誘導PGC-1α的表達調控腫瘤細胞中線粒體功能,從而影響ROS介導的代謝重編程,促進化療藥物的敏感性[9]。在本研究中,膿毒癥模型建立后腹腔給予ZLN005后組織免疫熒光檢測發現小鼠肺組織中PGC-1α的表達顯著增加,且肺組織病理損傷及水腫程度均明顯改善,BALF中M1型巨噬細胞炎癥因子TNF-α、IL-1β、IL-6均顯著降低,而M2型細胞因子IL-10的表達卻明顯升高,進一步通過體外細胞實驗顯示,ZLN005能通過上調中M2型巨噬細胞基因CD206、Arg1的表達,并降低M1型iNOS、MHC-Ⅱ表達,而上述作用能被沉默PGC-1α的siRNA所消除。這表明,ZLN005對巨噬細胞極化的調控作用是通過促進PGC-1α表達而發揮的。
膿毒癥是一種嚴重的感染并發癥,其中,免疫功能障礙被認為是膿毒癥發生發展的重要因素。同時,越來越多的證據表明免疫細胞如巨噬細胞的能量代謝障礙導致其免疫功能受損或異常與膿毒癥的發生發展密切相關。而線粒體是能量代謝的主要細胞器,其功能障礙直接參與了免疫細胞的異常反應[10,11]。研究證實PGC-1α是細胞內能量代謝,增加呼吸功能與線粒體氧化磷酸化的重要轉錄共激活因子,同時PGC-1α下游的核呼吸因子-1與2(nuclear respiratory factor-1/2,NRF-1/2)和線粒體轉錄因子A(mitochondrial transcription factor A,mtTFA)蛋白是調控線粒體基因轉錄和線粒體DNA復制的關鍵調控因子,其表達上調常被用來指示是線粒體生物發生和線粒體功能的增強[12]。此外,PGC-1α在炎癥反應與M2巨噬細胞極化中均具有重要地位。如在肝組織炎癥反應的體外研究中外源性促進PGC-1α的表達能顯著抑制炎癥因子TNF-α、IL-1β與IL-6的表達,而應用siRNA干擾PGC-1α的表達后其炎癥抑制的作用消失;而在運動損傷的小鼠模型中促進PGC-1α的表達能通過募集巨噬細胞的遷移并誘導其M2型極化,從而更快速高效低消除炎癥與壞死,從而促進肌纖維的再生[13]。此外,靳鑫等學者在乳腺癌的體外研究中發現,PGC-1α參與了乳腺癌腫瘤相關巨噬細胞的M2極化過程,其可能是通過促進PGC-1α依賴的線粒體功能,促使細胞向M2分化,并產生大量M2形細胞因子,如轉化生子因子-β1(transforming growth factor-β1,TGF-β1)、IL-10等,從而上調腫瘤細胞的侵襲、遷移能力,并提示PGC-1α的高表達是巨噬細胞M2極化狀態維持及產生M2型細胞因子所必需的。而在膿毒癥誘導的ALI中,PGC-1α在肺組織中的表達異常降低,而脂連素能通過激活內皮細胞中PGC-1α水平來增強線粒體生物發生功能而發揮保護作用[14]。在本實驗中,外源性給予ZLN005同樣萌購通過促進AMPK信號通路中AMPK-α的磷酸化水平來促進線粒體生物發生的關鍵蛋白NRF1、NRF2和mtTFA的表達來影響LPS誘導的巨噬細胞極化。這提示,ZLN005可能通過促進PGC-1α的表達參與巨噬細胞的表型轉化抑制炎癥反應來改善膿毒癥誘導的肺損傷。
綜上,本研究實驗發現,ZLN005能促進PGC-1α的表達以促進M2巨噬細胞的極化來保護膿毒癥引起的肺損傷,而其相關作用機制可能與ZLN005通過AMPK信號通路促進線粒體生物發生相關。因此,ZLN005有望成為治療膿毒癥誘導肺損傷的潛在應用藥物。

