基于CN/IL-10信號途徑探討烏司他丁對神經性疼痛大鼠模型的鎮痛效應及作用機制
黃鈺媛, 韋雪梅, 鄭育秀, 劉麗麗
(海南醫學院第二附屬醫院麻醉科, 海南 海口 570311)
神經性疼痛(Neuropathic pain)是軀體感覺神經系統損害或功能障礙引起的疼痛,屬于常見的慢性頑固性疼痛。由于神經性疼痛病因復雜,當前針對神經性疼痛的治療藥物有限,使得該疾病仍無法得到有效控制,對患者身體健康及生活質量產生持續性危害[1]。因此,探尋治療神經性疼痛的有效藥物和靶點,仍然是臨床亟需解決的難題。相關研究表明[2],周圍神經受損后,膠質細胞被激活,隨后分泌的大量促炎介質引起的神經炎癥反應是神經性疼痛發生、發展的重要因素。因此,抑制炎癥反應可能成為神經性疼痛治療的潛在途徑。烏司他丁(Ulinastatin,UTI)是一種絲氨酸蛋白酶抑制劑,在臨床上被廣泛用作消炎藥。研究發現[3],UTI可抑制炎癥介質的釋放、降低過氧化物酶和氧自由基水平,從而發揮心、肝、腎等多臟器保護作用。同時,UTI還能夠減輕腦損傷及神經功能損傷,具有神經保護作用[4]。但目前關于UTI作用于神經性疼痛的研究報道較少,因此,本研究建立慢性坐骨神經結扎(chronic constriction injury,CCI)大鼠模型,旨在探究UTI對神經性疼痛的鎮痛效應及相關分子機制。
1 材料與方法
1.1實驗動物:SPF級雄性SD大鼠40只,體重220~250g。飼養環境室溫為22~24℃,相對濕度45~55%,每日明暗交替各12h,標準飼料喂養,自由飲水、進食。本研究動物實驗操作均按照國際疼痛研究協會和國家動物實驗倫理委員會要求進行,嚴格遵循“3R”原則,實驗中盡量減少動物痛苦與用量。
1.2實驗試劑和儀器:UTI注射液(廣東天普生化醫藥股份有限公司,國藥準字H19990133);他克莫司(FK506)(安斯泰來制藥(中國)有限公司,注冊證號H20020377);水合氯醛、多聚甲醛(上海阿拉丁生化科技股份有限公司);白介素-6(IL-6)、白介素-1β(IL-1β)、腫瘤壞死因子-α(TNF-α)酶聯免疫吸附法(ELISA)試劑盒(默沙克生物科技有限公司);蘇木精-伊紅染色法(HE)試劑盒、原位缺口末端標記法(TUNEL)試劑盒、RIPA裂解液、二辛可寧酸(BCA)蛋白濃度測定試劑盒(上海碧云天生物技術研究所);兔抗鈣調神經磷酸酶(calcineurin,CN)抗體、兔抗白介素-10(interleukin-10,IL-10)抗體、兔抗β-肌動蛋白(β-actin)抗體、辣根過氧化物酶(horseradish peroxidase,HRP)標記的山羊抗兔IgG二抗(美國Abcam公司);增強型化學發光試劑(enhanced chemiluminescence,ECL)(上海時代生物科技有限公司)。JZ-BME-410C熱痛刺激儀(北京九州晟欣科技有限公司);Von-Frey纖維絲測痛儀(美國North Coast公司);CM3050S切片機(德國徠卡);LD-96A酶標儀(山東萊恩德智能科技有限公司);CKX53光學顯微鏡、IXTI-12FL/PH熒光顯微鏡(日本奧林巴斯公司);1658001型垂直電泳儀、1703930轉膜儀(美國Bio-Rad公司);FCM凝膠成像分析系統(美國protein simple公司)。
1.3實驗方法
1.3.1實驗分組和CCI大鼠模型制備:將40只大鼠適應性喂養7d后,隨機分為假手術組(Sham組)、模型組(CCI組)、UTI組、UTI+FK506組,每組10只。CCI組、UTI組、UTI+FK506組大鼠根據參考文獻[5]進行造模,將大鼠俯臥位固定于實驗臺,10%水合氯醛(300mg/kg)腹腔注射麻醉,選取大鼠左后肢備皮、消毒,沿大鼠左外側大腿皮膚切口,鈍性分離大腿肌肉組織,使坐骨神經干完全暴露,在坐骨神經干上用4-0鉻制羊腸線做4圈環形結扎,每圈間距約1mm,結扎強度以引起大腿肌肉或足趾輕度顫動反應為宜,復位坐骨神經,縫合皮膚,注射青霉素鈉預防感染。術后24h內大鼠表現出明顯的疼痛行為學變化,包括機械痛敏、熱痛敏等,出現術側爪內收同時后足輕度外翻和跛行等自發性疼痛表現和坐骨神經病理性損傷,即表示模型建立成功。Sham組大鼠同上述操作,只暴露坐骨神經干但不結扎。
1.3.2動物給藥:造模后進行給藥處理,UTI組大鼠腹腔注射UTI 10萬U/kg,UTI+FK506組大鼠腹腔注射UTI 10萬U/kg和2 mg/kg FK506, Sham組和CCI組大鼠分別腹腔注射等量生理鹽水。各組動物均每天給藥1次,連續給藥7d。
1.3.3機械縮足反射閾值(mechanical withdrawal threshold,MWT)的測定:采用Up-Down法測定大鼠機械痛閾的行為學。將各組大鼠單獨置于透明隔板隔開的金屬網格籠中,大鼠適應環境30min,待大鼠活動基本消失后,利用不同級別壓力系數的Von-Frey纖維絲測痛儀刺激大鼠足底中外側,逐漸加壓使刺激針彎曲呈90度,維持5s的刺激時間。若大鼠出現抬足或舔舐足底的行為,則記為陽性反應。連續刺激時,測量間隔時間為5min。分別檢測各組大鼠術前1d、術后3、7、10、14d的MWT。
1.3.4熱縮足反射潛伏期(thermal withdrawal latency,TWL)的測定:將各組大鼠單獨置于有機玻璃間隔的玻璃板(厚度2 mm)上,大鼠適應環境30 min,將熱痛刺激儀置于玻璃板下方,并對準大鼠后爪掌面正中,啟動刺激儀,當大鼠抬足或舔舐足底時,停止計時,儀器顯示的時間即為為TWL。每只大鼠測定5次,每次間隔10min,取5次平均值。分別檢測各組大鼠術前1d、術后3、7、10、14d的TWL。
1.3.5組織取材及處理:術后第14天疼痛指標測量結束后,腹腔注射10%水合氯醛麻醉大鼠,斷頸處死,快速取出各組大鼠術側坐骨神經,一部分坐骨神經標本固定于4%多聚甲醛中,一部分坐骨神經標本置于-80℃冰箱保存備用。
1.3.6HE染色法檢測大鼠坐骨神經組織形態學變化:將保存于4%多聚甲醛中固定的大鼠坐骨神經組織標本常規石蠟包埋、切片,切片厚度為5μm,將各組大鼠坐骨神經切片用蘇木精染液染色5min,蒸餾水洗去染色液,1%鹽酸乙醇3s,蒸餾水洗滌后,用伊紅染液染色2min,依次侵入70%、80%、90%、100%乙醇中脫水10s,然后用二甲苯透明5min,中性樹膠封片,顯微鏡下觀察拍照。
1.3.7ELISA法檢測大鼠坐骨神經組織中炎性因子IL-6、IL-1β、TNF-α水平:取-80℃冰箱保存備用的各組大鼠坐骨神經標本,加入生理鹽水,在4℃條件下勻漿制成10%勻漿液,10000r/min離心10min,收集上清液,嚴格按照ELISA試劑盒說明書進行操作,建立標準曲線,根據酶標儀上讀取的樣品值計算IL-6、IL-1β、TNF-α的含量。
1.3.8TUNEL法檢測大鼠坐骨神經組織細胞凋亡情況:取各組大鼠坐骨神經組織石蠟切片,二甲苯脫蠟,梯度乙醇脫水,磷酸鹽緩沖液(PBS)沖洗5min,用吸水紙吸干多余液體,37℃下加入蛋白酶K工作液處理組織30min,PBS漂洗3次×5min,每個標本上滴加50μL TUNEL反應混合液,置入濕盒中,37℃避光反應60min,PBS漂洗3次×5min,滴加50μL Converter-POD轉化劑,置入濕盒中,37℃避光反應30min,PBS洗滌3次×5min,DAPI染色液染色細胞核,室溫避光反應10min;用DAB顯色,蘇木素復染,自來水沖洗反藍,常規脫水透明,加適量抗熒光淬滅劑封片,倒置熒光顯微鏡下觀察拍照,DAPI標記的正常細胞核呈藍色,細胞核中紅色顆粒為凋亡細胞,記錄細胞凋亡情況,計算細胞凋亡率。細胞凋亡率=凋亡細胞數/細胞總數×100%。
1.3.9Western blot法檢測大鼠坐骨神經組織CN和IL-10蛋白表達水平:取-80℃冰箱保存備用的各組大鼠坐骨神經組織標本,用RIPA裂解液提取組織總蛋白,采用BCA法進行蛋白定量,蛋白樣品水浴煮沸變性5min,采用十二烷基硫酸鈉-聚丙烯酰胺凝膠(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)電泳分離,濕法轉移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),將膜置于含5 %脫脂牛奶的封閉液中室溫封閉2h,分別加入CN一抗(1∶500)、IL-10一抗(1∶500)、β-actin一抗(1∶1000),4℃孵育過夜,Tris鹽酸緩沖液(tris buffered saline tween,TBST)洗膜3次×10min,加入HRP標記的山羊抗兔IgG二抗(1∶2000),37℃孵育1h,TBST洗滌3次×10min,加入ECL化學發光試劑顯影,以β-actin為內參,采用凝膠成像系統儀分析目的蛋白表達水平。
2 結 果
2.1UTI對神經性疼痛大鼠MWT和TWL的影響:與Sham組相比,CCI組大鼠術后3、7、10、14d術側MWT和TWL值明顯降低(P<0.05);與CCI組相比,UTI組大鼠術后3、7、10、14d術側MWT和TWL值明顯升高(P<0.05);與UTI組比較,UTI+FK506組術后3、7、10、14d術側MWT和TWL值明顯降低(P<0.05)(見圖1A和B)。
2.2UTI對神經性疼痛大鼠坐骨神經組織形態學的影響:HE染色結果顯示,Sham組大鼠坐骨神經纖維結構完整、排列整齊、形態正常,無明顯炎癥反應;CCI組大鼠坐骨神經纖維結構紊亂、分布不均勻、神經纖維密度降低,呈收縮狀或空泡狀,炎性浸潤及水腫明顯;UTI組和UTI+FK506組大鼠坐骨神經組織形態學有一定改善,其中UTI組大鼠坐骨神經纖維結構較整齊、分布較均勻、神經纖維空泡樣變性減少,密度增加,水腫面積明顯減少,改善效果較UTI+FK506組更為顯著(見圖2)。
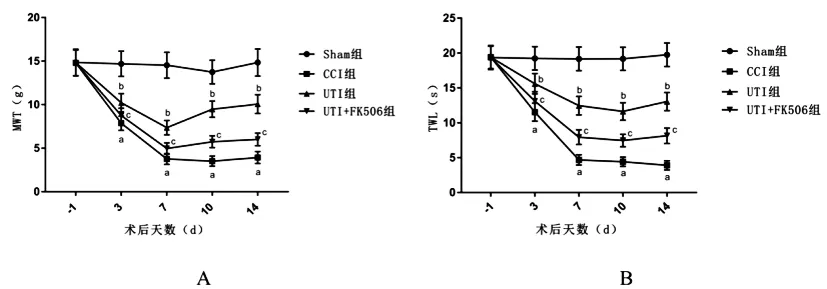
圖1 UTI對神經性疼痛大鼠MWT和TWL的影響
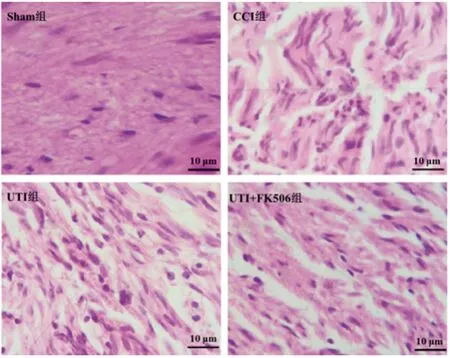
圖2 UTI對神經性疼痛大鼠坐骨神經組織形態學的影響(HE染色,×200)
2.3UTI對神經性疼痛大鼠炎性因子水平的影響:與Sham組相比,CCI組大鼠IL-6、IL-1β、TNF-α水平明顯升高(P<0.05);與CCI組相比,UTI組大鼠IL-6、IL-1β、TNF-α水平明顯降低(P<0.05);與UTI組比較,UTI+FK506組大鼠IL-6、IL-1β、TNF-α水平明顯升高(P<0.05),見表1。
表1 UTI對神經性疼痛大鼠炎性因子水平的影響
2.4UTI對神經性疼痛大鼠坐骨神經細胞凋亡的影響:與Sham組相比,CCI組大鼠坐骨神經細胞凋亡率明顯升高(P<0.05);與CCI組相比,UTI組大鼠坐骨神經細胞凋亡率明顯降低(P<0.05);而UTI+FK506組大鼠坐骨神經細胞凋亡率較UTI組明顯升高(P<0.05)(見圖3)。
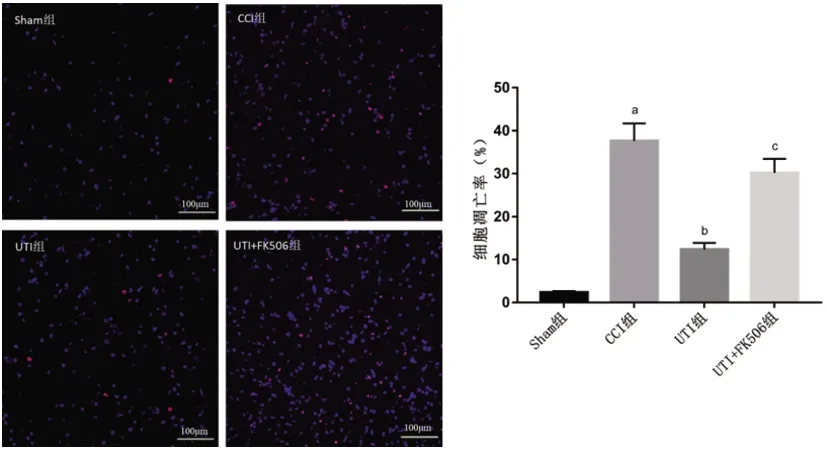
圖3 UTI對神經性疼痛大鼠坐骨神經細胞凋亡的影響(TUNEL染色,×200)
2.5UTI對神經性疼痛大鼠CN和IL-10蛋白表達的影響:與Sham組相比,CCI組大鼠CN和IL-10蛋白表達量明顯降低(P<0.05);與CCI組相比,UTI組大鼠CN和IL-10蛋白表達量明顯升高(P>0.05);而UTI+FK506組大鼠CN和IL-10蛋白表達量較UTI組明顯降低(P<0.05)(見圖4)。

圖4 UTI對神經性疼痛大鼠CN和IL-10蛋白表達的影響
3 討 論
神經性疼痛發病率在普通人群中約占7%~10%左右,該疾病通常以刺痛、灼熱痛等自發性疼痛及痛覺異常、痛覺超敏等刺激誘發樣疼痛為主要表現,且具有易反復、持續性發作的特點,嚴重影響患者日常生活和工作,已成為世界性的公共衛生難題。而當前臨床上尚無徹底治愈神經性疼痛的方法。UTI作為一種蛋白酶抑制劑,研究證實其通過抗炎、清除氧自由基等發揮對神經損傷、脊髓損傷及重要臟器等的保護功能,是一種強效的抗炎、抗氧化劑[6]。Nie等[7]報道,右美托咪定和UTI對長春新堿所致大鼠神經性疼痛具有協同鎮痛效果,作用機制可能與調控α2-腎上腺素能受體(α2-AR)和IL-10表達相關。但UTI作用于神經性疼痛的分子機制尚未完全明確。本研究建立CCI大鼠模型,觀察UTI對坐骨神經損傷所致神經性疼痛的鎮痛效應。結果顯示,CCI模型大鼠術后3、7、10、14d術側MWT和TWL顯著性降低,同時HE結果顯示,CCI組大鼠坐骨神經纖維結構紊亂、分布不均勻、神經纖維密度降低,呈收縮狀或空泡狀,存在明顯的炎性浸潤及水腫現象,表明CCI大鼠模型建立成功。UTI則對CCI誘導的神經性疼痛大鼠機械痛敏、熱痛敏和坐骨神經組織病理性損傷具有一定改善作用。
神經性疼痛動物模型實驗表明[8],促炎細胞因子在神經性疼痛的發病過程中起著非常重要的作用,其中TNF-α、IL-6、IL-1β作為主要的促炎因子介導了神經性疼痛的發生和維持。而過度的炎癥反應刺激會導致神經系統中氧化應激水平增高,進而引起神經細胞凋亡,加劇神經性疼痛。已有研究表明[9],抑制神經細胞凋亡能夠緩解神經性疼痛癥狀。本研究結果發現,UTI可顯著降低神經性疼痛大鼠IL-6、IL-1β、TNF-α水平,減輕神經性疼痛大鼠的炎癥反應,進而改善神經性疼痛大鼠坐骨神經中細胞凋亡情況,最終緩解CCI誘導的神經性疼痛。
鈣調神經磷酸酶(Calcineurin,CN)廣泛分布于哺乳動物的腦、心臟、肝臟、骨骼肌等各種組織中,其在神經系統中的表達水平比其他部位高10~20倍。CN參與神經系統痛覺調節,脊髓背角內CN的缺失可導致CCI引起的神經性疼痛,而鞘內注射外源性CN則能逆轉神經性疼痛引起的機械性疼痛和熱痛覺過敏[10]。Boubali等[11]報道,CN通過激活肌細胞增強因子2(MEF2)和活化T細胞核因子(NFAT)調節T淋巴細胞中細胞因子基因的表達,而MEF2是T淋巴細胞中IL-10基因轉錄的重要靶點。提示CN可調控IL-10的產生。IL-10作為一種抗炎細胞因子,在炎癥過程中起負向調控作用,能夠有效抑制所有促炎因子的合成及其生理作用。相關研究表明[12],IL-10在神經性疼痛中表達降低,而外源性注射IL-10能夠緩解神經性疼痛。本研究為探究神經性疼痛中UTI與CN、IL-10的關系,采用Western blot法檢測相關蛋白表達水平,結果顯示,UTI可顯著上調CCI誘導的神經性疼痛大鼠坐骨神經組織中CN和IL-10蛋白表達量。而CN抑制劑FK506可顯著減弱UTI對神經性疼痛大鼠的作用效果以及對CN、IL-10蛋白表達量的調控作用。提示UTI可能通過調控CN/IL-10信號通路發揮對神經性疼痛的鎮痛效應。
綜上所述,UTI可通過減輕炎癥反應及細胞凋亡緩解神經性疼痛,其作用機制可能與調控CN/IL-10信號通路有關。本研究為神經性疼痛的治療提供了新的候選藥物和潛在靶點。關于UTI對神經性疼痛的鎮痛作用是否存在其他機制,以及UTI作用于神經性疼痛的適宜劑量,還需進一步探索研究。

