Ni基催化劑催化環戊二烯加氫反應及其宏觀動力學
杜浩元,趙永祥,彭陽峰,童天中,趙紅亮
(1. 華東理工大學 化工學院,上海 200237;2. 中國昆侖工程有限公司 錦州分公司,遼寧 錦州 121001)
環戊烯作為一種重要的化工產品,廣泛應用于橡膠、醫藥、農藥等領域,可用來生產環戊醇[1]、環戊酮[2]、戊二醛[3]、戊二酸[4]等具有高經濟價值的產品。工業上生產環戊烯的主要方法是通過C5資源獲得環戊二烯后,在液相狀態下通過催化劑選擇性加氫制得[5]。環戊二烯選擇性加氫的核心在于催化劑,好的催化劑應具有高活性、高選擇性、穩定性好、經濟性優等特點。與鈀系催化劑相比,鎳系催化劑價格更便宜、抗毒害能力更強、穩定性更好[6-9]。近年來,環戊二烯加氫鎳系催化劑的研究取得了一定的成就。Wang等[10-11]制備的Ni-B/SiO2非晶態合金催化劑、李澤壯等[12]制備的Ni-Ru/Al2O3催化劑及張一烔等[13]制備的Ni-B/SiO2非晶態合金催化劑均在環戊二烯選擇性加氫制環戊烯中均表現出良好的轉化率和選擇性,具有潛在的工業應用前景。
目前,關于環戊二烯加氫的研究主要集中在加氫方法、工藝優化和催化劑開發上,環戊二烯加氫動力學的報道相對較少。反應動力學研究包括本征動力學和宏觀動力學,本征動力學是一種消除了內外擴散、研究催化劑表面反應、描述化學反應本身規律的動力學;宏觀動力學是一種包含流體流動、傳熱、傳質等物理因素影響的化學反應動力學[14-17]。顯然,宏觀動力學更加符合實際的工業應用,具有一定的工業指導意義。
本工作采用一種鎳系催化劑在固定床管式反應器中進行環戊二烯的液相加氫反應,考察了反應溫度、反應壓力、氫氣與環戊二烯的摩爾比(簡稱氫烯比)、液態空速對反應的影響;建立了環戊二烯加氫宏觀動力學數學模型,并對數學模型進行參數估值與統計檢驗,得到模型參數,為工業反應器的設計與優化提供依據。
1 實驗部分
1.1 原料
由于環戊二烯在室溫下容易二聚,本工作所用的環戊二烯在實驗室通過雙環戊二烯解聚制備后立即用環己烷按質量比為1∶9的比例稀釋并保存在-15℃的環境中,在此條件下3 d內環戊二烯的聚合程度不超過3%[18]。雙環戊二烯:純度85%(w),上海石化化工研究所;環己烷:純度大于99.5%(w),泰坦科技股份有限公司;氫氣:純度99.999 5%(φ),法國液化空氣集團;ZXH200鎳系催化劑:以Al2O3為載體,單質鎳為活性組分,莊信萬豐(上海)催化劑有限公司。
1.2 儀器
固定床加氫反應器:非標產品,合肥至臻機械科技有限公司。反應器核心為一根垂直安裝的內徑為10 mm,長700 mm的陶瓷管,可看作平推流反應器,陶瓷管外部為三段等溫控制加熱爐,反應器還包括控溫裝置、壓力控制裝置、流量控制裝置及相應的讀數顯示裝置。2ZB-2L20A型雙柱塞微量泵:北京星達科技發展有限公司。GC112N型氣相色譜儀:上海儀電分析儀器有限公司,FID檢測器,JN.SE-30型色譜柱50 m×0.32 mm×0.25 μm。
1.3 工藝流程
首先在流量控制器的控制下由雙柱塞泵將加氫原料打入管路與氫氣混合,經過預熱帶預熱后進入固定床反應器,固定床反應器前后端裝填約250 mm的陶瓷球,中間裝填約200 mm的催化劑,催化劑裝在恒溫段,物料在陶瓷球上預熱后與催化劑接觸發生反應,產物隨后經冷凝管降溫后收集于氣液分離罐,取樣時將穩定液放入試樣收集罐,排空后取樣分析。溫度由等溫加熱爐控制,通過背壓閥調節系統的壓力。
1.4 分析方法
采用氣相色譜儀分析產物組成。柱箱的初始溫度為35 ℃,以3 ℃/min的升溫速率升至50 ℃后保持3 min,再以15 ℃/min的升溫速率升至180 ℃后保持3 min,最后以20 ℃/min的升溫速率升至220 ℃后保持5 min,進樣溫度160 ℃;檢測器溫度250 ℃。用面積歸一法確定物質的含量。
1.5 催化劑的預處理
該催化劑出廠前活性組分鎳已經還原,催化劑已老化,通過處理保證催化劑在室溫環境下能穩定儲存。催化劑使用前需要脫除吸附水,并進行預硫化處理,使催化劑在使用中具有良好的活性與選擇性。
催化劑的干燥:在氫氣流量為200 mL/min、壓力為常壓的條件下進行吹掃,開啟床層的程序升溫,初始升溫速率為90 ℃/h,在床層溫度達到90 ℃時保持10~20 min,后以15 ℃/h的升溫速率升溫,每升高15 ℃保持10~20 min,床層最終在150 ℃下干燥8 h。
催化劑的預硫化:以二甲基二硫醚為硫化劑、環己烷為稀釋劑配制含硫量為50 mg/L的硫化液進行預硫化操作。在硫化溫度35 ℃、壓力1.5 MPa、氫氣流量200 mL/min、液體進料流率為30 mL/h條件下硫化時間16 h。
2 結果與討論
2.1 操作條件對反應的影響
2.1.1 反應溫度
反應溫度對環戊二烯轉化率和環戊烯選擇性的影響見圖1。從圖1可看出,隨著反應溫度的升高,環戊二烯的轉化率逐漸增加,環戊烯的選擇性逐漸下降,符合一般的化學反應規律。在反應溫度為50~80 ℃的范圍內,環戊烯的選擇性明顯下降,且低于90%,這主要是因為溫度升高,反應速率加快,生成的環戊烯越來越多,競爭吸附加劇,更多的環戊烯加氫生成環戊烷。在工業上,滿足效率的同時要求產物的純度盡可能高,因此反應溫度在40~50 ℃之間最為適宜。
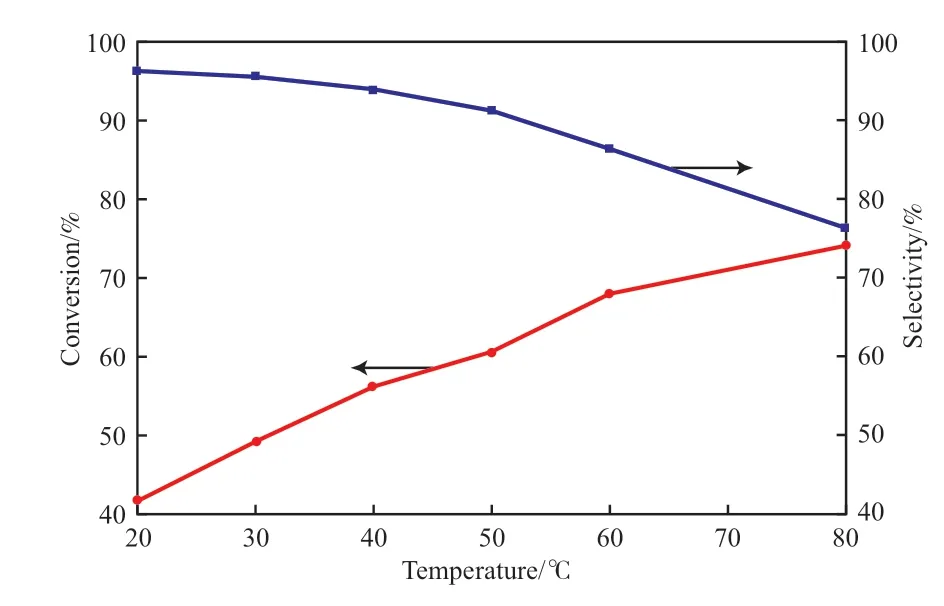
圖1 反應溫度對環戊二烯加氫反應的影響Fig.1 Effect of temperature on the hydrogenation of cyclopentadiene.Reaction conditions:2.0 MPa,n(H2)∶n(cyclopentadiene)=1.4,LHSV=3 h-1.
2.1.2 氫烯比
氫烯比對環戊二烯轉化率和環戊烯選擇性的影響見圖2。
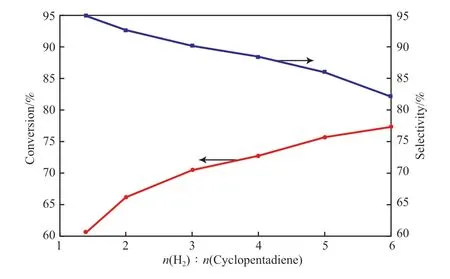
圖2 氫烯比對環戊二烯加氫反應的影響Fig.2 Effect of hydrogen/cyclopentadiene ratio on hydrogenation of cyclopentadiene.Reaction conditions:50 ℃,2.0 MPa,LHSV=3 h-1.
從圖2可看出,隨著氫烯比的增加,環戊二烯的轉化率逐漸升高,環戊烯的選擇性逐漸下降。當氫烯比在1.4~3.0之間時,環戊二烯的轉化率提高較為明顯,且環戊烯的選擇性能維持在90%以上;而當氫烯比大于3.0后,環戊二烯的轉化率提升幅度減少,環戊烯的選擇性降到90%以下。這是由于環戊二烯加氫是一個串聯反應,開始時以環戊二烯加氫生成環戊烯為主,當氫烯比在低區間內改變時,氫氣的含量主要影響主反應而對副反應的影響不明顯;當氫烯比在高區間內改變時,氫氣的含量對于主反應來說已經過量而對副反應的影響加劇。因此,較適宜的氫烯比為2.0~3.0。
2.1.3 反應壓力
壓力對環戊二烯轉化率和環戊烯選擇性的影響見圖3。從圖3可看出,隨反應壓力的升高,環戊二烯的轉化率逐漸升高,環戊烯的選擇性逐漸下降。在1.0 ~2.0 MPa壓力范圍內,環戊二烯的轉化率從43%提高到71%,環戊烯的選擇性從97%降低到90%,說明在該區間內壓力對環戊二烯轉化率的影響比對環戊烯的選擇性影響更大。在2.0~2.7 MPa壓力范圍內,環戊二烯轉化率提升緩慢,環戊烯選擇性下降明顯。這是由于環戊二烯加氫是分子數減少的反應,增大壓力有利于反應的正向進行,且隨著壓力的增加,反應液的氫氣含量增加,更多的環戊烯發生了加氫反應。因此,較適宜的壓力為1.6 ~2.0 MPa。
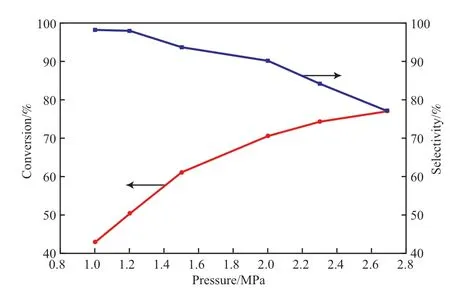
圖3 壓力對環戊二烯加氫反應的影響Fig.3 Effect of pressure on the hydrogenation of cyclopentadiene.Reaction conditions:50 ℃,n(H2)∶n(cyclopentadiene)=3,LHSV=3 h-1.
2.1.4 液態空速
液態空速對環戊二烯轉化率和環戊烯選擇性的影響見圖4。從圖4可看出,隨液態空速的增加,環戊二烯的轉化率下降,在液態空速大于3 h-1時,環戊烯的選擇性沒有明顯的變化。這是由于液態空速增大,環戊二烯與催化劑的接觸時間縮短,轉化率降低,而環戊二烯奪取的氫氣能力變強,環戊烯的選擇性增加。因此,較適宜的液態空速為2~3 h-1。

圖4 進料液態空速對環戊二烯加氫反應的影響Fig.4 Effect of LHSV on the hydrogenation of cyclopentadiene.Reaction conditions:50 ℃,2.0 MPa,n(H2)∶n(cyclopentadiene)=3.
2.2 宏觀動力學
2.2.1 動力學模型的建立
在環戊二烯加氫反應體系中,環戊二烯除了生成環戊烯之外還會發生其他反應,如環戊二烯深度加氫生成環戊烷、環戊二烯二聚或三聚、二聚物雙環戊二烯加氫生成二氫雙環戊二烯或四氫雙環戊二烯。考慮到原料中的二聚物含量極低且在反應器內的停留時間較短,可認為體系中主要發生式(1)的反應。
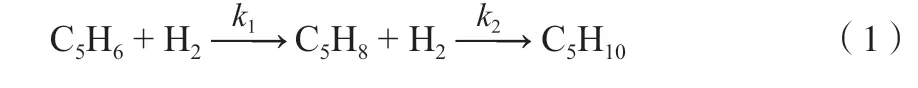
為了考察環戊二烯液相加氫的宏觀動力學,模型采用較簡單、便于指導工業應用的冪函數形式。影響環戊二烯液相加氫的因素包含:反應溫度、反應壓力、氫烯比與液態空速,因此,建立的動力學模型如下:

綜上,需要確定的動力學參數有A1,Ea1,a,b,c,A2,Ea2,d,e,f。2.2.2 模型參數估值
式(2),(3),(6),(7)及反應器的入口條件組成了一階常微分方程的初值問題。通過給定動力學模型參數的初值并采用合適的數值積分方法就可以得到反應器出口的組成情況,然后將計算值與實驗值對比,以一定的優化算法優化修正參數直至滿足設定的精度,最后得到模型參數的擬合值。根據環戊二烯加氫反應的實驗結果,采用龍格-庫塔法對式(2),(3),(6),(7)求解,并運用列文伯格-馬夸爾特法對參數估值[19],得到動力學模型參數。
將環戊二烯、環戊烯、環戊烷摩爾分數的模擬值與實驗值偏差的平方和作為優化目標函數:

2.2.3 模型驗證
將環戊二烯與環戊烯視為關鍵組分,對宏觀動力學模型進行統計檢驗,ρ2為決定性指標,是度量回歸值總偏離大小的參數,ρ2的值越大,模型就越可靠,ρ2表達式為:

F為回歸均方與模型計算誤差均方和之間的比值,表達式為:
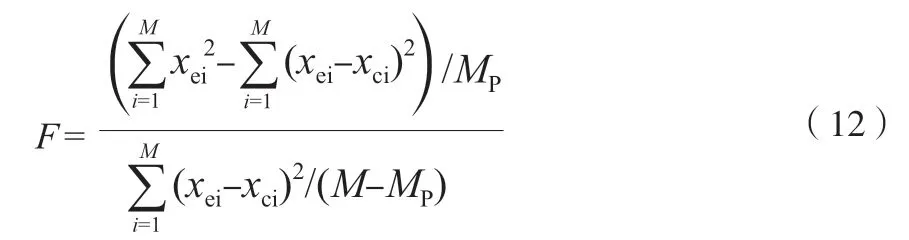
非線性擬合中,當ρ2>0.9,F>10F0.05(10,11)即表明模型可以較好地預示實驗結果。
環戊二烯轉化率與環戊烯選擇性的模型計算值與實驗值的相對偏差見圖5。圖中對角線表示計算值與實驗值等值,上方的點表示計算值比實驗值大,下方的點表示計算值比實驗值小。
模型方程的r1與r2的ρ2>0.9,F>10F0.05(10,11)。由圖5可得,環戊二烯的轉化率與環戊烯的選擇性的模型計算值分布在對角線附近,平均偏差在10%以內,計算值與實驗值吻合良好。綜上,在溫度為20~80 ℃、反應壓力為1.0~2.7 MPa、氫烯比為1.4~6.0、液態空速為2~7 h-1條件下,得到的動力學模型適用可信。
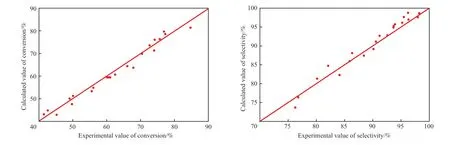
圖5 環戊二烯的轉化率和環戊烯的選擇性計算值與實驗值的對比Fig.5 Comparison between the calculated value and experimental value of cyclopentadiene conversion and cyclopentene selectivity.
3 結論
1)ZXH200鎳系催化劑催化的環戊二烯液相加氫反應適宜的條件為:反應溫度40~50 ℃、反應壓力1.6 ~2.0 MPa、氫烯比2.0~3.0、液態空速2~3 h-1。
2)在適宜的反應條件內,ZXH200鎳系催化劑催化環戊二烯選擇性加氫可使用冪函數形式的宏觀動力學模型進行描述,該宏觀動力學模型是適用可信的。
符 號 說 明



