液體管理對ICU心臟術后患者的臨床意義*
李 霞,賴軍華,馬華怡,易渠深,羅 靜
(柳州市工人醫院重癥醫學科,廣西 柳州 545007)
心臟外科手術是患有心臟及血管疾病患者的重要手術,術后常因出血、毛細血管滲漏、容量再分布等導致低血容量[1-2],糾正低血容量的首要措施是靜脈滴注。然而,心臟術后容量治療策略目前仍未統一,現有研究表明,補液方式、時機、種類均將影響患者預后。早期補液擴充血容量可提高心輸出量而增加氧輸送,保證器官灌注避免器官功能障礙[3]。但如過度補充血容量將導致液體外滲組織間隙水腫,甚至引起多器官功能障礙,即容量超負荷[4]。有研究表明,限制性液體復蘇對心臟術后患者是有益的,但沒有證據證實心臟術后患者應如何進行液體管理。本研究回顧性分析了液體負平衡對重癥監護病房(ICU)心臟術后患者病死率的影響,現報道如下。
1 資料與方法
1.1資料
1.1.1研究對象 本研究為回顧性臨床觀察研究,納入研究對象為2019年10月至2020年10月本院重癥醫學科收治的心臟外科手術后患者127例,年齡大于18歲,均在體外循環下行心臟手術并入住ICU的患者。
1.1.2納入標準 (1)血壓達到正常(血管活性藥物使用下),射血分數≥35%;(2)無明確外科原因所致大出血。
1.1.3排除標準 (1)惡性心律失常;(2)心臟驟停;(3)存在殘余分流或殘余梗阻。
1.2方法 記錄127例患者基本數據,包括年齡、性別、體重指數、主要心血管診斷、合并疾病等。術后ICU后24 h內進行急性生理和慢性健康估測評分Ⅱ(APACHEⅡ),每天液體平衡為24 h內液體攝入(靜脈液體、血液制品和腸內營養)和液體丟失(尿液、腸內損失、排泄損失、超濾率)之間的差異,ICU累計液體平衡為每天液體平衡的總和。分析液體平衡與結果之間的關系時,液體平衡視為連續變量,而負平衡視為一個二元變量。隨訪至患者出院或住院第28天,記錄患者術后28 d內所有死因,計算術后病死率。
2 結 果
2.1存活組與非存活組患者一般資料比較 127例患者中死亡10例(非存活組),占7.9%,死亡原因主要為低心排出量綜合征(低心排)、急性心肌梗死、多器官功能衰竭、膿毒血癥等。存活組患者117例。2組患者性別、年齡比較,差異均無統計學意義(P>0.05)。非存活組患者APACHEⅡ明顯高于存活組,差異有統計學意義(P<0.05)。2組患者主要診斷均為心臟瓣膜病、冠心病、主動脈夾層、先天性心臟病及其他,2組患者冠心病及其他診斷占比比較,差異均有統計學意義(P<0.05)。2組患者主要合并疾病均包括高血壓、糖尿病、慢性阻塞性肺疾病(COPD)、腦梗死、腎功能不全等,2組患者合并高血壓、糖尿病占比比較,差異均有統計學意義(P<0.05)。2組患者術后肌酐、連續腎臟替代療法(CRRT)、膿毒血癥、液體負平衡、住院時間比較,差異均有統計學意義(P<0.05)。2組患者ICU時間比較,差異無統計學意義(P>0.05)。見表1。
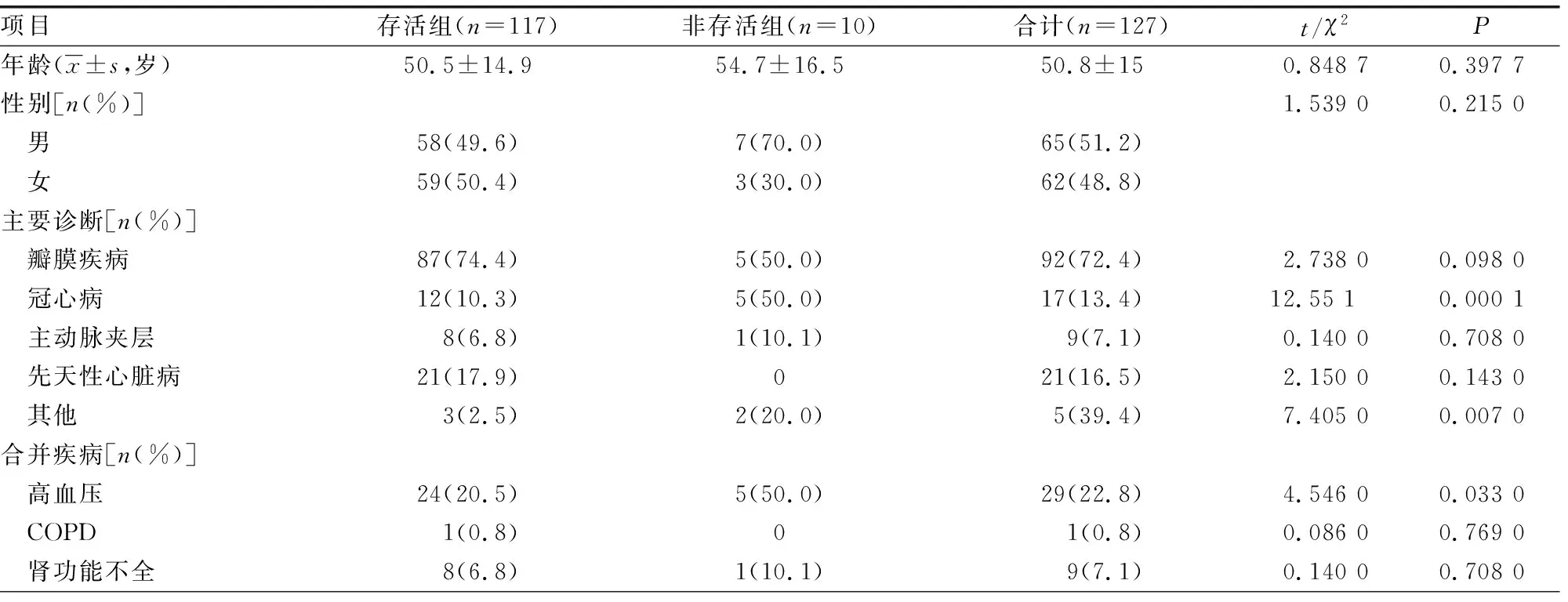
表1 存活組與非存活組患者一般資料比較

續表1 存活組與非存活組患者一般資料比較
2.2液體負平衡組與液體正平衡組患者一般資料比較 127例患者中液體負平衡患者82例(液體負平衡組),液體正平衡患者45例(液體正平衡組)。2組患者性別比較,差異無統計學意義(P>0.05)。液體正平衡組患者年齡、APACHEⅡ均明顯高于液體負平衡組,差異均有統計學意義(P<0.05)。2組患者主要診斷為主動脈夾層占比的比較,差異有統計學意義(P<0.05)。2組患者合并疾病中高血壓占比比較,差異有統計學意義(P<0.05)。2組患者術后肌酐、ICU時間比較,差異均有統計學意義(P<0.05)。2組患者中存活者ICU時間、住院時間比較,差異有統計學意義(P<0.05)。2組患者病死率比較,差異有統計學意義(P<0.05)。見表2。2組患者生存曲線見圖1。
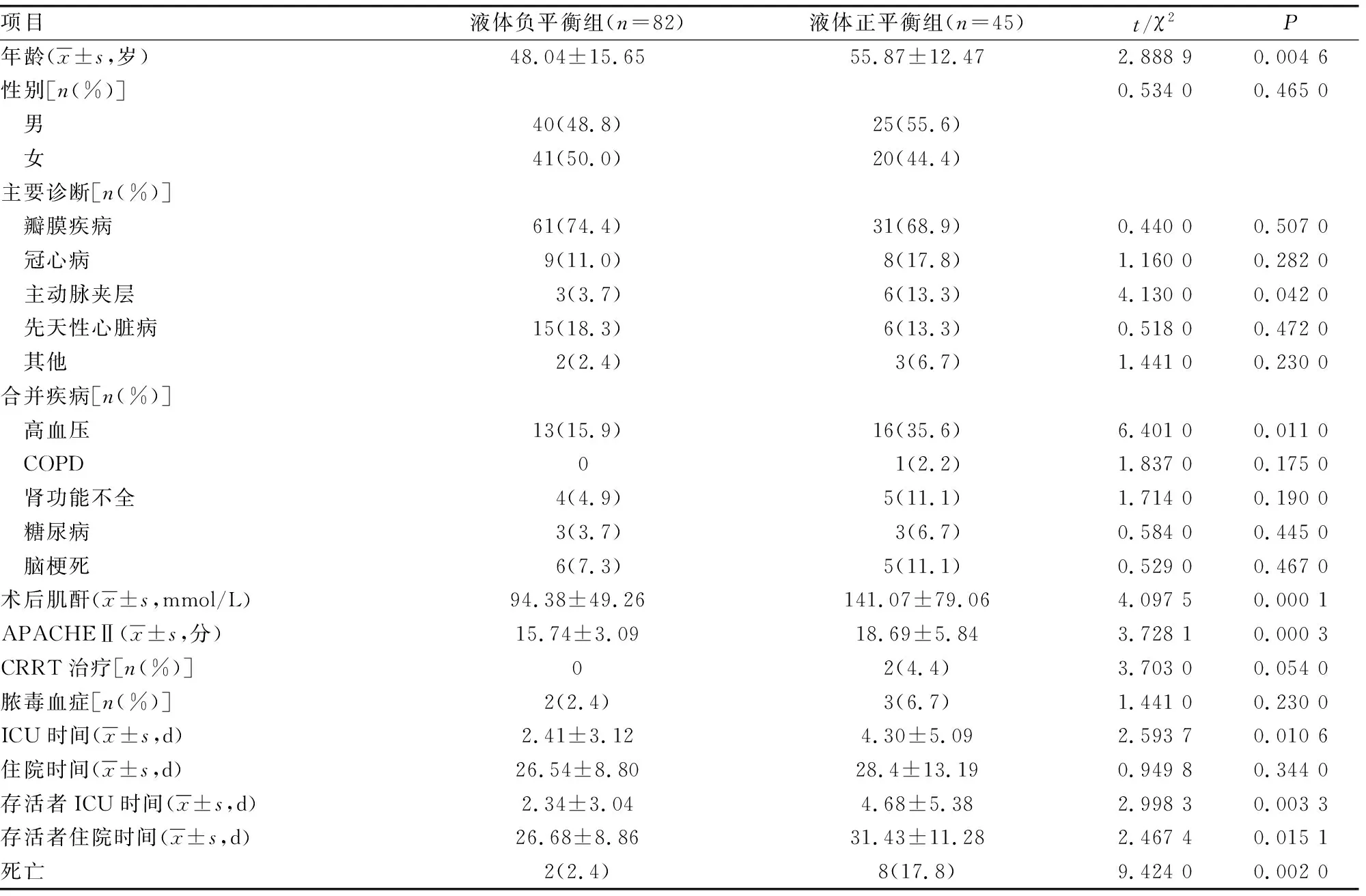
表2 液體負平衡組與液體正平衡組患者一般資料比較
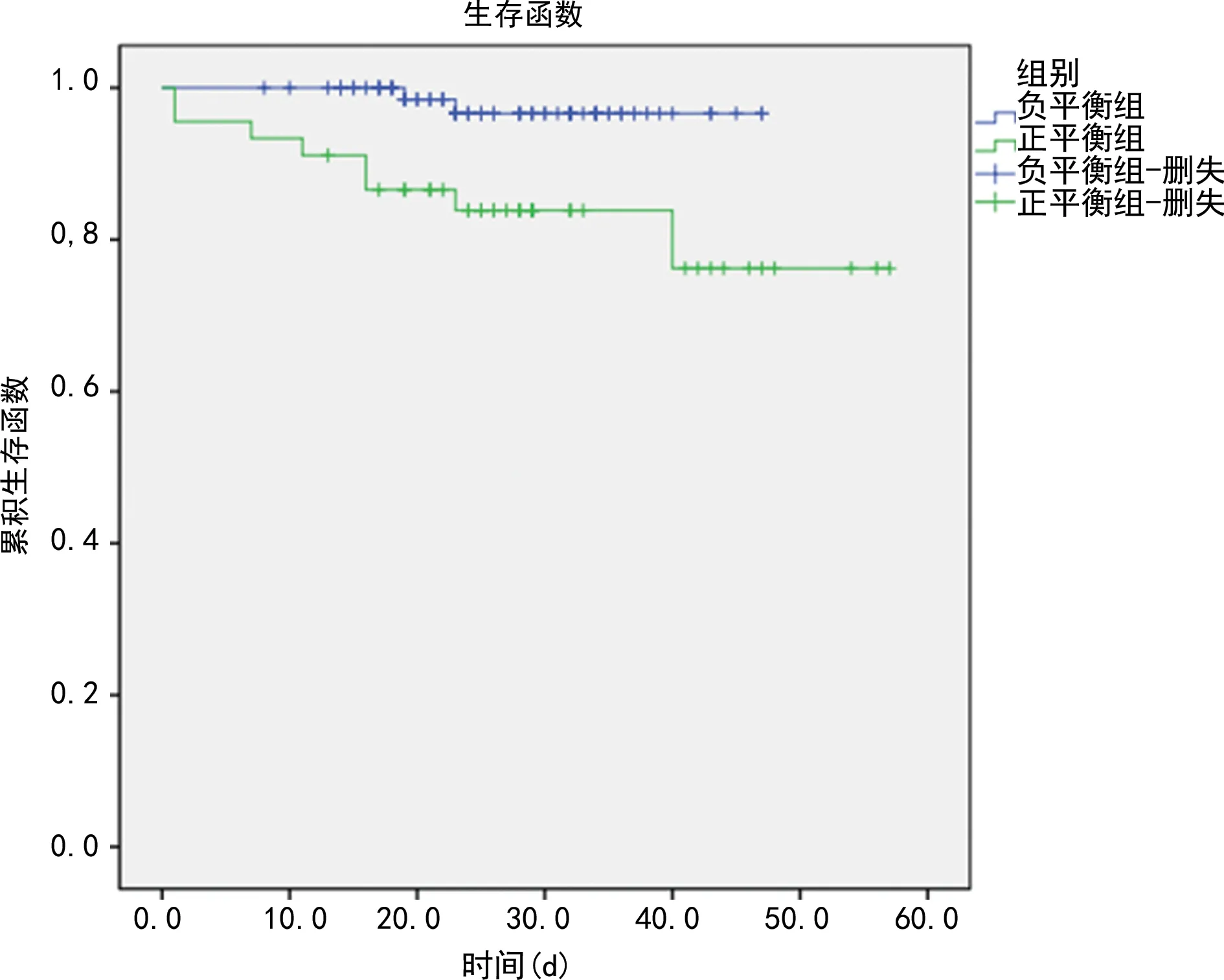
圖1 2組患者生存曲線
3 討 論
本研究結果顯示,心臟外科術后液體負平衡與病死率有關,術后ICU期間液體負平衡患者病死率較低,較高的APACHEⅡ與患者不良預后有關。冠心病患者行心血管手術與術后死亡相關,非存活組患者術后肌酐明顯升高,需要接受CRRT治療,膿毒血癥發生率較高,同時,該類患者往往因病情危重、血流動力學不平穩等因素難以維持一定的液體負平衡,病情進展迅速,住院時間較短。液體正平衡組患者年齡高于液體負平衡者,考慮與患者年齡越大,器官功能相對較差有一定關系,同時,液體正平衡組患者APACHEⅡ高于液體負平衡組,說明病情往往較重。液體正平衡組患者ICU時間、住院時間均高于液體負平衡組,說明液體管理可縮短患者ICU時間及住院時間。
本研究結合早期研究可見,與液體正平衡比較,液體負平衡對心臟外科術后患者是有益處的。容量超負荷常發生在急危重患者中,可導致多器官功能障礙,甚至更嚴重的后果。間質內液體外滲可增加血管外肺水、破壞氧合功能,增加腎間質液體,減少毛細血管血流量,甚至導致腎缺血[5]。液體過度超過機體承受范圍,對心肌、肝臟、凝血系統均具有一定影響,組織水腫導致傷口難以愈合,過多液體堆積在體內,嚴重者導致腹腔高壓及呼吸困難等[4]。已有多項研究證實,危重病患者液體超負荷與病死率、發病率均有關[6-9]。OGBU等[4]回顧性分析了2 526例患有急性腎損傷的危重患者的臨床資料,結果顯示,液體超負荷是增加急性腎損傷發生率和嚴重度的獨立危險因素。另一項關于膿毒癥及膿毒癥休克患者的研究結果顯示,早期(48、72、96 h)累計液體正平衡與較高的病死率有關,同樣的結局也適用于外科及創傷患者[9]。本研究結果顯示,液體負平衡可降低病死率,降低患者接受血液凈化治療的概率。液體負平衡還可縮短ICU時間,能夠減少患者二次創傷及家庭費用的支出,從而減輕患者經濟負擔,減少醫療費用,與相關研究結果一致[10]。
在危重病患者的治療中,尤其是心臟外科手術后,由于臨床病情、檢測技術和手術等多種因素導致血流動力學極不穩定,液體的最佳管理仍是一個重要且有待于解決的問題。這些因素包括患者本身心肌功能障礙、術中體外循環的確定因素、心臟停搏液使用及復雜的外科手術創傷。心臟外科手術后入住ICU的患者因低心排所致的低血壓僅占12.5%,因此,應該避免過度的容量治療。通過容量反應、中心靜脈血氧飽和度、乳酸值及心輸出量等血流動力學監測對心臟外科術后實施目標導向性治療。一項系統性評價結果顯示,心臟外科術后患者實施目標導向性液體管理可降低病死率及縮短住院時間[11]。本研究是回顧性研究,結果與早期已有研究結果一致,在維持血流動力學平穩后液體負平衡能降低術后病死率。
已有研究結果顯示,心臟外科手術類型和體外循環時間是患者早期死亡的獨立危險因素[12-13],而且術中大出血和輸血與術后早期病死率顯著相關,包括低風險患者[14]。此外,體外循環期間和術后血流動力學不平穩可顯著增加術后早期死亡的風險[15]。但本研究未將這些因素進行分析,是本研究的不足之處,因此,并不能證明術后ICU液體負平衡與降低術后病死率之間存在直接因果關系。而且與存活者比較,非存活者術后ICU住院期間APACHEⅡ顯著升高,膿毒血癥、腎功能不全發生率較高,說明非存活者術后情況較存活者差。
綜上所述,心臟外科術后適當液體負平衡可改善患者預后,降低腎功能不全發生率,縮短ICU時間及住院時間,同時,降低病死率。但本研究屬回顧性研究,存在一定的局限性,尚需大樣本、多中心研究進一步證實。