基于小胸鱉甲轉錄組的免疫相關基因發掘
李潔瓊
(新疆農業職業技術學院生物科技分院,新疆 昌吉 831100)
昆蟲不具備適應性免疫系統,依賴多種先天防御反應對抗入侵的病原體和寄生蟲,這些反應包括使用物理屏障以及局部和全身的先天免疫反應[1,2]。同時昆蟲體內存在的強大抗菌免疫系統可以作為第二道防線發揮作用,主要基于抗菌肽,但也包括絲氨酸蛋白酶、應激因子和參與調理和凝血的因子[3,4]。與其他生理過程一樣,昆蟲免疫反應涉及傳感器(sensor)、效應器(effector)和信號轉導器(signal transducer),將病原體識別與細胞免疫反應、體液免疫反應聯系起來[5-7]。因此,昆蟲細胞外和細胞內信號轉導網絡對于介導昆蟲的免疫反應是非常重要的。受體介導的Toll、IMD、MAPK-JNK-p38、JAKSTAT 等免疫信號通路進化保守,作為體液和細胞免疫反應的調節劑和介質發揮著重要的作用[8-10]。
對果蠅(Drosophila melanogaster)的研究表明,真菌、革蘭氏陽性細菌往往是借助果蠅體內的絲氨酸蛋白酶級聯作用,水解活化細胞因子Sp?tzle 最終觸發Toll 通路[11,12]。被激活的細胞因子Sp?tzle 能夠高度結合Toll 受體,借助Dorsal、Dif 等NF-κB 轉錄激活因子,作用和調控體內的免疫效應物基因的表達水平,促進抗菌肽加速合成。在這一過程中還會逐步分化血細胞,從而產生具有包裹作用的層狀細胞,可以殺滅寄生蟲、病原體[13]。當發現或感知到革蘭氏陰性細菌時,DAP 型肽聚糖可以快速通過信號傳導介質、跨膜受體PGRP-LC 開啟IMD 信號通路,活化的Relish(NF-κB 轉錄激活因子)也會轉入細胞核內,啟動另一組免疫相關基因的轉錄[14,15]。而且,果蠅體內有很多能夠激發MAPK-JNK-p38 通路的物質,如應激信號、生長因子、細胞因子等,并對細胞凋亡、分化和IMD 通路起到調節作用[16,17]。此外,JAK-STAT 通路、RNA 干擾以及自噬同樣也會介入抗病毒免疫反應[18]。根據現有信息,這些途徑在模式昆蟲和非模式昆蟲中基本保守,但也存在明顯的差異。報道顯示,意蜂(Apis mellifera)的各類免疫基因并不是很多[19]。例如,果蠅中已發現9 個不同的Toll 基因,但是意蜂卻僅為5 個[19]。相較于果蠅,豌豆蚜(Acyrthosiphon pisum)尚未找到完整、統一的IMD 途徑[20]。在昆蟲綱中,部分基因組已發現免疫相關基因在不同物種中是有區別的。因此,有必要分析在不同的昆蟲中,是否存在完整的免疫信號傳導通路以及免疫信號通路組分的進化是否保守。
昆蟲生存的微環境豐富多樣,對不同類別的昆蟲來說,其響應低溫、病原微生物等脅迫的分子機制有顯著差異。鞘翅目擬步甲科昆蟲小胸鱉甲(Microdera punctipennis),廣泛地分布于新疆地區的古爾班通古特沙漠,是生存于北部荒漠的優勢物種之一,也是新疆特有物種[21],在抵抗荒漠環境時具有自身的優勢和特點[22]。小胸鱉甲這種對環境適應性的差異需要從基因整體表達的角度開展全面研究。所以,本研究以小胸鱉甲為試驗對象,樣本采集選擇在越冬地點進行,并分別對越冬的成蟲、實驗室飼養的成蟲和實驗室低溫脅迫的成蟲進行轉錄組測序[23-25],最終建立低溫響應相關的轉錄組數據庫,獲得小胸鱉甲基因整體表達的情況。
目前缺乏對小胸鱉甲分子免疫機制的研究。為觀察小胸鱉甲自身的免疫功能在低溫環境下發生哪些變化,人們先要了解它的免疫系統,對比、判斷與其他模式昆蟲是否存在不同之處。目前昆蟲防御機制的基因組分析表明,病原體誘導免疫應答的中心是識別真菌、細菌和病毒所引發的信號通路,這些信號通路可導致效應分子的產生[8],因此,本研究利用小胸鱉甲的轉錄組數據首次注釋和篩選了小胸鱉甲的免疫相關基因,包括編碼模式識別受體、信號轉導及調控因子、免疫效應因子等。分別對小胸鱉甲潛在的模式識別受體蛋白完成有序的篩選;對Toll、IMD、MAPK-JNK-p38 以及JAK-STAT 免疫通路,以及自噬、凋亡還有RNA 干擾等免疫相關的細胞過程進行全面的分析;并對溶菌酶、抗菌肽、幾丁質酶、熱休克蛋白、酚氧化酶以及谷胱甘肽S-轉移酶等免疫效應物做出注釋。結合篩選得到的免疫相關基因繪制小胸鱉甲免疫通路圖,建立小胸鱉甲的免疫系統架構。此研究成果為進一步明確昆蟲免疫調控與抗寒機制的內在聯系奠定可靠的基礎。
1 材料與方法
1.1 樣品采集、處理及測序
小胸鱉甲成蟲采自古爾班通古特沙漠南部,阜康市222 團(44°24′ N,87°51′ E,海拔444 m),于實驗室(30 ℃)飼養。4 只越冬成蟲于2016年1月11日采集(組名為Mp_W),置于液氮內保存。采樣點土壤溫度-8.8 ℃,濕度4.98%。在飼養得到的成蟲中選取個體相似的3 只作為對照組試蟲(組名為Mp_30)。此外,取3 只飼養的成蟲于-4 ℃低溫脅迫處理3 h(組名為Mp_4)。-4℃處理組、越冬組、對照組,全部通過Illumina HiSeq?4000 測序儀來完成轉錄組測序。
為補充低溫處理的數據,再次將3 只飼養的成蟲作為對照組試蟲(組名為CK),另取3 只飼養的成蟲于4 ℃低溫脅迫處理3 h(組名為CD),通過測序儀完成轉錄組測序。
小胸鱉甲轉錄組測序數據已上載至生物技術信息中心(NCBI),利用BioProject 號PRJNA345299 即可完成下載。
1.2 原始序列拼接組裝
基于Novogene 內部的Perl 腳本,進行測序raw reads 的預處理。將adapter、低質量reads(摻雜多聚-N)予以去除,留下clean reads。通過Trinity(r20140413p1)軟件進行clean reads 的拼接得到contig,然后進行contig 聚類組裝,從中選取最長的轉錄本作為unigene。除參數min_kmer_covfor 設為2 外,各參數均為0。
1.3 unigene 功能注釋和分類
基于blastx 算法(E-value<10-5),將unigene 與Refseq Insect Protein、Refseq Insect RNA、NCBI Nr、NCBI Nt、Swiss-Prot、基因本位GO、京都基因與基因組百科全書KEGG 等多個數據庫的已知序列做比較,根據序列相似性,可以對照注釋轉錄組中unigene 的功能。若同個unigene 在不同的庫中注釋結果不一致,則參照最佳命中(best hit)結果來確定基因的生物學功能。使用軟件Blast2go 預測各序列功能及其GO 分類,使用KAAS(KEGG auto annotation server)預測KEGG 代謝通路。
1.4 重要免疫相關基因的篩選和比較
基于基因比對注釋的信息,并參照果蠅[9,11-14,16,17]、家蠶[26]、赤擬谷盜(Tribolium castaneum)[27]、煙草天蛾[5,28]等昆蟲物種中已報道的相關知識,采用人工識別的方法從小胸鱉甲轉錄組序列中識別篩選出與免疫信號途徑有關的基因序列,尤其MAPK、Toll、IMD、JAK-STAT、RNAi、凋亡和自噬等信號通路。利用Trinity 的CDS 軟件來完成蛋白編碼序列(Protein coding sequence,CDS)的預測。根據上述結果,篩選免疫相關基因,同時繪制小胸鱉甲的免疫通路圖。
2 結果與分析
2.1 基于昆蟲數據庫的小胸鱉甲測序數據的組裝及功能注釋
為了充分獲取小胸鱉甲低溫轉錄組中潛在的昆蟲免疫相關基因序列,本研究收集以小胸鱉甲為材料測序的所有RNA-Seq 數據(表1),包括來自冬季樣本的4 組數據(Mp_W),30 ℃飼養成蟲對照組樣本的3 組數據(Mp_30),-4 ℃3 h 處理樣本的3 組數據(Mp_4),4 ℃3 h 處理樣本的1 組數據(3 只昆蟲數據合并)(CD)和25 ℃飼養成蟲的1 組數據(3 只昆蟲數據合并)(CK)。

表1 小胸鱉甲轉錄組測序數據的統計
4 個越冬組樣本、3 個-4 ℃組樣本和3 個對照組均是利用De novo 組裝、Trinity 拼接,得到的平均長度為635 bp,N50 為1 007 bp 的198 206 個小胸鱉甲unigene(表2)。4 ℃處理組與對照組樣本總共得到79 725 244 個轉錄本,約為31 741 條unigene,其長度平均為1 019 bp,N50 為1 958 bp。
將小胸鱉甲unigene 與NCBI nr 庫內的123 種昆蟲基因數據進行序列同源性對比,共發現49 034 個unigene(占24.74%)與已知的其他昆蟲蛋白具有不同程度的同源性(表3)。在小胸鱉甲已注釋的序列中,有9 650 個(E-value = 0)unigene 是完全匹配的,占注釋序列總數的19.68%(圖1a)。分析對比同源性序列一致的物種,共9 522 個unigene(占19.42%)和模式昆蟲赤擬谷盜存在高度同源性(圖1b)。
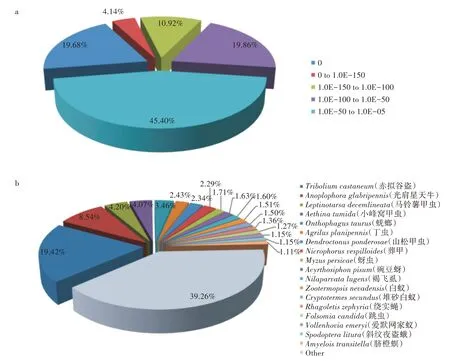
圖1 小胸鱉甲轉錄組unigene 與NCBI的nr 庫昆蟲數據的比對結果

表3 小胸鱉甲轉錄組測序數據在公共數據庫中的基因注釋統計
2.2 小胸鱉甲免疫相關基因的篩選與分析
從轉錄組數據分析和功能注釋的結果中,共篩選得到小胸鱉甲的107 個免疫相關基因及其同源unigene 1 750 個,分為識別、信號轉導與調控、效應分子3 大類(表4)。
小胸鱉甲轉錄組中篩選出16 種模式識別受體,其中,vitellogenin最多,有75 個unigene;篩選出昆蟲調制因子(Modulator)相關的352 個unigene,其中包括絲氨酸蛋白酶SP 基因的同源unigene 112 個(表4)。另外,有13 個絲氨酸蛋白酶抑制劑serpin 基因同源unigene。
昆蟲Toll 信號通路的組分是高度保守的,與果蠅相比,小胸鱉甲的Toll 通路是完整的,具有編碼胞外細胞因子sp?tzle、跨膜受體Toll、激酶pelle 和NFκB 轉錄因子dorsal等基因(表4,圖2)。
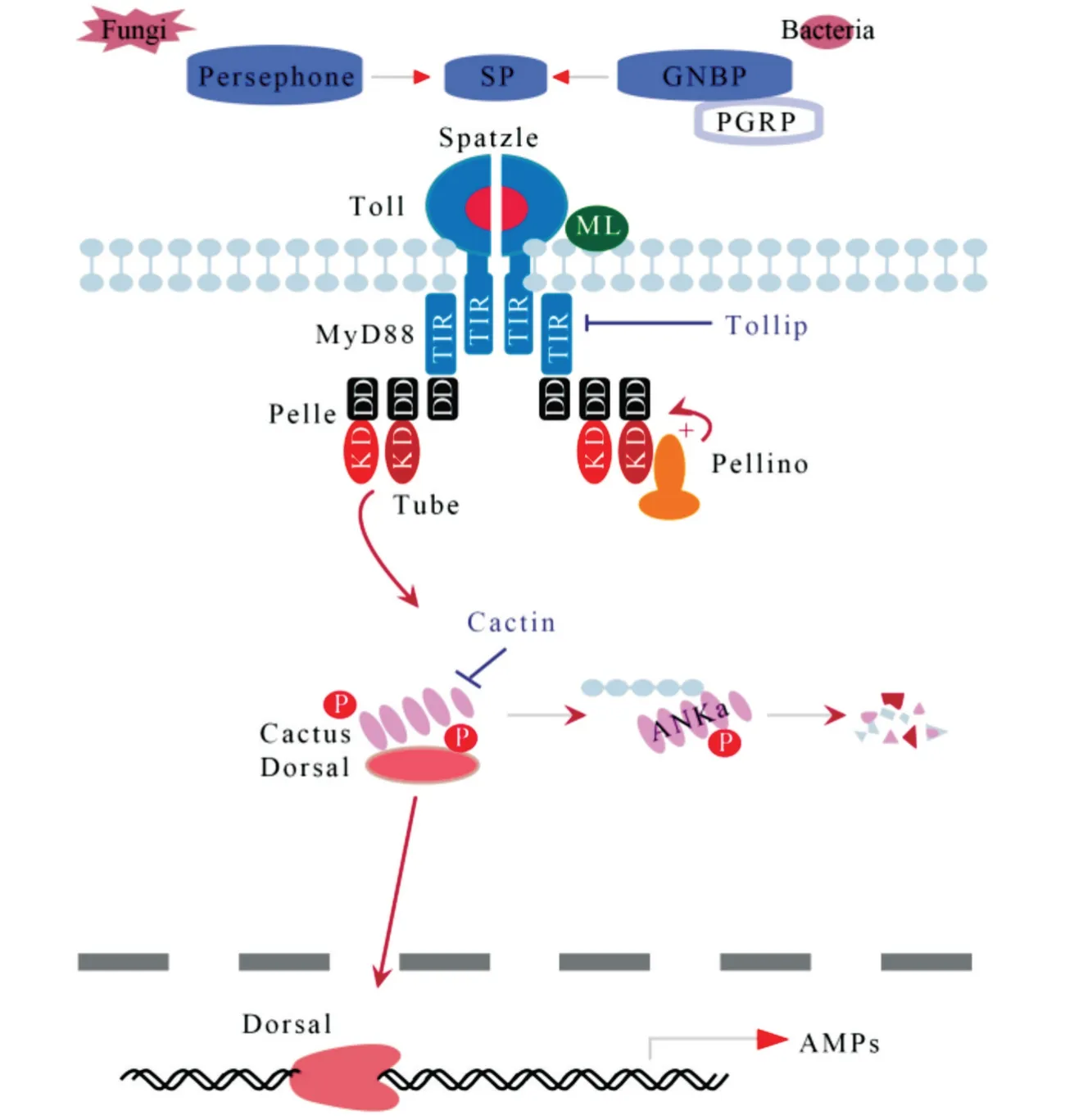
圖2 小胸鱉甲Toll免疫信號通路及其調控
圖3 顯示小胸鱉甲IMD 通路基因包含了TAK1、TAB2、Dredd、Ird5、Relish(Rel)、Effete等。與果蠅IMD 通路相比,小胸鱉甲缺失的IMD 通路基因包括IMD、kenny和FADD。IMD 通路也分支到JNK 通路和細胞凋亡通路,圖3a 顯示,JNK 通路是IMD 通路的一個分支,共享一些上游調控基因,包括TAK1、TAB2 和IRD5;圖3b 顯示,JNK 通路與p38MAPK 通路共同激活下游基因——核內轉錄因子Jra/Fos,增強特定基因的轉錄。此外,還有2 種血小板衍生和血管內皮生長因子PVF 及其受體PVR,可以和小GTP 酶Ras85D 共同作用激活JNK 通路(圖3b)。同時MLK1 和MKK4 也參與到JNK 途徑的激活。
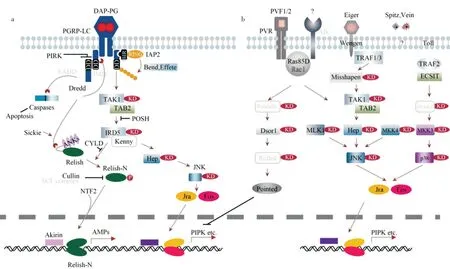
圖3 小胸鱉甲IMD-JNK 與MAPK-JNK-p38 免疫信號通路及其調控
圖4 顯示小胸鱉甲具有JAK-STAT 通路的核心基因,包括編碼JAK 酪氨酸激酶(Hopscotch)和STAT 因子的基因,與果蠅相比,小胸鱉甲轉錄組中未找到與跨膜受體Dome(domeless)、配體Upd(unpaired)同源的基因(表4,圖4a)。介入調節免疫的RNAi 途徑有3 種,分別為piRNA、miRNA、siRNA。小胸鱉甲轉錄組中注釋到dicer(Dcr)、Belle、argonaut(Ago)以及Vig基因,如siRNA 核心基因Dcr-2、Ago-2,以及miRNA 和piRNA 的核心基因Ago-1和Ago-3(表4,圖4b)。在小胸鱉甲轉錄組中檢測到參與調控整個自噬過程的自噬相關基因(Autophagy-related gene,Atg)的同源unigene,分別為Atg1、Atg2、Atg5、Atg8、Atg9、Atg13、Atg16,還有5 個磷脂酰肌醇3-激酶PI3K、6 個蛋白激酶AKT、8 個蛋白激酶TOR基因的同源unigene(表4,圖4c)。同時,檢測到細胞凋亡過程中重要的5 個基因,包括sickle、IAP1(Inhibitor of apoptosis)、Dronc(caspase-5)、Dredd(caspase-6)以及hid(編碼IAP 拮抗劑)(表4,圖4d)。

圖4 小胸整甲JAK-STAT(a)、RNAi(b)、自噬(c)與凋亡(d)免疫信號通路及其調控
對免疫效應因子對應的基因進行初步注釋、篩選后,發現小胸鱉甲轉錄組中共有558 個免疫效應因子基因的同源unigene(表4),包括抗菌肽、溶菌酶、幾丁質酶、熱休克蛋白、酚原氧化酶(PPO)以及酚氧化酶(PO)等。此外,還具有涉及調控自由基的多種抗氧化酶,包括過氧化物酶、過氧化氫酶、超氧化物歧化酶、谷胱甘肽S-轉移酶、NADPH 氧化酶、一氧化氮合酶、硫氧還蛋白還原酶、硫醇抗氧化酶等(表4)。

表4 小胸鱉甲主要免疫基因

續表4
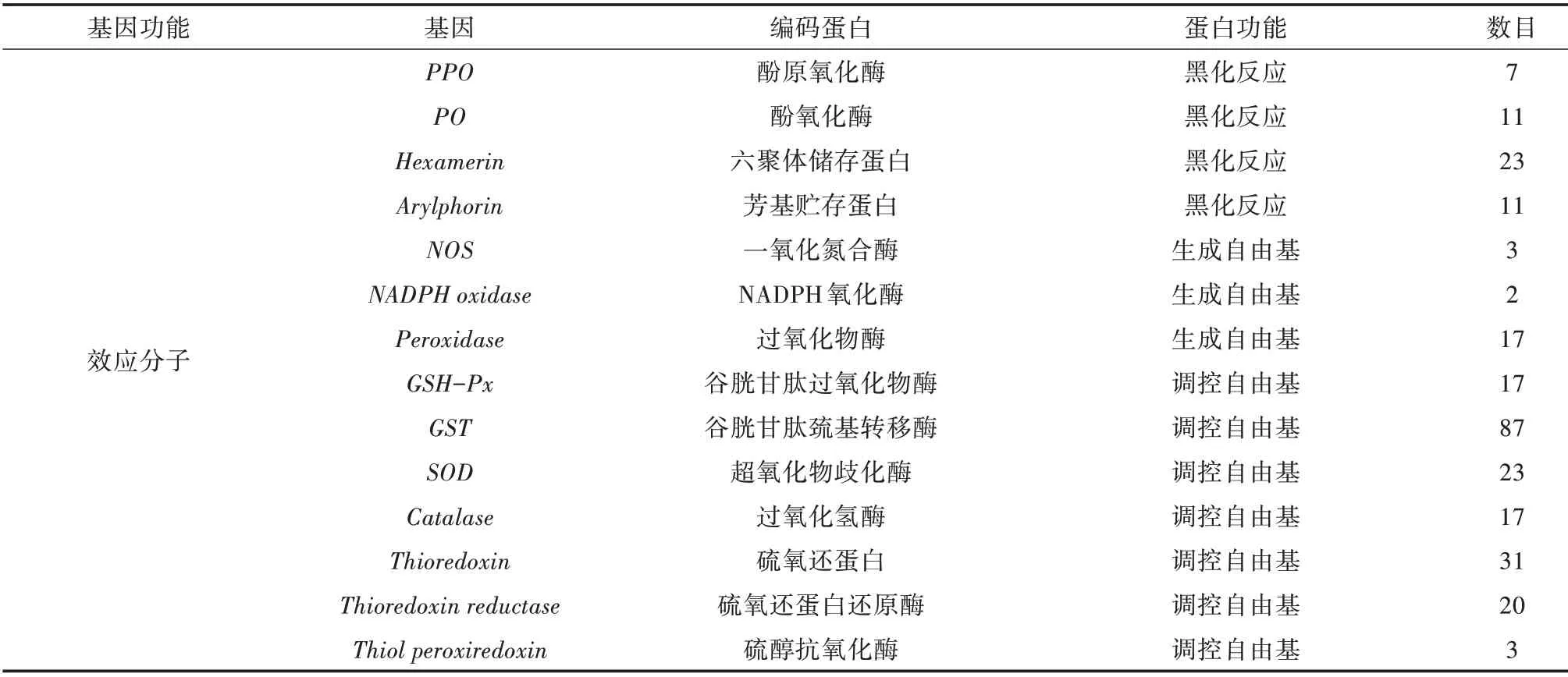
續表4
2.3 小胸鱉甲免疫信號通路
參照模式昆蟲果蠅、家蠶、赤擬谷盜和煙草夜蛾的研究結果,繪制小胸鱉甲的免疫通路(圖5),囊括了小胸鱉甲中編碼模式識別受體、免疫信號轉導及調控因子和免疫效應因子的免疫相關基因,及Toll、IMD、MAPK-JNK-p38 和JAK-STAT 免疫通路、RNAi機制、細胞自噬和細胞凋亡過程中的免疫相關基因。
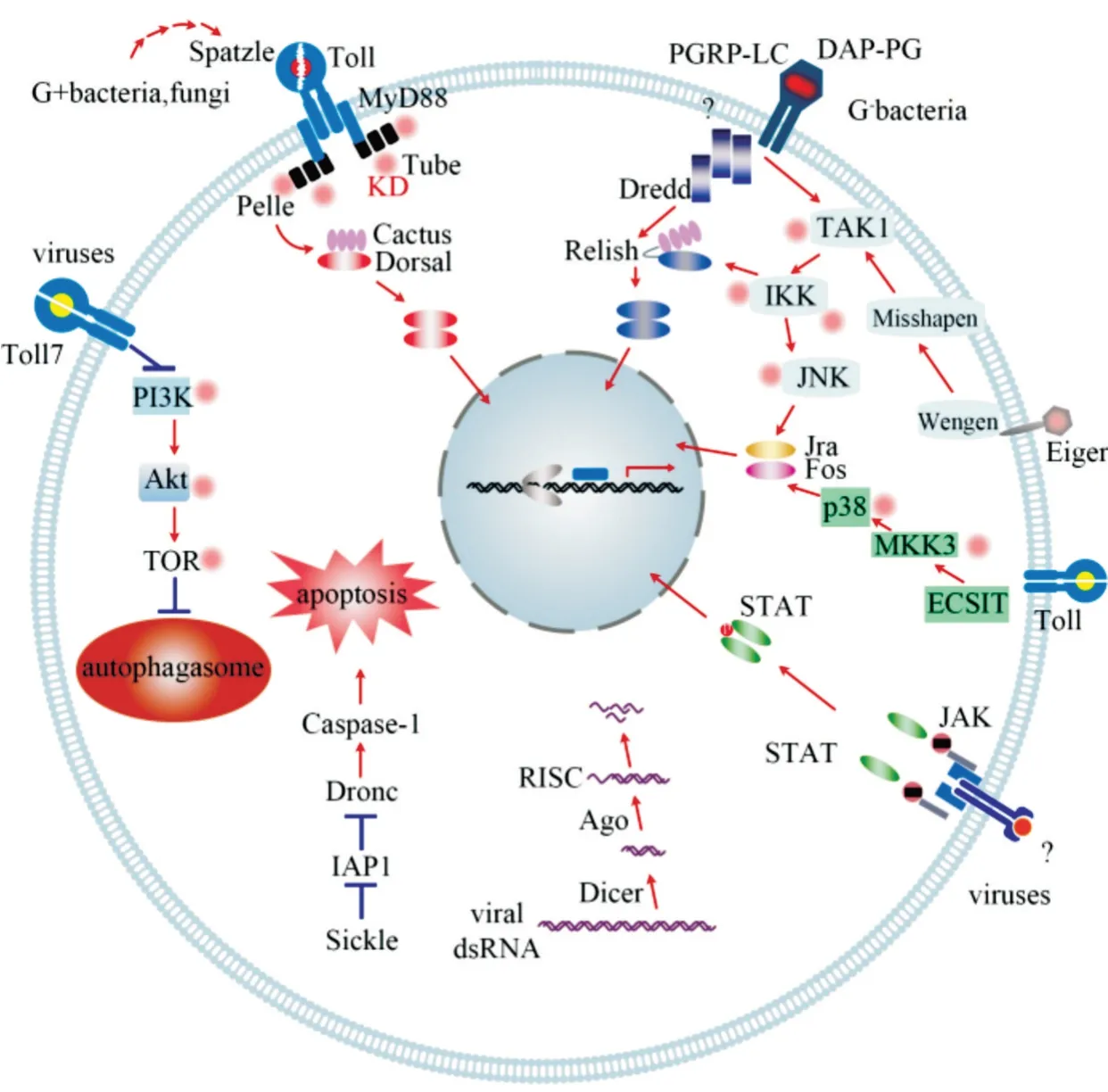
圖5 小胸鱉甲的免疫通路
3 討論
昆蟲免疫系統由各種細胞免疫和體液免疫反應組成,這些免疫成分具有多種組合形式來對抗病原體和其他有害物質[8,15]。為明確感染的分子機制,有必要對免疫反應的參與基因、蛋白質進行分析。遺憾的是,目前的研究結果仍未將昆蟲免疫相關基因做出細致的分類。本研究開展對昆蟲小胸鱉甲免疫系統的分析,為了構建小胸鱉甲免疫庫,并在其免疫系統的多種免疫反應過程中呈現蛋白質的分類,通過比對同源序列和GO 分類,結合手工篩選,共完成小胸鱉甲100 個免疫相關基因的注釋。本研究是參考其他學者研究的昆蟲免疫相關蛋白基礎上來進行蛋白質的功能注釋[8,15],包括果蠅[9,11-14,16,17]、家蠶[26]、赤擬谷盜[27]以及煙草天蛾[5,28]等昆蟲。除了直接編碼昆蟲免疫蛋白的基因外,還有其他特定的基因可以參與免疫反應,盡管有許多差異表達的調節因子與應激反應重疊而不是由免疫攻擊引起的[29],但是理論上免疫攻擊后差異調節的基因都可能具有免疫功能。因此,本研究基于序列同源性和文獻報道構建了小胸鱉甲免疫系統的信號傳導通路圖,其中,對病原體進行準確識別是引發免疫反應的基礎:PRR 識別結合入侵病原體的PAMP,它們直接或者在絲氨酸蛋白酶介導的酚氧化酶級聯反應后,觸發信號轉導系統的激活,進而激活抗微生物防御機制,如抗菌肽的表達、RNAi、自噬以及凋亡等;有些還會啟動細胞免疫反應,將入侵者吞噬,發生包囊、集結并伴隨黑化反應[15]。
昆蟲免疫系統可與環境和微生物共同進化從而達到動態平衡,在進化過程中,一些免疫相關基因為了滿足生物的生理需求變化,適應新的外界環境,會以適應、復制及丟失等形式做出應對反應[15]。目前在果蠅[9,11-14,16,17]、家蠶[26]、豌豆蚜[20]以及煙草天蛾[5,28]等不同類別的昆蟲中,已檢測出很多免疫相關基因。岡比亞按蚊(Anopheles gambiae)基因組中有335 個免疫相關基因,與埃及伊蚊(Aedes aegypti)的353 個在基因數目上相似,但研究認為,與其他基因相比,免疫相關基因具有更高的進化速率[30]。從基因的個數、基因家族方面進行比較,岡比亞按蚊與果蠅的基因組也十分相似,僅在抗菌肽基因家族中存在差異[31]。對比5 種昆蟲的基因組[32],家蠶具有218 個免疫相關基因,與果蠅、赤擬谷盜數目相似,與意蜂的139 個免疫相關基因數目則具有較大的差異。另外,意蜂的免疫相關基因數量與果蠅相比,僅占50%,表明意蜂的免疫機制可能與其他幾種昆蟲存在較大差異[19,32]。類似的,將小胸鱉甲轉錄組中編碼病原體識別、信號轉導與調控以及效應蛋白的107 個免疫相關基因,與其他昆蟲進行分析比對,發現編碼模式識別受體和效應蛋白的基因在不同物種中顯示出更高水平的類群特異性[19,20,26-28,30-32],而信號傳導通路基因的進化相對保守,變異程度較低[33]。
小胸鱉甲并未開展全基因組測序研究,故轉錄組數據De novo 組裝獲得的246 648 個unigene 中,難免會有冗余現象。同時,多數屬于未注釋完成、功能模糊的unigene,許多基因可能分布于基因組內,但因為裝配或注釋錯誤導致未精準識別[34]。所以本研究初步建立的小胸鱉甲免疫防御通路網絡后續還需要進行深入的驗證、補充、豐富。
3.1 模式識別受體
通過模式識別受體蛋白PRR,昆蟲能夠識別分布于病原體表面的模式分子PAMP[15,35],進而激活體液、細胞免疫來應答不同的病原體[35]。因此昆蟲識別和結合不同PAMP 的PRR,也具有不同的結構和功能[15,35]。PRR 識別并結合病原體的PAMP 后,激活Toll 等信號通路,誘導合成抗菌蛋白發揮作用,或引發酚氧化酶級聯反應,從而使分解蛋白作用活化,并伴隨著黑化反應,最終發揮清除病原體的作用,這類的PRR 包括肽聚糖識別蛋白(PGRP)[36]、β-1,3-葡聚糖識別蛋白(βGRP)[37]、革蘭氏陰性菌結合蛋白(GNBP)[3,38]、C 型凝集素(CTL)[39]和載脂蛋白(ApoLp)[40]等。有些PRR 可啟動細胞免疫反應,通過合成和分泌一系列炎癥細胞因子和趨化因子,促進病原體與血細胞結合形成集結或包囊,并調節細胞吞噬入侵者,如CTL、ApoLp、半乳糖凝集素(galectin)[41]、含硫酯鍵蛋白(TEP)[42]、Nimrod 超級家族[43]和唐氏綜合癥細胞黏附分子(Dscam)[44]、清道夫受體(SR 和Croquemort)[45]、整聯蛋白(Integrin)[46]和卵黃蛋白原(vitellogenin)[47]等。在昆蟲的PRR 中,纖維蛋白原相關蛋白(FREP)還可參與細胞-細胞相互作用,介導活性氧的釋放[48];另外,Draper 作為巨噬細胞中重要的損傷受體,也可在昆蟲損傷修復、防御病原體和細胞自噬等免疫反應中發揮重要作用[49]。
3.2 免疫信號通路
3.2.1 調制因子 小胸鱉甲轉錄組中SP、persephone和SPH(trypsin、chymotrypsin 和elastase)基因編碼的蛋白可作為調制因子,參與昆蟲病原體識別、信號中繼/調節和執行機制,在先天免疫系統中發揮重要作用[50]。昆蟲PRR 識別病原體PAMP 后激活血漿中SP 和SPH,介入2 條免疫通路,第一條,激活胞內酚氧化酶原proPO,從而得到能夠氧化酚類分子的PO,由于PO 的作用,傷口、病原體周圍會產生黑色素引發黑化反應;第二條,血淋巴中具有Clip 結構域的SP 和SPE(Sp?tzle-processing enzyme),在活化Sp?tzle 蛋白后,再與膜受體Toll 蛋白結合,激活Toll通路并促進attacin、cecropin、gloverin 等抗菌蛋白的合成[50]。另外在小胸鱉甲轉錄組中注釋到13 個serpin基因的同源unigene。serpin 超家族大部分都具有抑制絲氨酸蛋白酶(SP)的作用,可與絲氨酸蛋白酶結合形成共價復合物,確保了瞬時、集中的防御反應[51]。
3.2.2 免疫信號通路及其調控
1)Toll 通路及其調控。小胸鱉甲Toll 信號通路是保守的。PGRP、GNBP 將病原體識別出來的過程中會同步向Persephone 等絲氨酸蛋白酶傳送信號,通過蛋白酶水解級聯使胞外因子Sp?tzle 活化,并使其結合Toll 跨膜受體,從而促進Toll 受體胞內域招募聚集3 種胞漿蛋白(Myd88、Tube 和Pelle),Pelle激酶促使抑制因子Cactus 發生磷酸化和蛋白水解然后釋放NF-κB 轉錄因子Dorsal,Dorsal 從細胞質中轉運到細胞核中,并結合抗菌肽基因的啟動子元件,在Cactin、Pellino 和Traf 等調控作用下誘導抗菌肽 drosomycin、defensin、cecropin、attacin 的 表達[5,8,10,12,15]。多數病毒、革蘭氏陽性菌、真菌以及瘧原蟲均能夠激活Toll 信號通路[3,10],而微生物不再入侵昆蟲時,Serpin 抑制劑則能夠發揮抑制作用,阻止Toll通路的持續激活[10,12,15]。
昆蟲Toll 蛋白具有介導先天性免疫、表達抗菌肽、調控生長發育及形態發生等多種功能[12,52]。果蠅中已完成9 個Toll基因(Toll1 至Toll9)的鑒定,本研究中小胸鱉甲檢測到67 個Toll基因的同源unigene,但未檢測到全部種類的Toll基因,且尚不清楚每個Toll 蛋白在小胸鱉甲中的作用。小胸鱉甲中具有編碼Dorsal 的基因同源unigene,但未發現Dif 的同源unigene,可能是Dif 屬于高度衍生的分支,僅在短尾蒼蠅(Brachyceran flies)中發現[19]。因此,Dorsal 是小胸鱉甲發生Toll 介導的免疫反應時,誘導抗菌肽所需的獨特轉錄因子。
2)IMD -JNK 通路及其調控。IMD 信號通路可有效抵御革蘭氏陰性菌的侵染[3,5,8,10,15],但小胸鱉甲缺少IMD、kenny以及FADD這3 個IMD 信號通路中的關鍵基因。從圖3 可知,小胸鱉甲免疫系統中,G-菌體表附著的肽聚糖可以結合細胞跨膜受體PGRP,從而使PGRP 胞內域招募Dredd,完成胞內信號轉導,在TAK1/TAB2 復合物的作用下IκB 激酶IRD5(IκBγ)磷酸化,促使NF-κB 轉錄因子Relish 蛋白斷裂,其中Relish-N 經核轉運因子NTF2(nuclear transport factor 2)的輔助,轉位入細胞核,與Akirin共同調控cecropin,attacin,diptericin和drosocin等抗菌肽基因的表達[5,8,10,14,15]。IMD 信號通路也分支到JNK 通路和細胞凋亡:蛋白酶Dredd 不僅可以介入裂解Relish,還可以招募、裂解pro-caspase,形成的caspase 同時能夠加快細胞凋亡進程;在hemipterous(MAPKK7)作用下,TAK1/TAB2 復合物還能夠完成JNK 磷酸化,從而激活JNK 通路[5,8,10,14,15]。
相較小胸鱉甲缺失組分的IMD 通路,在果蠅、家蠶、伊蚊以及赤擬谷盜等昆蟲中均已找到IMD 通路基因的直向同源物[5,8,10,14,15,32]。然而蜱螨(Tetranychus、Metaseiulus以及Ixodes)、木蟻(Camponotus floridanus)、豌豆蚜還有麗蠅蛹集金小蜂(Nasonia vitripennis)則類似于小胸鱉甲,缺失IMD 信號通路上的關鍵基因[15]。有研究表明,IMD 通路中的基因被敲除后會使果蠅對某些G+菌和真菌更加敏感從而導致死亡[53],揭示IMD 通路介導的組織損傷反應是防御微生物的重要過程。而小胸鱉甲IMD 通路核心組分的缺失現象,是否反映了小胸鱉甲抵御病原體的免疫潛力較低,或者是否存在未知因子參與構建IMD 通路,還有待深入研究。
在小胸鱉甲轉錄組中注釋到9 個Sickie、115 個CYLD 以及25 個Cullin 同源unigene,它們表達的蛋白是IMD 通路的負調控因子。Sickie 對Dredd 誘導的Relish 活化具有相反的作用;去泛素化酶CYLD調節IKK 復合物以控制Relish 磷酸化,可抑制IMD信號傳導;Cullin 蛋白參與調控Relish-N 的磷酸化[5,8,14,15]。IMD 通路釋放過量的抗菌肽,對宿主本身并無益處。所以,精準的負調控機制才能保證IMD 途徑可以在合理范圍內反應。
3)MAPK-JNK-p38 通路及其調控。從實質上來看,JNK 信號是有絲分裂激活的蛋白激酶MAPK通路,參與調節昆蟲的發育和代謝、免疫反應等[15-17]。小胸鱉甲具有JNK 通路的核心免疫相關基因Hep、JNK(basket)、Jra 和Fos[15],該通路以保守的狀態進化。
JNK 信號通路由一系列胞外因子和胞內的應激物誘導激活,可通過多條分支接收傳導信號:①JNK可 由IMD通路的TAK1 激酶(即MAPKKK7)激活[5,14,15];②可由混合連接激酶MLK1(MAPKKK 激酶)激活[5,15];③由MKK4(MAPKK 激酶)激活[5,15];④由血小板衍生和血管內皮生長因子(PVF)及其受體PVR(Ser/Thr 激酶)介導激活[5];⑤由腫瘤壞死因子同源物Eiger(egr/TNF)、受體Wengen(wgn/TNFR)、TRAF(TNF receptor associated factor)和Misshapen 途徑依次激活TAK1、hemipterous(MKK7)和JNK[5,17];⑥通過Toll 受體與TRAF 激活p38 激酶,級聯誘導Jra-Fos 復合物的形成(JNK 通路下游基因[5,17])。
JNK 收到多條上游分支傳導的激活信號后,會誘導Jra-Fos 復合物即轉錄激活因子AP-1(Activator protein 1)的形成。該轉錄因子能夠結合多種基因啟動子區的AP-1 位點,促進特定基因的轉錄,從而表達靶蛋白參與到應激、傷口愈合、凋亡、炎癥反應以及細胞免疫反應中[8,10,54]。
4)JAK-STAT 通路及其調控。小胸鱉甲轉錄組注釋到編碼JAK-STAT 通路核心組分JAK 和STAT的基因同源unigene,然而,跨膜受體Domeless 以及激活果蠅JAK-STAT 通路的關鍵配體細胞因子Unpaired(Upd1、Upd2 和Upd3)還沒有檢測到[8,13]。JAK 激酶(Hopscotch)接收信號后,使轉錄因子STAT磷酸化,磷酸化的STAT 以二聚體的形式進入細胞核,誘導表達含硫酯蛋白(TEP)為代表的抗病毒蛋白等效應物[42]。小胸鱉甲轉錄組具有調控基因SOCS和PIAS的多條unigene,其編碼的SOCS(JAK抑制劑)和PIAS(活化STAT 的蛋白抑制劑)蛋白,可以調控JAK-STAT 信號通路,進而參與調節小胸鱉甲的免疫應答及多種發育過程,包括抗病毒免疫反應[3,10,13,18]。
昆蟲JAK-STAT 信號通路高度保守,但小胸鱉甲未注釋到Domeless 和Upd,考慮可能是遺漏或者存在其他未知的跨膜受體和配體,如煙草天蛾除了domeless 之外,還存在未知跨膜受體可以與Vago 的直系同源物結合,以類似于domeless 配體的方式激活JAK 和STAT[5]。同時還發現,赤擬谷盜、意蜂和煙草天蛾等昆蟲也缺失Upd 配體[5,19,27]。
5)RNAi 途徑。參與調節免疫應答的RNAi 包括piRNA、miRNA 和siRNA,RNAi 利用siRNA 的反義鏈切割靶mRNA 引發轉錄后基因沉默,在昆蟲防御病毒感染機制中發揮重要作用[10,18,55]。小胸鱉甲轉錄組中具有編碼siRNA 通路核心組分Dicer-2 和Argonaute-2 的基因同源unigene,以及編碼miRNA和piRNA 的核心組分Argonaute-1 和Argonaute-3 的基因同源unigene,這些小RNA 可參與構成RNA 誘導沉默復合體,在小胸鱉甲抗病毒反應中發揮作用[56]。
6)自噬和凋亡過程。細胞自噬和細胞凋亡過程在昆蟲機體適應環境變化的細胞應激反應、維持細胞穩態和新陳代謝、組織損傷反應和抗病毒感染機制等許多方面具有重要意義[57,58]。小胸鱉甲中自噬相關蛋白Atg,可以調控自噬過程。昆蟲在自噬發生過程中受到磷脂酰肌醇3 激酶(PI3K)/絲/蘇氨酸激酶(Akt)通路調控,該途徑中PI3K 能夠磷酸化底物并激活下游的Akt,Akt 進一步磷酸化雷帕霉素靶蛋白(TOR),TOR 通過磷酸化使形成的自噬調節復合物Atg13-ULK1 失活,影響自噬小體的生物發生,進而抑制自噬[57]。在小胸鱉甲轉錄組中注釋到DNA 損傷自噬調整蛋白(DRAM),其參與自噬體與各種囊泡的融合過程,能夠促進自噬體的積累并且調控自噬溶酶體的形成[57]。一些病原體可以靶向自噬體,然后被溶酶體降解[57]。在果蠅中,自噬被一些病毒、細胞內細菌(例如單核細胞增生李斯特氏菌)和其他病原體感染誘導[18,59],表明自噬也可能是一種經典的細胞免疫反應。
入侵昆蟲細胞的病毒,可通過觸發細胞外或細胞內的信號,激活一系列半胱氨酸蛋白酶caspase 引發一種主動的細胞凋亡,用以抑制入侵的病毒的擴散和復制[58]。小胸鱉甲具有凋亡途徑的組分caspase Dronc、IAP、Sickle(與Reaper 顯著相似)和Hid,可分別從內部和外部觸發細胞凋亡,在應激反應和免疫防御機制中發揮作用[58]。在昆蟲細胞內部,細胞凋亡的級聯反應受到啟動因子caspase Dronc 和caspase 的負調節因子(IAP)的共同調控,同時,促凋亡蛋白Sickle,即IAP 拮抗劑,也能通過使IAP 失活參與調控凋亡過程[60]。而在細胞外部引發的凋亡信號是通過JNK 通路來傳導的。IMD 通路、toll 通路以及細胞膜錨定外部蛋白Eiger 都可以通過激活JNK 信號通路,誘導細胞凋亡。Eiger 誘導的細胞凋亡也受到IAP 抑制[58]。雖然凋亡通常涉及病毒致病,但某些病毒已學會利用該機制,在長期進化過程中獲得了各種抗凋亡的基因,以不同的方式促進自身的生存和復制[61]。
3.3 免疫效應因子
1)抗菌肽。昆蟲的免疫防御體系主要由多種抗菌肽發揮作用,已知的昆蟲抗菌肽就有170 余種。在小胸鱉甲轉錄組數據中搜索昆蟲抗菌肽的基因,檢測到7 個drosomycin、4 個defensin、5 個attacin、3 個tenecin、2 個holotricin、1 個cecropin以及1 個anionic antimicrobial peptide基因同源unigene。由于物種特異性抗菌肽的存在,且這些分子的序列具備多樣性特點,基于同源性的搜索可能遺漏了一些抗菌肽基因。防御素(Defensin)可抵御革蘭氏陽性菌,攻擊素(Attacin)與天蠶素(Cecropin)可抑制革蘭氏陰性菌,而抗真菌肽(Drosomycin)具有較高的抗真菌活性[4,8,10,62],這些抗菌肽是組成小胸鱉甲免疫防御體系的重要成員。
2)溶菌酶與幾丁質酶。小胸鱉甲轉錄組注釋到c 型、i 型以及p 型lysozyme基因的同源unigene。Lysozyme 蛋白能夠降解細菌細胞壁肽聚糖和胞壁酸[63],是抵抗細菌感染的關鍵因素。在小胸鱉甲的幾丁質酶中,編碼酸性哺乳動物幾丁質酶(Acidic mammalian chitinase)基因的同源unigene 比較多,這類Chitinase 蛋白具有降解幾丁質活性,可參與對抗線蟲、真菌和其他病原體的防御,在免疫反應和炎癥反應中發揮作用[64]。
3)熱休克蛋白與肌動蛋白。小胸鱉甲轉錄組中具有多種不同分子量的Hsp和actin基因的同源unigene(表4)。已知HSP 是應激蛋白,因此病原體的侵染也能誘導HSP 的合成,在許多昆蟲中,已顯示HSP 在感染性損傷和微生物入侵后被上調表達[65]。在免疫反應中,HSP 也可作為重要的信號蛋白[65]。家蠶組學研究發現抗性添毒個體中actin 和HSP 呈現高表達,由于actin 的過表達能夠干擾病毒多角體合成和組裝[66],因此推測actin 和HSP 都參與家蠶抗病毒過程。小胸鱉甲表達的actin 和HSP 蛋白是否有助于抵御病毒也值得進一步研究。
4)其他免疫反應效應蛋白。小胸鱉甲注釋到酚氧化酶(PO)、酚氧化酶原(proPO)、芳基貯存蛋白(Arylphorin)和六聚體儲存蛋白(Hexamerin)的基因同源unigene,這些基因編碼的蛋白都可參與細胞吞噬、集結、包囊和黑化作用,在昆蟲的先天免疫系統中發揮著重要作用[67,68]。已有研究發現PO 和多巴脫羧酶(Dopa decarboxylase,Ddc)參與果蠅血細胞的集結[6,68]。PO 與hexamerin、arylphorin 都屬于節肢動物血藍蛋白hemocyanin 超家族,在昆蟲免疫防御中,有些血藍蛋白表現出酚氧化酶催化活性,甚至可以轉化為酚氧化酶,hemocyanin 和hexamerin 均已證實與節肢動物的免疫功能相關[69]。集結、包囊以及黑化作用可將小胸鱉甲免疫反應定位到損傷部位以迅速清除病原物和受損細胞[2,6,68]。
細胞免疫反應過程中,局部產生自由基也是非常重要的免疫反應,對防御病原微生物十分有效[2,6,8]。自由基以及自由氧簇(包括O2-、ROS、OH-、H2O2和RNS)均可協助血細胞吞噬病原體,并在包囊作用中殺死病原體[2,6,8]。由于ROS 和RNS的細胞毒性,它們的轉化率和濃度受機體抗氧化酶系統的嚴格調節,從而防止昆蟲受到過剩自由基攻擊造成損傷[2,6,8]。小胸鱉甲注釋到的抗氧化酶包括:過氧化物酶(peroxidase,POD)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)、過氧化氫酶(catalase,CAT)、硫醇抗氧化酶(thiol peroxiredoxin,TP)、谷胱甘肽硫轉移酶(glutathione S-transferase,GST)、硫氧還蛋白(thioredoxin)、硫氧還蛋白還原酶(thioredoxin reductase)、一氧化氮合酶(nitric oxide synthase,NOS)以 及NADPH 氧 化 酶(NADPH oxidase)。在小胸鱉甲氧化應激反應和免疫防御反應中,上述成分可發揮重要的作用[2,6,8]。有報道稱,基因突變或基因敲除引起的自由基水平的變化,對按蚊的繁殖力及其抗瘧疾反應均有較大影響[70]。
綜上所述,小胸鱉甲轉錄組中有1 750 個免疫相關基因的同源unigene,共107 個編碼免疫相關蛋白的基因,表達的蛋白可以參與到toll、IMD、MAPKJNK-p38、JAK-STAT 免疫信號通路中,以及RNAi、自噬、凋亡以及吞噬、包囊和黑化反應。本研究構建的小胸鱉甲免疫信號網絡中,一些免疫通路(IMD 通路和JAK-STAT 通路)和一些組分(如IMD、FADD 和domeless 等)與模式生物之間存在差異。下一步還需要使用生物化學、分子生物學和細胞生物學方法驗證本研究基于轉錄組數據構建的免疫信號通路。本研究對荒漠昆蟲小胸鱉甲免疫相關基因的注釋和分析,既充實了昆蟲免疫相關基因的研究內容,也加深了對昆蟲天然免疫機制的認識。

