新高考化學(xué)題對平衡常數(shù)的考查
孟凡盛
化學(xué)平衡常數(shù)(K)是重要的物理量,常見的平衡常數(shù)有濃度平衡常數(shù)(Kc)、分壓平衡常數(shù)(Kp)、電離平衡常數(shù)(Ka或Kb)、水解平衡常數(shù)(Kh)等。新高考化學(xué)題對平衡常數(shù)的全面考查,能很好地評價(jià)考生“變化觀念與平衡思想”核心素養(yǎng)的發(fā)展?fàn)顩r和學(xué)業(yè)質(zhì)量。2021年新高考湖北卷在選擇題和非選擇題中對多種平衡常數(shù)進(jìn)行了全面的考查,希望能引起2022屆高考生的重視。
一、利用新穎坐標(biāo)圖像考查電離平衡常數(shù)的計(jì)算
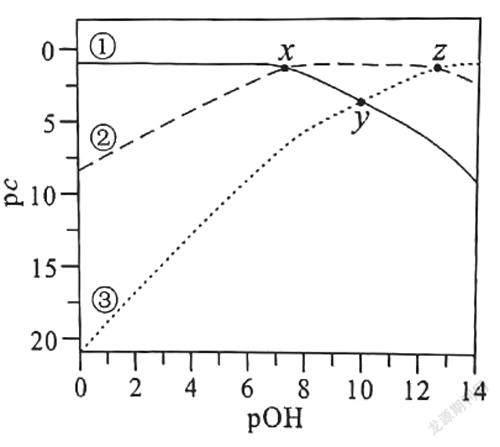
【例1】(2021年湖北卷第14題)常溫下,已知H3PO3溶液中含磷物種的濃度之和為0.1 mol/L,溶液中各含磷物種的pc-pOH關(guān)系如圖1所示。圖中pc表示各含磷物種的濃度負(fù)對數(shù)(pc=-lg c),pOH表示OH-的濃度負(fù)對數(shù)[pOH=-lg c(OH-)],x、y、z三點(diǎn)的坐標(biāo):x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列說法正確的是( )
A.曲線①表示pc(H3PO3)隨pOH的變化
B. H3PO3的結(jié)構(gòu)簡式為
C. pH=4的溶液中:c(H2PO3-)<0.1 mol/L-2c(HPO32-)
D. H3PO3+HPO32-2H2PO3-的平衡常數(shù)K>1.0×105
【解析】本題考查考生快速準(zhǔn)確獲取圖像中隱藏化學(xué)信息的能力。圖像中含磷物種只有3種,說明H3PO3為二元弱酸。隨著c(OH-)逐漸增大,pOH減小,根據(jù)H3PO3+OH-= H2PO3-+H2O、H2PO3-+OH-=HPO32-+H2O 知,c(H3PO3)逐漸減小,c(H2PO3-)先增大后減小,c(HPO32-)逐漸增大,pc=-lg c,則pc(H3PO3)逐漸增大,pc(H2PO3-)先減小后增大,pc(HPO32-)逐漸減小,故曲線③表示pc(H3PO3),曲線②表示pc(H2 PO3-),曲線①表示pc(HPO32-);x點(diǎn)的c(HPO32-)=c(H2PO3-),pOH=7.3,pH=14-7.3= 6.7,c(H+)=10-6.7mol/L,則H3PO3的Ka2== c(H+)=10-6.7;z點(diǎn)的c(H3PO3)=c(H2PO3-),pOH=12.6,pH=14-12.6=1.4,c(H+)=10-1.4mol/L,則H3PO3的Ka1== c(H+)=10-1.4。
隨著c(OH-)逐漸增大,c(H3PO3)逐漸減小,因此曲線③表示pc(H3PO3)隨pOH的變化,故A錯(cuò)誤。H3PO3是二元酸,結(jié)構(gòu)中含有兩個(gè)羥基:,故B錯(cuò)誤。pH=4時(shí)溶液的pOH=10,此時(shí)c(HPO32-)=c(H3PO3),根據(jù)題干中“H3PO3溶液中含磷物種的濃度之和為0.1 mol/L”可得c(H2PO3-)+c(HPO32-)+c(H3PO3)=0.1 mol/L,整理這兩個(gè)等式得到c(H2PO3-)=0.1 mol/L-2c(HPO32-),故C錯(cuò)誤。將H3PO3的第一步電離方程式減去第二步電離方程式得到H3PO3+HPO32-2H2PO3-,則平衡常數(shù)K===105.3>1×105,故D正確。
【答案】D
二、利用多重平衡規(guī)則探究難溶電解質(zhì)能否溶解
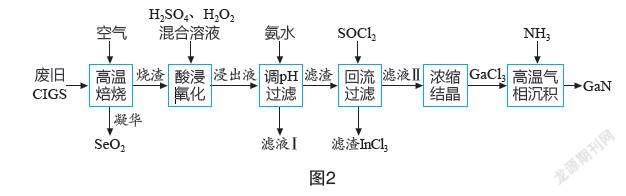
【例2】(2021年湖北卷第16題)廢舊太陽能電池CIGS具有較高的回收利用價(jià)值,其主要組成物質(zhì)為CuIn0.5Ga0.5Se2。某探究小組回收處理流程如圖2所示,回答下列問題:
(1)硒(Se)與硫?yàn)橥逶兀琒e的最外層電子數(shù)為? ? ?? ?;鎵(Ga)和銦(In)位于元素周期表ⅢA族,CuIn0.5Ga0.5Se2中Cu的化合價(jià)為? ? ? ?。
(2)“酸浸氧化”發(fā)生的主要氧化還原反應(yīng)的化學(xué)方程式為? ? ? 。
(3)25℃時(shí),已知Kb(NH3·H2O)≈2.0×10-5,Ksp[Ga(OH)3]≈ 1.0×10-35,Ksp[In(OH)3]≈1.0×10-33,Ksp[Cu(OH)2]≈1.0×10-20,“浸出液”中c(Cu2+)=0.01 mol·L-1。當(dāng)金屬陽離子濃度小于1.0×10-5mol·L-1時(shí)沉淀完全,In3+恰好完全沉淀時(shí)溶液的pH約為? ? ? ?(保留一位小數(shù));若繼續(xù)加入6.0 mol·L-1氨水至過量,觀察到的實(shí)驗(yàn)現(xiàn)象是先有藍(lán)色沉淀,然后? ? ? ? ;為探究Ga(OH)3在氨水中能否溶解,計(jì)算反應(yīng)Ga(OH)3+NH3·H2O[Ga(OH)4]-+NH4+的平衡常數(shù)K=? ? ? ? 。(已知:Ga3++4OH-[Ga(OH)4]- K′=≈1.0×1034)
(4)“濾渣”與SOCl2混合前需要洗滌、干燥,檢驗(yàn)濾渣中SO42-是否洗凈的試劑是? ? ? ? ;“回流過濾”中SOCl2的作用是將氫氧化物轉(zhuǎn)化為氯化物和? ? ? ? 。
(5)“高溫氣相沉積”過程中發(fā)生的化學(xué)反應(yīng)方程式為? ? ? ? 。
【解析】(1)硒(Se)與硫同為ⅥA族元素,最外層有6個(gè)電子,在該化合物中Se為-2價(jià);Ga和In為ⅢA族元素,在化合物中為+3價(jià),根據(jù)化合物中正負(fù)化合價(jià)代數(shù)和為0,設(shè)CuIn0.5Ga0.5Se2中Cu的化合價(jià)為x,則x+3×0.5+3×0.5-2×2=0,解得x=+1。
(2)CuIn0.5Ga0.5Se2與空氣高溫焙燒時(shí)生成更穩(wěn)定的Cu2O(高溫時(shí)氧化銅會分解為氧化亞銅),故酸浸氧化時(shí)發(fā)生的主要氧化還原反應(yīng)為:Cu2O+H2O2+2H2SO4=2CuSO4+3H2O
(3)當(dāng)In3+恰好完全沉淀時(shí),即c(In3+)=1×10-5mol/L,根據(jù)Ksp[In(OH)3],計(jì)算得c(OH-)=mol/L=1×
mol/L,c(H+)=≈1×10-4.7mol/L,pH=4.7;繼續(xù)加入6 mol/L的氨水與Cu2+反應(yīng),先生成Cu(OH)2藍(lán)色沉淀,氨水過量,Cu(OH)2藍(lán)色沉淀溶解生成深藍(lán)色的[Cu(NH3)4]2+。
反應(yīng)①? ? Ga(OH)3Ga3++3OH- Ksp[Ga(OH)3]
反應(yīng)②? ? NH3·H2ONH4++OH- Kb(NH3·H2O)
反應(yīng)③? ? Ga3++4OH-[Ga(OH)4]- K′
“①+②+③”得到目標(biāo)反應(yīng):Ga(OH)3+NH3·H2O [Ga(OH)4]-+NH4+,根據(jù)多重平衡規(guī)則,目標(biāo)反應(yīng)的平衡常數(shù)K=Ksp[Ga(OH)3]×Kb(NH3·H2O)×K′=2.0×10-6。
(4)檢驗(yàn)濾渣中的SO42-是否洗凈,可加入鹽酸和BaCl2溶液;得到的濾渣是In(OH)3和Ga(OH)3的混合物,加入SOCl2后它們分別轉(zhuǎn)化為難溶的InCl3和易溶的GaCl3,難溶的InCl3作為濾渣被分離,易溶的GaCl3留在濾液中,所以SOCl2的另一作用為溶解GaCl3利于與InCl3分離(或作溶劑)。
(5)高溫氣相沉積時(shí)GaCl3和NH3反應(yīng)生成GaN和HCl,化學(xué)方程式為GaCl3+NH3GaN+3HCl。
【答案】(1)6 +1 (2)Cu2O+H2O2+2H2SO4=2CuSO4+ 3H2O (3)4.7 藍(lán)色沉淀溶解,溶液變?yōu)樯钏{(lán)色 2.0×10-6 (4)鹽酸和氯化鋇溶液 作溶劑(或溶解GaCl3,利于與InCl3分離) (5)GaCl3+NH3GaN+3HCl
【提醒】多重平衡規(guī)則是指如果某一可逆反應(yīng)可以由幾個(gè)可逆反應(yīng)相加(或相減)得到,則該可逆反應(yīng)的平衡常數(shù)等于幾個(gè)可逆反應(yīng)的平衡常數(shù)的乘積(或商),同學(xué)們在復(fù)習(xí)時(shí)要熟練掌握利用多重平衡規(guī)則計(jì)算可逆反應(yīng)的平衡常數(shù)。
三、利用科研探索情景考查分壓平衡常數(shù)的計(jì)算
【例3】(2021年湖北卷第19題)丙烯是一種重要的化工原料,可以在催化劑作用下由丙烷直接脫氫或氧化脫氫制備。
反應(yīng)Ⅰ(直接脫氫):C3H8(g)=C3H6(g)+H2(g) ΔH1= +125 kJ·mol-1
反應(yīng)Ⅱ(氧化脫氫):C3H8(g)+O2(g)=C3H6(g)+ H2O(g) ΔH2=-118 kJ·mol-1
(1)已知鍵能:E(C—H)=416 kJ·mol-1,E(H—H)= 436 kJ·mol-1,由此計(jì)算生成1 mol碳碳π鍵放出的能量為
kJ。
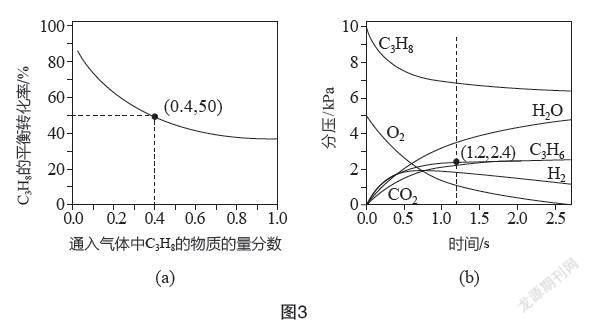
(2)對于反應(yīng)Ⅰ,總壓恒定為100 kPa,在密閉容器中通入C3H8和N2的混合氣體(N2不參與反應(yīng)),從平衡移動(dòng)的角度判斷,達(dá)到平衡后通入N2的作用是? ? ? ? ? ? ?;在溫度為T1時(shí),C3H8的平衡常數(shù)Kp=? ? ? ? ? ? ?kPa(以分壓表示,分壓=總壓×物質(zhì)的量分?jǐn)?shù),保留一位小數(shù))。
(3)在溫度為T2時(shí),通入氣體分壓比為p(C3H8)∶p(O2)∶p(N2)=10∶5∶85的混合氣體,各組分氣體的分壓隨時(shí)間的變化關(guān)系如圖3(b)所示。0~1.2 s生成C3H6的平均速率為? ? ? ? ? ? ?kPa·s-1;在反應(yīng)一段時(shí)間后,C3H8和O2的消耗速率比小于2∶1的原因是? ? ? ? ? ? ?。
(4)恒溫剛性密閉容器中通入氣體分壓比為p(C3H8)∶p(O2)∶p(N2)=2∶13∶85的混合氣體,已知某反應(yīng)條件下只能發(fā)生如下反應(yīng)(k,k′為速率常數(shù))。
反應(yīng)Ⅲ:2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g)k
反應(yīng)Ⅳ:2C3H6(g)+9O2(g)=6CO2(g)+6H2O(g) k′
實(shí)驗(yàn)測得丙烯的凈生成速率方程為v(C3H6)=kp(C3H8)- k′p(C3H6),可推測丙烯的濃度隨時(shí)間變化的趨勢為? ? ? ?,其理由是? ? ? ? 。
【解析】(1)由反應(yīng)Ⅰ知,反應(yīng)斷裂2mol C—H鍵,形成1 mol碳碳π鍵和1 mol H—H鍵,416 kJ·mol-1×2-E(碳碳π鍵)-436 kJ·mol-1=+125 kJ·mol-1,E(碳碳π鍵)=271 kJ·mol-1,所以形成1 mol碳碳π鍵放出的能量為271 kJ。(2)達(dá)到平衡后,通入N2,由于總壓恒定為100 kPa,則容器體積增大,平衡向氣體分子數(shù)增大的正反應(yīng)方向移動(dòng),C3H8的轉(zhuǎn)化率增大;根據(jù)圖3(a),C3H8的物質(zhì)的量分?jǐn)?shù)為0.4時(shí),其平衡轉(zhuǎn)化率為50%;假設(shè)混合氣體為1 mol,則起始時(shí)C3H8為0.4 mol,N2為0.6 mol,運(yùn)用三段式法計(jì)算:
C3H8H2(g) + C3H6(g)
開始量(mol) 0.40?00
變化量(mol) 0.20 ? 0.20 0.20
平衡量(mol) 0.20 ? 0.20 0.20
由于總壓恒定為100 kPa,平衡時(shí)C3H8為0.2 mol,C3H6為0.2 mol,H2為0.2 mol,N2為0.6 mol,則C3H8(g)、C3H6(g)、H2(g)的分壓均為:100 kPa×=kPa,故T1時(shí)反應(yīng)Ⅰ的平衡常數(shù)KP==16.7 kPa。
(3)0~1.2s內(nèi)C3H6的分壓由0增大為2.4 kPa,則生成C3H6的平均速率為=2.0 kPa·s-1;若只發(fā)生反應(yīng)Ⅰ、Ⅱ,C3H6的分壓應(yīng)大于H2和H2O的分壓,但由圖3(b)知,隨著反應(yīng)進(jìn)行,分壓p(H2O)>p(C3H6)>p(H2),且有CO2生成,H2分壓降低,故體系中還發(fā)生副反應(yīng):C3H6+O2=3CO2+3H2O,H2+O2=H2O,消耗O2,因此C3H8和O2的消耗速率比小于2∶1。
(4)由“丙烯的凈生成速率方程為v(C3H6)=kp(C3H8)- k′p(C3H6)”推知,反應(yīng)Ⅲ生成丙烯的速率方程為v(C3H6)= kp(C3H8),反應(yīng)Ⅳ消耗丙烯的速率方程為v(C3H6)= k′p(C3H6),反應(yīng)開始時(shí)p(C3H8)大、p(C3H6)小,以反應(yīng)Ⅲ生成丙烯為主;隨著反應(yīng)進(jìn)行,p(C3H8)減小、p(C3H6)增大,以反應(yīng)Ⅳ消耗丙烯為主,因此丙烯的濃度隨時(shí)間的變化趨勢為先增大后減小。
【答案】(1)271 (2)使平衡向氣體分子數(shù)增大的正向移動(dòng),提高C3H8的轉(zhuǎn)化率 16.7 (3)2.0 有消耗O2的副反應(yīng)發(fā)生 (4)先增大后減小 先以反應(yīng)Ⅲ為主,后以反應(yīng)Ⅳ為主

