股骨頸骨折患者術后血清miR-133a、BMP-2水平與骨折延遲愈合的關系
蘇清君,李鵬,邊朝輝,宋廣明,馬文明
北京中醫藥大學房山醫院骨傷科,北京102400
骨折延遲愈合是骨折手術后常見并發癥,可導致患者嚴重殘疾、生活質量下降和醫療負擔加重。評估與骨折延遲愈合相關指標有助于預測骨折延遲愈合風險,為臨床制定治療策略提供依據。研究顯示,細胞因子、趨化因子、生長因子以及微小核糖核酸(miRNA)等參與了骨折愈合過程,其表達異常與骨折延遲愈合密切相關[1]。miR-133a具有調節骨代謝的作用,可通過成纖維細胞生長因子受體1-絲裂原活化蛋白激酶/細胞外調節蛋白激酶信號通路誘導糖皮質激素誘導的骨量丟失[2]。骨形態發生蛋白2(BMP-2)是一種強有力的骨誘導生長因子,可募集成骨細胞,促使成骨細胞分化,促進骨形成[3]。鑒于此,本研究擬探討miR-133a、BMP-2與股骨頸骨折延遲愈合的關系,以期為臨床診斷和治療提供參考。
1 資料與方法
1.1 資料來源 選擇2019年2月—2021年6月在我院接受手術治療的251例股骨頸骨折患者,納入標準:①X線、CT檢查提示單側股骨頸骨折;②住院接受內固定手術治療;③知情同意本研究,簽署同意書。排除標準:①既往骨折病史或骨科手術史;②退行性關節炎、滑囊炎、滑膜炎、股骨頭壞死、類風濕關節炎、骨腫瘤;③急慢性感染、免疫和血液系統疾病。根據術后是否發生骨折延遲愈合(診斷標準:骨折后≥3個月X線檢查顯示無或極少骨痂生成,斷端骨質可見硬化、間隙),將患者分為延遲組(n=30)和正常組(n=221)。兩組臨床資料比較見表1,延遲組開放性骨折、骨質疏松、糖尿病、目前吸煙、局部感染、筋膜室綜合征所占比例均高于正常組(P<0.05或<0.01)。本研究獲得我院倫理委員會審核批準。
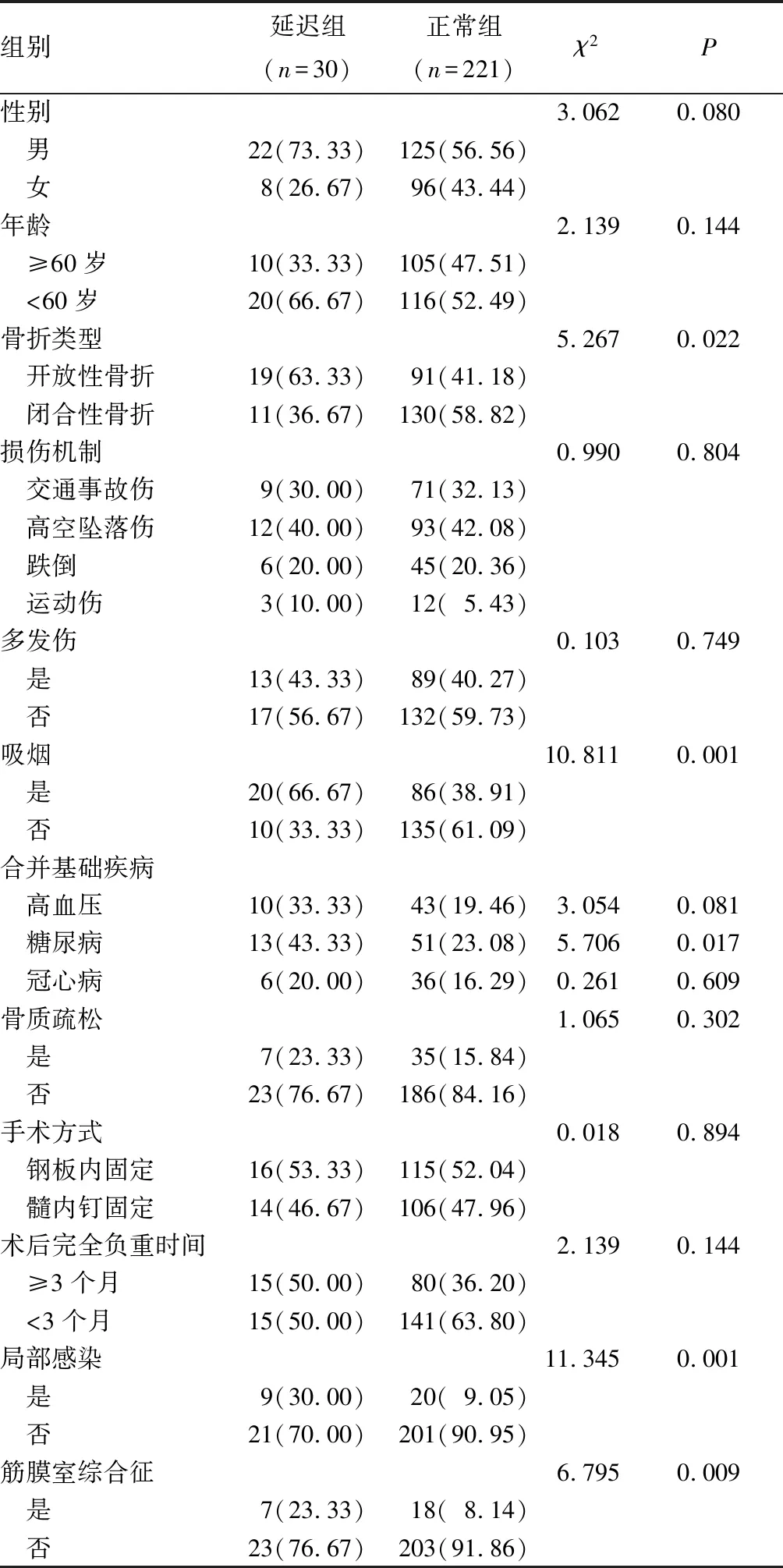
表1 兩組臨床資料比較[例(%)]
1.2 血清miR-133a、BMP檢測 于術后4周復查時,采集患者外周靜脈血3 mL,4 ℃ 3 000 r/min離心15 min(離心半徑10 cm),取上清液,-80 ℃保存。血清miR-133a檢測采用RT-PCR法。取血清樣本,使用miRNA分離試劑盒(PureLinkTM,美國賽默飛公司)提取miRNA,使用含miR-133a和U6的莖環RT引物的逆轉錄酶(SuperScriptTMⅡ,美國賽默飛公司)逆轉錄合成cDNA。PCR引物由上海基康公司完成,引物序列:miR-133a上游引物5′-GCGTTTGGTCCCCTTCAACCA-3′,下游引物5′-AGTGCAGGGTCCGAGGTATT-3′;內參U6上游引物5′-CTCGCTTCG GCAGCACA-3′,下游引物5′-AACGCTTCACGAATTTGCGT-3′。PCR反應條件:95 ℃變性10 s,65 ℃退火20 s;75 ℃延伸15 s,共40個循環,反應體系(20 μL):包含cDNA、Power SYBR Green Master Mix和擴增引物等。采用2-ΔΔCt法計算miR-133a的相對表達量。血清BMP-2檢測采用酶聯免疫吸附法,室溫下復融血清標本,使用SpectraMax iD5-多功能酶標儀(上海美谷分子儀器有限公司)檢測BMP-2,試劑盒購自武漢博士德公司。
2 結果
2.1 兩組血清miR-133a、BMP-2水平比較及二者相關性分析 延遲組血清miR-133a水平高于正常組,BMP-2水平低于正常組(P均<0.05)。見表2。延遲組血清miR-133a與BMP-2呈負相關(r=-0.418,P=0.022)。
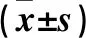
表2 兩組血清miR-133a水平、BMP-2水平比較
2.2 血清miR-133a與BMP-2對股骨頸骨折術后骨折愈合延遲的影響 高齡≥60歲、骨質疏松、血清miR-133a≥0.90、BMP-2<167.15 ng/L是骨折延遲愈合的危險因素(P<0.05)。見表3。
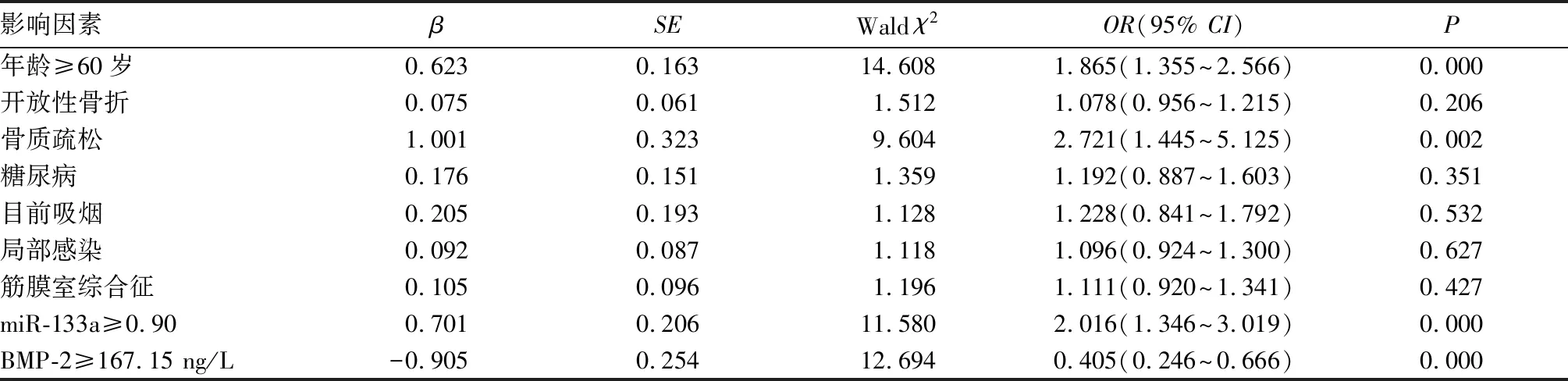
表3 影響骨折愈合延遲的Logistic回歸分析結果
2.3 血清miR-133a、BMP-2對股骨頸骨折術后骨折愈合延遲的預測效能 miR-133a、BMP-2預測股骨頸骨折術后骨折愈合延遲的截斷值為2.03、129.35 ng/L,曲線下面積分別為0.771、0.678,miR-133a聯合BMP-2預測股骨頸骨折術后骨折愈合延遲的AUC為0.915,高于單獨指標(P均<0.01),見表4。
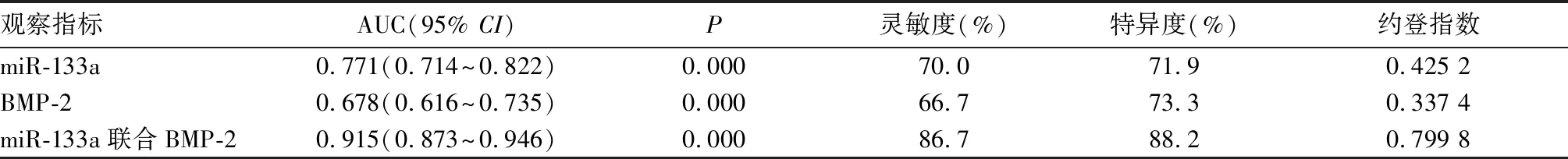
表4 miR-133a、BMP-2對股骨頸骨折術后骨折愈合延遲的預測效能
3 討論
骨折愈合是一個復雜的修復過程,主要分為炎癥反應、軟骨痂形成、硬骨痂形成和骨重塑4個階段,損傷誘導的血腫和炎癥反應驅使骨膜、骨內膜和骨髓的間充質細胞向骨折部位凝聚并向軟骨細胞和成骨細胞分化,同時成骨細胞分化增加,促使骨膜上膜內骨在骨折間隙形成堅固的骨支架,骨支架擴張橋接骨折端,礦化形成堅硬的硬骨痂,硬骨痂在破骨細胞和成骨細胞相互作用下發生骨重塑,重建正常的骨幾何形狀,實現剛性固定[4]。然而5%~10%的患者術后骨折愈合延遲或難以愈合,年齡大、糖尿病、吸煙、局部感染、營養缺乏、軟組織損傷加重、筋膜室綜合征等是骨折延遲愈合的危險因素[5]。
miRNA是內源性單鏈非編碼RNA,通過與信使RNA結合來調節多種生物過程,其中包括骨形成過程[6]。miR-133a是一種高度保守miRNA,從與miR-1相同的染色體位點轉錄而來,在心肌組織中大量表達,參與心臟疾病以及心血管疾病的發生,同時還涉及結直腸癌、肝細胞癌等多種癌癥過程[7-8]。miR-133a在骨骼肌間充質干細胞中也有豐富表達,可調控骨骼肌發育以及骨代謝過程。已有研究表明,miR-133a是骨細胞分化的負向調節因子[9]。動物實驗顯示,miR-133a在雌激素缺乏誘導的骨質疏小鼠中表達上調[10]。ANASTASILAKIS等[11]研究發現,絕經后骨質疏松患者外周循環血中miR-133a表達上調,接受抗骨質疏松治療后miR-133a表達下調。此外,MENCIA等[12]報道,局部使用含miR-133a抑制復合物的多孔膠原—納米羥基磷灰石支架可上調runt相關轉錄因子2(Runx2)表達,增強間充質干細胞介導的成骨細胞分化。本研究結果顯示,延遲組術后血清miR-133a水平增高,回歸分析結果顯示miR-133a與股骨頸骨折延遲愈合有關,miR-133a升高是骨折延遲愈合的危險因素之一,表明miR-133a升高可能抑制骨折術后骨形成過程。分析其機制包括:首先,Runx2是間充質干細胞成骨細胞分化的主要調節因子,參與成骨細胞分化過程[13],Runx2是miR-133a的直接靶標,miR-133a通過直接靶向Runx2抑制成骨分化。其次,維生素K環氧化物還原酶復合亞基1對骨鈣素γ-羧化和骨代謝具有重要作用,骨鈣素在骨礦化過程中由成骨細胞合成,骨鈣素γ-羧化可增強對鈣離子的親和力,γ-羧化失敗降低對鈣離子的親和力和骨質量,而miR-133a可直接調控維生素K環氧化物還原酶復合亞基的表達,抑制骨鈣素γ-羧化和骨形成[14],導致骨折愈合延遲。
BMP-2屬于轉化生長因子β超家族的成員,是一種骨源性骨誘導細胞因子,具有誘導成骨的能力。研究顯示,將BMP植入骨骼外軟組織后可促進間充質干細胞分化成軟骨細胞和成骨細胞,刺激骨形成,增加硬骨痂的發育和骨痂強度。除誘導骨形成外,在骨祖細胞旁分泌信號傳導下,BMP-2還可促使新生血管形成,為骨再生提供血管供應[15]。BMP-2在骨折愈合中起重要作用,軟骨細胞BMP-2的缺失可導致骨折愈合無法啟動,或軟骨愈傷組織的形成時間延長,從而影響骨折愈合過程[16]。動物實驗顯示,對去卵巢骨折小鼠給予重組人BMP-2后,可促使去卵巢小鼠骨折愈合[17]。GAO等[16]報道,骨折術后恢復良好患者的血清BMP-2水平顯著高于恢復較差患者,血清BMP-2水平可作為股骨頸骨折髖關節置換術后恢復的標志物。在骨間充質干細胞的成骨分化過程中,高水平的BMP-2可直接誘導信號轉導器Smad-1/5/9的磷酸化,促進骨組織分化和骨折愈合[18],BMP-2缺乏其骨誘導能力降低,因此骨折愈合延遲。本研究結果顯示,延遲組血清BMP-2水平低于正常組,回歸分析結果顯示BMP-2水平降低是股骨頸骨折患者術后骨折延遲愈合的危險因素,說明BMP-2缺失可能導致骨折術后骨愈合延遲。
研究顯示,miR-133a可通過靶向調控Runx2,抑制RUNX2/BMP2信號通路傳導,抑制骨形成,負向調節骨折愈合過程[8]。本研究相關性分析結果顯示miR-133a與BMP-2呈負相關,提示miR-133a、BMP-2在骨折術后骨折愈合過程中具有相互抑制作用,血清miR-133a升高可能抑制BMP-2活性,降低其骨誘導能力,導致骨折愈合延遲。ROC分析結果顯示,miR-133a聯合BMP-2可較好地預測股骨頸骨折術后骨折延遲愈合風險,說明檢測血清miR-133a、BMP-2可為臨床骨折延遲愈合預防提供有效信息,指導臨床治療。回歸分析結果顯示,高齡、骨質疏松也與骨折延遲愈合有關,提示臨床應針對高危患者進行干預,促使骨折愈合。
綜上所述,股骨頸骨折延遲愈合患者術后血清miR-133a水平升高,BMP-2水平下降,miR-133a水平升高、BMP-2水平降低是骨折延遲愈合的危險因素,miR-133a可能通過負向調控BMP-2參與骨折愈合延遲的過程;聯合檢測miR-133a和BMP-2可為骨折延遲愈合評估提供可靠信息。

