子宮內膜癌組織中GMNN、RFC4表達變化及其與患者預后的關系
章小霞,任曉燕,陶玉梅,袁明明,顧麗麗,王燕
1南通市婦幼保健院病理科,江蘇南通226006;2南通大學附屬醫院病理科
子宮內膜癌是常見的婦科惡性腫瘤,近年來,我國子宮內膜癌的發病率呈逐年上升趨勢,并逐漸年輕化。目前治療子宮內膜癌的主要方法是手術切除輔以放療和藥物治療,但大多數患者術后生存時間短,生活質量較差,且極易出現耐藥性。靶向治療的迅速發展為子宮內膜癌提供了新的治療手段,但多數靶向藥物仍處于實驗階段,尋找具有針對性的分子標志物是攻克子宮內膜癌的關鍵。Geminin基因(GMNN)是一種小分子蛋白,在多種惡性腫瘤中呈高表達,是細胞周期調控的關鍵因子[1]。RFC4是復制因子C(RFC)復合體的幾個亞基之一,作為聚合酶輔助蛋白在DNA復制和修復中起作用,RFC4失調可促進細胞增殖和腫瘤發生[2]。關于子宮內膜癌組織中GMNN、RFC4的表達情況及其與患者預后關系的研究目前罕見報道。本研究利用數據庫進行生物信息學分析,觀察子宮內膜癌組織中GMNN、RFC4 mRNA的表達變化,探討其與患者臨床病理參數及預后的關系,并利用臨床標本對分析結果進行驗證,旨在為子宮內膜癌的診斷與預后評估提供理論依據。
1 材料與方法
1.1 材料
1.1.1 生物信息學網上數據庫 UALCAN數據庫(http://ualcan.path.uab.edu/analysis.html),OncoLnc數據庫(http://www.oncolnc.org/),基因表達譜數據動態分析(GEPIA)數據庫(http://gepia.cancer-pku.cn/)。
1.1.2 組織標本來源 收集2020年在南通大學附屬醫院行手術切除的40例子宮內膜癌患者的新鮮癌組織及癌旁組織(距離腫瘤直徑2 cm),患者年齡≤55歲67例,>55歲66例;腫瘤組織分級G1級32例,G2級73例,G3級28例;腫瘤浸潤深度<1/2肌層110例,≥1/2肌層23例;FIGO病理分期Ⅰ+Ⅱ期88例,Ⅲ+Ⅳ期45例;合并淋巴結轉移35例;絕經100例;ER陽性61例,PR陽性68例,Her-2 0~2+ 109例、3+ 24例,Ki67陽性65例,p53陽性38例。另收集2013年1月1日—2016年6月30日南通大學附屬醫院病理科保存的石蠟標本,包括120例正常子宮內膜組織、100例不典型增生子宮內膜組織及133例子宮內膜癌組織。所有患者手術前未接受過抗癌治療,臨床資料及術后隨訪記錄完整。
1.2 方法
1.2.1 子宮內膜癌組織中GMNN、RFC4 mRNA和蛋白表達檢測
1.2.1.1 子宮內膜癌組織和正常子宮內膜組織的生物信息學分析 利用UALCAN數據庫獲取GMNN、RFC4 mRNA和蛋白在人子宮內膜癌組織中的表達情況。在數據庫右上角中選擇TCGA “TCGA Gene analysis”,“Enter gene symbol(s)”中輸入目的基因GMNN、RFC4,“TCGA dataset”中選擇“Uterine Corpus Endometrial Carcinoma”,然后Explore選擇“Expression”即可獲得圖片結果。GMNN、RFC4蛋白結果的獲取在右上角選擇CPTAC即可,其余步驟同上。
1.2.1.2 子宮內膜癌組織與癌旁組織的PCR分析 使用TRIzol試劑盒提取組織總RNA,逆轉錄合成cDNA。按照RT-qPCR試劑盒的操作說明進行擴增,引物序列:GMNN上游5′-AGAAAATGAGCTGTCCGCAGG-3′,下游5′-TACAGCGCCTTTCTCCGTTT-3′;RFC4上游5′-GCGGAAACCTGAGGAACGAGCC-3′,下游5′-TGGCAGCTACTCCTCGATCCTTG-3′;內參GAPDH上游5′-GAAGGTCGGAGTCAACGGAT-3′,下游5′-TCCCGTTCTCAGCCATGTAGTT-3′。PCR擴增條件:95 ℃預變性5 min;95 ℃ 30 s,60 ℃ 20 s,72 ℃ 30 s,共40個循環。采用2-ΔΔCt法計算GMNN、RFC4 mRNA的相對表達量。實驗獨立重復3次。
1.2.1.3 正常子宮內膜組織、不典型增生子宮內膜組織及子宮內膜癌組織中GMNN、RFC4蛋白表達 采用免疫組化EnVision法檢測。取組織石蠟標本,連續切片,按照試劑盒說明進行染色,染色結果由兩位資深病理診斷醫師采用雙盲法進行判斷,取來自5個高倍視野的100個細胞進行判讀并評分。GMNN、RFC4定位在細胞核,染色強度計0~3分(無著色為0分,淺黃色為1分,棕黃色為2分,棕褐色為3分),染色細胞比例計1~4分(≤10%為1分,>10%~50%為2分,>50%~80%為3分,>80%為4分),以染色強度評分與染色細胞比例相乘,>6為高表達,≤6為低表達。
1.2.2 子宮內膜癌患者預后分析
1.2.2.1 生物信息學分析 利用OncoLnc數據庫進行TCGA生存分析,觀察GMNN、RFC4 mRNA不同表達水平對子宮內膜癌患者的總生存率的影響。在數據庫中輸入目的基因GMNN、RFC4,“submit”選擇UCEC(子宮內膜癌)中的“Yes Please!”,“Lower Percentile”及“Higher Percentile”均填寫“50”(即前50%定義為低表達組,后50%定義為高表達組),低表達組和高表達組各270例,“submit”后即可獲得圖片結果。
1.2.2.2 組織標本分析 133例子宮內膜癌患者均獲隨訪,隨訪截至日期為2021年6月,記錄患者的生存情況,計算總生存率。
1.2.3 GMNN與RFC4的相關性分析
1.2.3.1 生物信息學分析 利用GEPIA數據庫分析GMNN與RFC4的相關性。在數據庫中選擇“Correlation”,Gene A及Gene B中輸入 “GMNN”與“RFC4”,“TCGA Tumor (Cancer name)”選擇“UCEC Tumor”,“Add”,“Plot”后即可得到結果。
1.2.3.2 組織標本分析 采用Spearman等級相關分析133例子宮內膜癌組織中GMNN與RFC4的相關性。
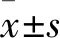
2 結果
2.1 子宮內膜癌組織中GMNN、RFC4基因表達變化 UALCAN數據庫分析結果顯示,子宮內膜癌組織(n=546)中的GMNN、RFC4 mRNA表達水平均高于正常子宮內膜組織(n=35)(P均<0.05),見圖1。本課題組RT-qPCR結果顯示,GMNN、RFC4 mRNA在子宮內膜癌組織中的表達分別為2.08±0.43、1.98±0.51,在癌旁組織中的表達分別為1.31±0.39、1.07±0.40。GMNN、RFC4 mRNA在子宮內膜癌組織中的表達水平均高于癌旁組織(P均<0.05)。
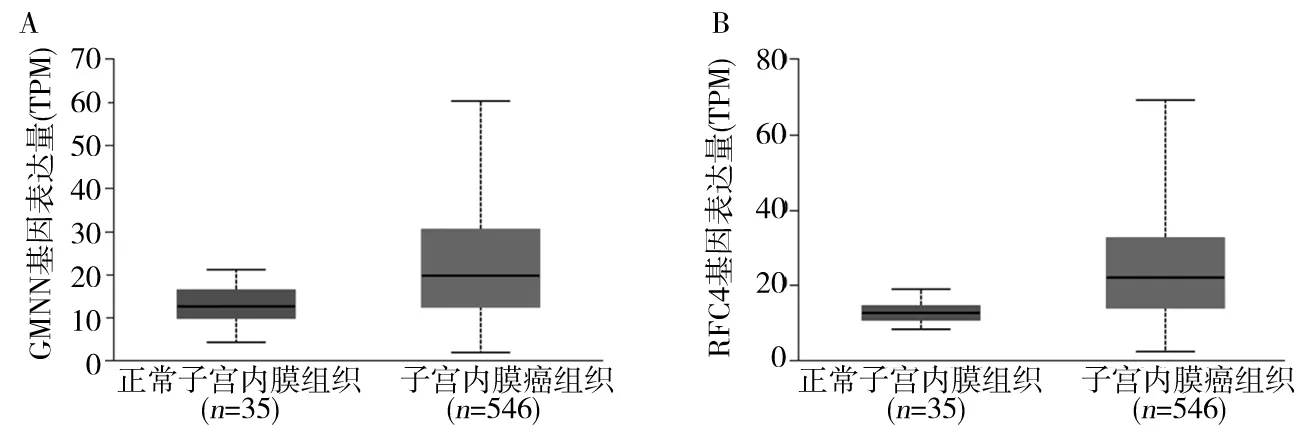
2.2 子宮內膜癌組織中GMNN、RFC4蛋白表達變化 UALCAN數據庫分析結果顯示,GMNN及RFC4蛋白在子宮內膜癌組織中(n=546)的表達高于正常子宮內膜組織(n=35)(P均<0.05),見圖2。本課題組免疫組化結果顯示,GMNN、RFC4蛋白在子宮內膜癌中的高表達率高于正常子宮內膜組織和不典型子宮內膜組織(P均<0.05)。見表1。進一步分析顯示,合并淋巴結轉移、FIGO病理分期Ⅲ+Ⅳ期、Ki67表達陽性、p53表達陽性患者的GMNN、RFC4蛋白高表達率分別高于無淋巴結轉移、FIGO病理分期Ⅰ+Ⅱ期、Ki67表達陰性、p53表達陰性患者(P均<0.05)。見表2。
注:A為GMNN mRNA在子宮內膜癌組織與正常子宮內膜組織中的表達比較;B為RFC4 mRNA在子宮內膜癌組織與正常子宮內膜組織中的表達比較。
注:A為GMNN蛋白在子宮內膜癌組織與正常子宮內膜組織中的表達比較;B為RFC4蛋白在子宮內膜癌組織與正常子宮內膜組織中的表達比較。
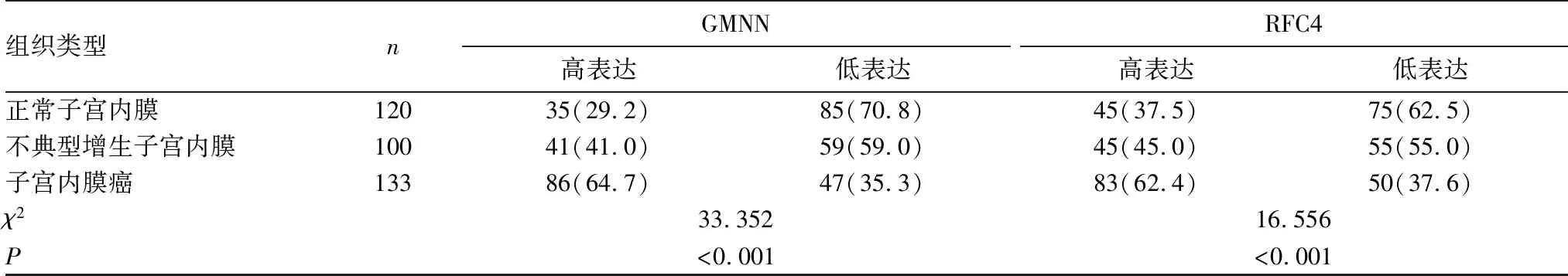
表1 正常子宮內膜、不典型子宮內膜及子宮內膜癌組織中GMNN、RFC4蛋白表達比較[例(%)]
2.3 子宮內膜癌組織中GMNN、RFC4表達對預后的影響 OncoLnc數據庫分析結果顯示,GMNN及RFC4 mRNA高表達患者的總生存率較低表達患者降低(P均<0.05),見圖3。本課題組中,GMNN、RFC4蛋白高表達患者的總生存率分別為43.0%、43.4%,低表達患者的總生存率分別為89.4%、86.0%。GMNN、RFC4蛋白高表達患者的總生存率低于低表達患者(P均<0.05)。Cox回歸分析顯示,GMNN高表達、RFC4高表達、淋巴結轉移、FIGO病理分期Ⅲ+Ⅳ期、Ki-67陽性是子宮內膜癌患者預后的獨立影響因素(P均<0.05)。見表3。
2.4 子宮內膜癌組織中GMNN、RFC4表達的相關性 GEPIA數據庫分析結果顯示,子宮內膜癌組織中GMNN與RFC4 MRNA表達呈正相關(r=0.58,P<0.01)。本課題組中,子宮內膜癌組織中GMNN與RFC4蛋白表達呈正相關(rs=0.303,P<0.01)。
3 討論
正常內膜、不典型增生內膜、內膜癌三者之間是疾病進展的一個過程。正常子宮內膜在長期持續的激素或炎癥刺激影響下,子宮內膜會出現細胞異形性,即不典型增生,若不及時治療,進一步發展就會成為子宮內膜癌。子宮內膜不典型增生是子宮內膜癌的癌前病變,約1/3左右會發展為內膜癌。子宮內膜癌預后不佳,僅依賴常規化療或臨床手術無法解決子宮內膜癌患者尤其是晚期患者的高病死率。雖然目前免疫療法、RNA療法等多種療法聯合為其治療提供了一種有前景的臨床策略,但能夠有效治療子宮內膜癌的靶向藥物目前并不多見。GMNN一種多功能蛋白質,可抑制細胞增殖S期的DNA復制,防止基因組不穩定性,并防止化學誘導的致癌作用。GMNN通過控制細胞周期內DNA復制的重新啟動來維持基因組保真度[3],并可調節HBO1影響的DNA復制[2],其復制起始因子Cdt1表達水平的不平衡可導致DNA復制缺陷從而導致癌癥的發生[4-5]。GMNN在胃癌、腸癌、乳腺癌、肺癌等多種惡性腫瘤組織中過度表達[6],表明其具有致癌作用。
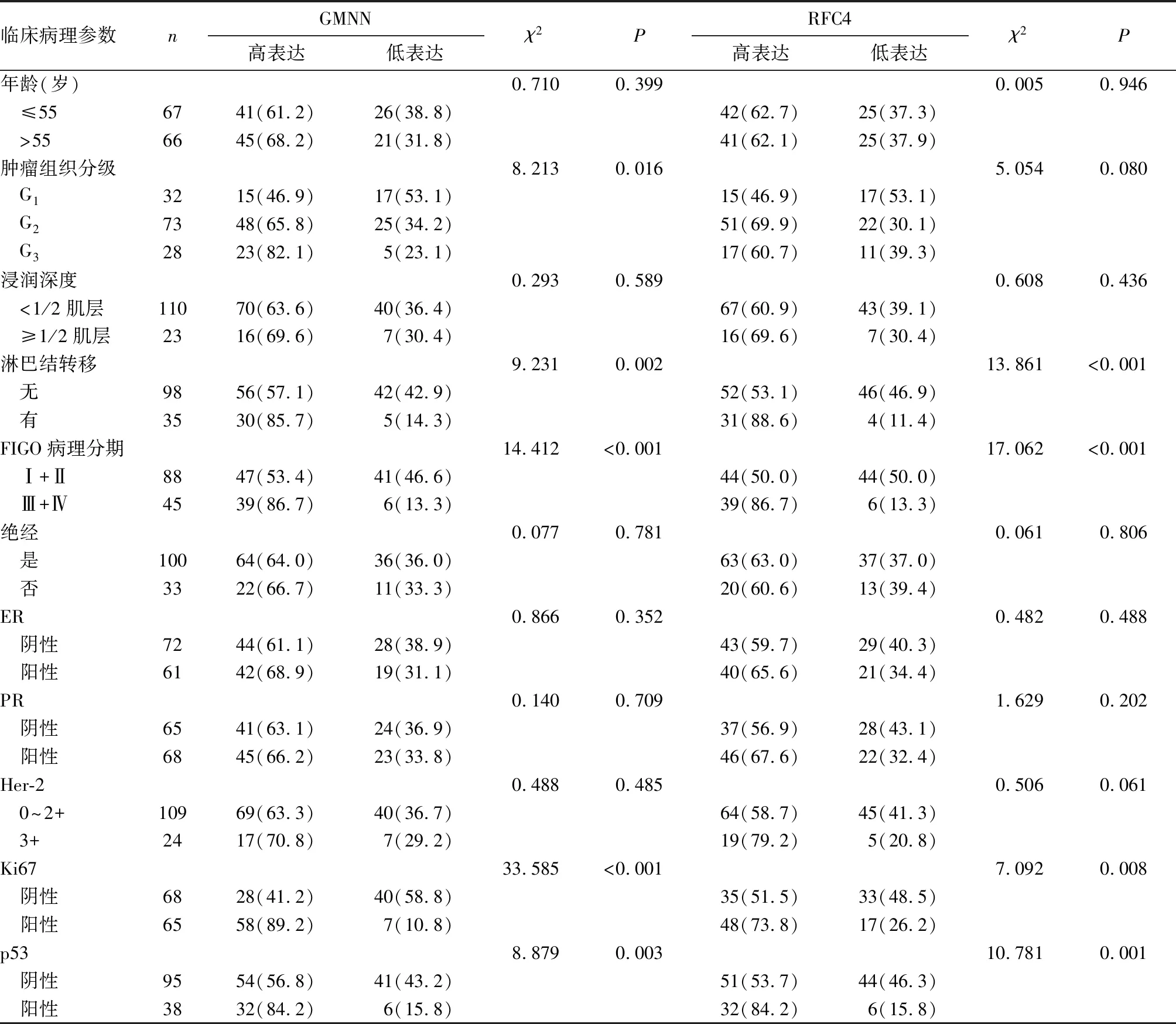
表2 不同臨床病理參數子宮內膜癌患者GMNN、RFC4蛋白表達比較[例(%)]
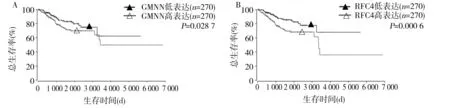
注:A為GMNN不同表達水平患者的生存時間比較;B為RFC4不同表達水平患者的生存時間比較。
這種致癌作用的機制包括在早期細胞譜系中維持多能性的能力[7]、促進胚胎干細胞中的上皮間質轉化(EMT)[8]和在G2/M/G1早期控制胞質分裂的能力[9]。大量研究顯示,GMNN表達水平越高,腫瘤細胞的生長速度越快,侵襲能力越強,患者生存時間越短[10-12],因此有學者認為GMNN可作為肝癌診斷的生物標志物[13]。RFC復合體位于真核生物復制叉上,由RFC1、RFC2、RFC3、RFC4、RFC5亞基構成,在DNA損傷后的真核DNA復制和DNA修復活動中發揮重要作用[14]。RFC4與RFC2、RFC5亞基形成核心復合物,具有DNA依賴性ATP酶活性,在體外系統中發現,該活性受PCNA刺激,是DNA聚合酶δ和DNA聚合酶ε延伸引物DNA模板所必需的[15]。RFC4在肺癌、口腔舌鱗癌、前列腺癌、乳腺癌、白血病等多種癌癥中高表達,其致癌作用與腫瘤細胞增殖及侵襲密切相關[16]。本研究利用UALCAN數據庫分析子宮內膜癌組織中的GMNN、RFC4 mRNA和蛋白表達水平,結果顯示,GMNN、RFC4mRNA和蛋白在子宮內膜癌組織中的表達均高于正常子宮內膜組織;進一步采用RT-qPCR方法對子宮內膜癌患者的新鮮癌組織和癌旁組織中的GMNN、RFC4 mRNA表達進行檢測,結果顯示,GMNN、RFC4 mRNA在子宮內膜癌組織中的表達水平均高于癌旁組織;采用免疫組化方法檢測正常內膜、不典型增生內膜、內膜癌組織中的GMNN、RFC4蛋白表達,結果顯示,GMNN、RFC4蛋白在子宮內膜癌中的高表達率明顯高于不典型子宮內膜組織和正常子宮內膜組織。這提示MNN、RFC4 mRNA和蛋白表達可能與子宮內膜癌的發生有關,二者高表達促進了子宮內膜癌的發生。進一步分析GMNN、RFC4與子宮內膜癌臨床病理參數之間的關系,結果顯示合并淋巴結轉移、FIGO病理分期Ⅲ+Ⅳ期、Ki67表達陽性、p53表達陽性患者的GMNN、RFC4高表達率分別高于無淋巴結轉移、FIGO病理分期Ⅰ+Ⅱ期、Ki67表達陰性、p53表達陰性的患者,表明GMNN和RFC4表達與子宮內膜癌的FIGO病理分期、淋巴結轉移、Ki67蛋白表達水平、p53蛋白表達水平有關,提示GMNN及RFC4的高表達均可促進人子宮內膜癌的惡性進展。
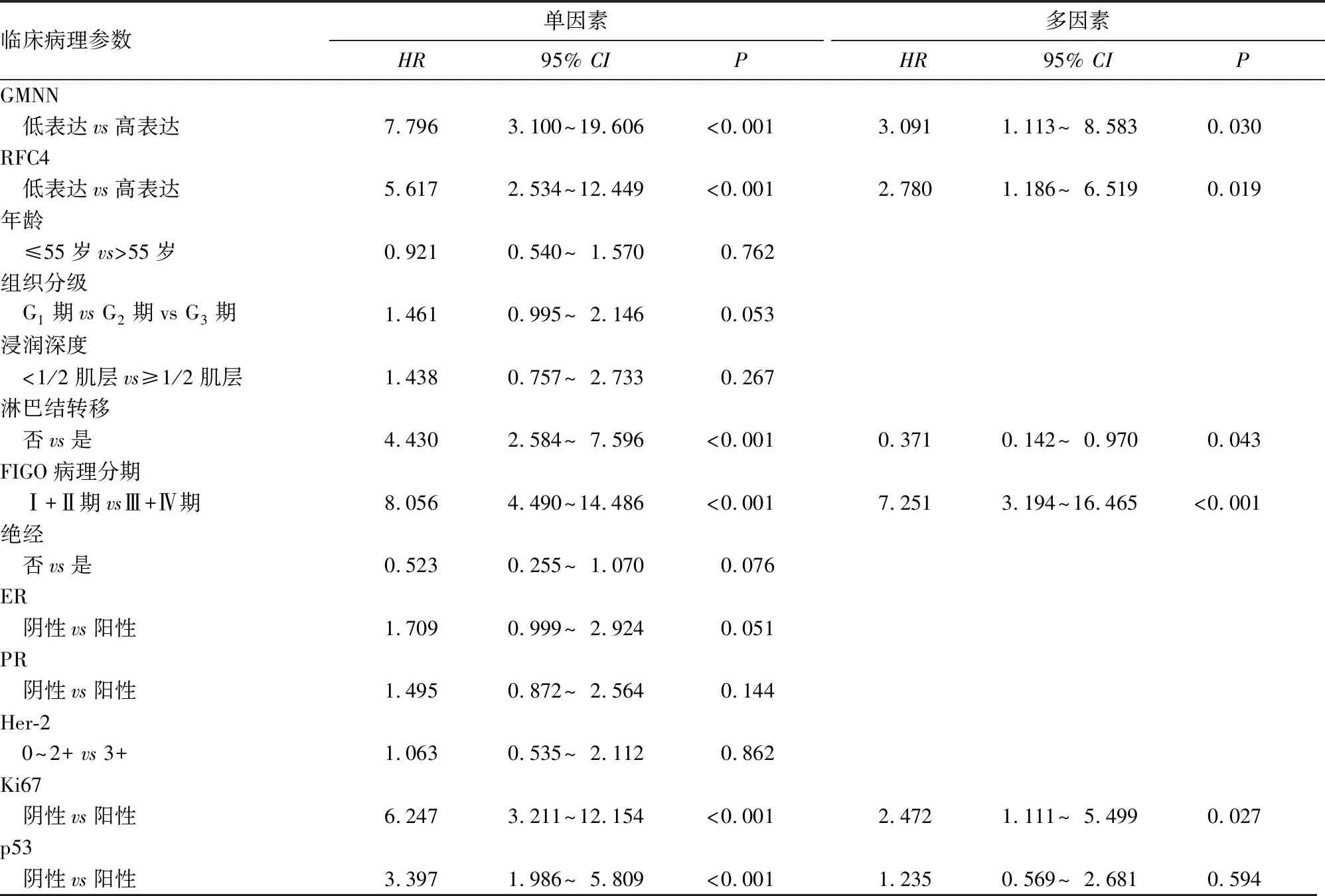
表3 子宮內膜癌患者的術后單因素和多因素生存分析
子宮內膜癌作為常見的婦科惡性腫瘤,大多數患者手術后生存時間短,預后差。本研究采用OncoLnc數據庫分析子宮內膜癌組織中GMNN、RFC4 mRNA表達對預后的影響,結果顯示,GMNN及RFC4 mRNA高表達患者的總生存率較低表達患者降低;本課題組對子宮內膜癌患者的隨訪結果顯示,GMNN、RFC4蛋白高表達患者的總生存率低于低表達患者,提示二者的高表達與內膜癌患者的總生存率均密切相關,兩者的表達情況可提示子宮內膜癌患者的術后生存率;Cox回歸分析顯示,GMNN、RFC4蛋白高表達是子宮內膜癌患者預后的獨立影響因素,二者與內膜癌患者的預后密切相關,可作為內膜癌患者預后的獨立預測因子,GMNN和RFC4表達越高,子宮內膜癌患者的預后越差。
最新對斑馬魚的研究顯示,GMNN通過影響Fgf8和Notch信號通路,以調節體節發生過程中的體節分割[17];對斑馬魚和小鼠的研究發現,GEMC1作為GMNN家族的一員,是多纖毛細胞分化程序的關鍵上游介質,在Notch抑制時被激活[18]。而另有研究顯示,RFC4是Notch1信號傳導的全新直接轉錄靶點[19]。我們推測,GMNN與RFC4的相互作用可能與Notch信號通路有一定的關系,但具體作用機制尚不清楚。本研究先通過生物信息學分析GMNN與RFC4 mRNA表達的相關性,結果顯示,GMNN與RFC4 mRNA表達呈正相關;然后對子宮內膜癌組織中GMNN與RFC4蛋白表達進行相關性分析,結果顯示二者呈正相關,進一步驗證了上述結果。推測二者可能協同表達,共同促進內膜癌的惡性生物學行為。
綜上所述,GMNN、RFC4 mRNA及蛋白在子宮內膜癌組織中的表達升高,且二者表達呈正相關;GMNN、RFC4高表達與子宮內膜癌的惡性程度、進展情況有關,嚴重影響患者的術后生存率。因此認為,GMNN及RFC4與子宮內膜癌的惡性生物學行為密切相關,兩者極有可能成為今后病理診斷和治療子宮內膜癌的新的分子指標。關于GMNN與RFC4相互作用的具體機制目前尚并不明確,有待我們從細胞學及分子遺傳學水平進一步深入研究。

