結核分枝桿菌潛伏性感染診斷的潛在標志物蛋白研究
張海晴,張雪迪,劉成永,周冬青,魏素梅,賈 彤, 張禮茂,郭 巖,李 莉,黃海濱
(江蘇省徐州市傳染病醫院 結核二科,江蘇 徐州,221004)
結核病是由結核分枝桿菌感染所致,有潛伏期及活動期2種疾病狀態[1-2],潛伏性感染患者早期無明顯癥狀[3],因此早期發現和治療潛伏性感染患者對控制結核病的傳播意義重大。目前,檢測結核潛伏性感染的方法仍不完善,結核菌素試驗不能明確區分卡介苗接種者、非結核分枝桿菌感染者、結核潛伏性感染和活動性結核病者,γ-干擾素 (IFN-γ)釋放試驗有局限性,亦不能鑒別潛伏性感染及活動性結核病[4]。因此,尋求結核潛伏性感染更為有效的診斷方法至關重要。潛伏性感染及活動性結核病患者中結核分枝桿菌蛋白表達差異,可作為潛伏性感染診斷的新思路。本研究通過同位素標記相對和絕對定量(iTRAQ)技術對結核分枝桿菌的休眠株及標準株進行蛋白質組差異表達篩選,并結合生物信息學技術進行分析,獲得參與潛伏性感染菌株中直接與休眠相關的能量代謝通路中的蛋白P9WPC9,從而為篩選出可用于結核潛伏性感染診斷的潛在標志物提供理論依據。
1 材料與方法
1.1 材料與試劑
選取結核分枝桿菌標準株H37Rv和由標準株誘導的潛伏性感染菌株模型(休眠株)各三皿,分別編號為sta1、sta2、sta3;dor1、dor2、dor3,數量為1×107;其中sta3和dor3因樣本蛋白降解,所以未能檢測出相關數據。試劑為蛋白酶抑制劑(protease inhibitor,美國 Calbiochem公司)、胰酶(trypsinPromega,德國Merk公司)、乙腈(acetonitrile、超純水,德國 Fisher Chemical公司)、三氟乙酸(trifluoroacetic acid)、二硫蘇糖醇(dithiothreitol)、三乙基碳酸氫銨(TEAB)、尿素、碘代乙酰胺(iodoacetamide)(三氟乙酸、二硫蘇糖醇、TEAB、尿素、碘代乙酰胺均購自美國 Sigma-Aldrich Sigma公司)。
1.2 實驗方法
(1)菌株造模。① 標準菌種培養:將結核分枝桿菌標準株H37Rv接種于提前配置好的中性羅氏培養基(珠海貝索生物技術有限公司)上,培養3~4周后將菌株轉種于含0.2%甘油、10% ADC的7H9液體培養基(BI)上,并置于搖床中震蕩培養,溫度為37 ℃,160轉/min,12~15 h待達到對數生長期即可(吸光度值約為0.4)。② 休眠菌種模型構建:取已經達到對數生長期的標準菌株進行研磨,研磨均勻后,按照菌株與培養基1∶100進行配液,加入亞甲藍,終濃度為1.5 μg/mL。將此混合液制成菌懸液,吸取10 mL于15 mL試管中,上層氣體與下層液體的體積比為1∶2,封口膠密封后置于37 ℃恒溫箱靜止培養。培養12~15 d后,溶液中的亞甲藍完全處于無色狀態時,說明菌株已進入完全缺氧休眠狀態。
(2)iTRAQ技術。① 菌株樣本蛋白抽提:向不同菌株樣本中分別加入4倍體積(尿素、1%蛋白酶抑制劑)裂解緩沖液,然后進行超聲裂解。將裂解后的混合液至于4 ℃離心機中離心10 min,轉速為12 000 g。去除細胞碎片后,將上清液轉移至新的離心管中,利用BCA試劑盒進行蛋白濃度測定。② 樣品及實驗預判。③ 蛋白質經過還原及巰基封閉后,使用胰蛋白酶進行酶切。④ 肽段混合物分別使用4種不同的iTRAQ試劑進行標記,使用Strata X C18(Phenomenex)將胰酶酶解后肽段進行鹽份祛除,待進行真空干燥及冷凍處理后,按照0.5 M TEAB將所獲得的肽段全部進行溶解處理。根據iTRAQ操作說明書步驟,將肽段進行不同同位素的標記,樣本分離信息及相關標記名稱見表1。⑤ 等量混合各種iTRAQ試劑標記的肽段。⑥ 混合樣品的HPLC分級處理:選取的色譜柱為Agilent 300 Extend C18,長度250 mm,內徑4.6 mm,粒徑5 μm。在高pH值狀態下,對已混合處理好的肽段進行反向高效液相色譜法(HPLC)分級。⑦ 相關質譜數據分析:使用EASY-nLC 1200超高效液相系統對處理好的肽段進行分離,所有已處理好的肽段均使用液相色譜流動相A進行溶解,并將其注入NSI離子源中集中進行電離操作,然后進入Q Exactive HF-X質譜進行分析。⑧ 生物信息學分析:使用Maxquant (v1.5.2.8)對二級質譜所獲得的數據進行檢索分析,相關參數設置的數據庫為Mycobacterium_tuberculosis_Uniprot (6 529條序列),數據中的假陽性率(FDR)可通過添加反庫計算方式進行優化,在數據庫中添加常見污染庫,以消除樣本鑒定結果中污染蛋白的影響,iTRAQ-4plex參數為1%,蛋白鑒定參數為1%,PSM鑒定的FDR參數為1%,相關參數設置見表2。

表1 樣本分離信息及相關標記名稱

表2 質譜數據分析相關參數設置
2 結 果
2.1 蛋白鑒定
iTRAQ定量質譜分析共得到365 454張二級譜圖。蛋白理論數據進行搜庫及對比后共得到可利用有效譜圖數量為5 624個,利用率為1.5%。通過譜圖解析鑒定出518條肽段,其中514條肽段為特異性肽段,共鑒定出238個蛋白,其中187個可定量。
2.2 蛋白差異表達分析
通過iTRAQ質譜定量分析檢測出肽段對應在每個樣本中的定量值,每個蛋白會對應多個肽段,計算蛋白在每個樣本中的定量值時,采用蛋白所對應特異性肽段的定量值中值作為該蛋白的定量值。對于每一次重復實驗,2個不同樣本之間蛋白定量比值作為差異表達量(Ratio)。本項目分別進行了2次不同重復實驗,可取2次重復Ratio值的平均值作為最終Ratio值。同時,可以取2次不同重復實驗的Ratio值變異系數CV值作為最終CV值。當CV值<0.1時,差異表達量變化超過1.2作為顯著上調的變化閾值,小于1/1.2作為顯著下調的變化閾值。差異表達蛋白統計信息見表3。

表3 差異表達蛋白信息
2.3 基因的本體論(GO)分析
使用GO分析對差異表達的蛋白進行統計分析,通過數據庫對比,找出標準株與休眠株中不同差異蛋白在不同信號通路中的功能,根據參與條款能量代謝途徑的差異蛋白進行分析。差異表達蛋白在GO二級分類中統計分布見圖1。
2.4 同源蛋白簇分析(COG/KOG)功能分類
將所獲得的質譜數據導入到數據庫進行比對分析,通過數據庫比對,找出標準株與休眠株中不同差異蛋白在不同信號通路中的功能,將差異蛋白進行COG/KOG功能分類統計(見圖2),發現不同生理狀態下的結核桿菌菌株間,差異性表達的蛋白質同樣與能量產生和轉換、蛋白質翻譯等關系。
2.5 差異蛋白互作網絡分析
對結核分枝桿菌標準株H37Rv和誘導的潛伏性感染菌株樣本中所獲得表達差異的蛋白進行統一編碼,將數據導入到STRING(v.10.5)蛋白網絡互作數據庫進行差異蛋白分析,按照參數confidence score >0.7 (high confidence)提取數據,從而分析標準株和潛伏性感染菌株中差異表達蛋白的相互作用網絡。差異蛋白互作網絡可通過R package“networkD3”工具構建展示,差異表達蛋白使用圓圈表示,圖中標記的紅顏色表示上調蛋白,藍顏色表示下調蛋白。圓圈大小表示2種樣本中差異表達蛋白及所對應的相互作用蛋白個數(圓圈越大說明與其互作的蛋白越多,圓圈越小說明與其互作的蛋白越少)。圖中編號為C的部分為能量代謝相關通路蛋白,可通過差異蛋白的功能富集分析,清晰找出哪些差異蛋白參與了代謝調控潛伏性感染菌株能量代謝相關通路調節,從而進一步確定關鍵標志物蛋白。取排名前50個且互作關系最緊密的蛋白,最終通過數據庫對比分析繪制出差異表達蛋白互作網絡圖,見圖3。
2.6 具有鑒別診斷價值的蛋白質及互作網絡
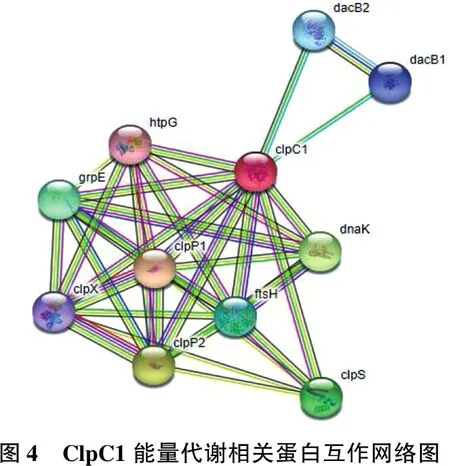
蛋白質組學差異表達結果以及生物信息學分析后得到詳細蛋白及相關通路信息,見表4。篩選出的P9WPC9(基因名稱為ClpC1)是潛伏期肺結核具有潛在診斷價值的蛋白質。休眠菌株P9WPC9表達水平是標準結核桿菌菌株的2.2倍,其網絡互作情況見圖4。
3 討 論
近年來,雖然醫療水平已有大幅提高,但結核病的診斷及治療仍是嚴重的公共衛生問題[6-7]。耐藥菌株的不斷出現[8]以及糖尿病、免疫缺陷性疾病等合并結核感染更增加了結核病的防治難度。傳統結核菌素試驗無法明確區分卡介苗接種者、非結核分枝桿菌感染者、結核潛伏性感染者及結核病患者[9];IFN-γ釋放試驗亦無法鑒別結核潛伏性感染及活動性結核病[10],若患者伴有其他免疫缺陷性疾病[11-12],則可會出現假陰性結果。因此尋求更加準確、有效的結核潛伏性感染診斷標志物至關重要。
從蛋白質組學分析結果中可知,所測差異蛋白主要與細胞能量代謝相關。進一步將差異蛋白進行COG/KOG功能分類統計,發現不同生理狀態下結核桿菌菌株間,休眠株中P9WPC9表達上調2.2倍,P9WPC9為ATP依賴性Clp蛋白酶ATP結合亞基(基因名稱為ClpC1),可以將蛋白酶引導至特定的底物處,亦可在沒有ClpP的情況下執行伴侶功能,在ClpP2存在的情況下降解抗σ-E因子RseA,從而調節能量代謝途徑,其調控主要與能量產生和轉換、蛋白質翻譯等相關。
因此,P9WPC9有望成為結核潛伏性感染的潛在診斷性標志物。下一步可應用western-blot對P9WPC9蛋白質水平進行驗證,應用實時熒光定量PCR(qRT-PCR)等技術觀察ClpC1 mRNA水平的改變。研究潛伏性感染及活動性結核病患者P9WPC9表達的改變,從而進一步探討P9WPC9在結核潛伏性感染診斷中的臨床應用價值。

