季戊四醇四油酸酯合成反應的熱力學分析
張 建,王 偉,錢文珍,劉 曦,劉寶勇*
(1. 蘭州交通大學 化學化工學院,蘭州 730070;2. 蘭州交通大學 環(huán)境與市政工程學院,蘭州 730070;3. 蘭州交通大學 材料科學與工程學院,蘭州 730070)
潤滑油在現(xiàn)代工業(yè)生產(chǎn)中發(fā)揮著必不可少的作用,被用于各種行業(yè),如航空、汽車、金屬高溫加工等領域[1-2].因此,潤滑油性能的提升和更新?lián)Q代受到了廣泛的關注.目前潤滑油大致分為植物潤滑油、礦物潤滑油和合成潤滑油三大類.季戊四醇油酸酯作為多元醇脂肪酸酯類合成潤滑油,其分子結構中含有較多高活性的酯基,不僅具有優(yōu)異的熱穩(wěn)定性和氧化穩(wěn)定性,而且兼具良好的水解穩(wěn)定性、低溫流動性、潤滑性能以及生物降解性和環(huán)境友好性,是重要的合成潤滑油[3-4].同時,隨著人們對于環(huán)境問題的愈發(fā)關注,具有良好的生物降解性的季戊四醇油酸酯將會受到越來越廣泛的使用[5].
目前,其合成方法多以酯化法[6]為主,但是該工藝生產(chǎn)過程中缺乏熱力學數(shù)據(jù)的指導;熱力學分析是化學反應發(fā)生的可能性和反應限度的重要判據(jù),可以為反應的操作條件、反應裝置設計及催化劑選用等提供參考;熱力學計算可以給出化學反應的理論極限轉化率,對工藝過程具有重要指導意義.基團貢獻法是估算化合物物理化學性質(zhì)的一種準確性高、適用范圍廣、計算過程簡便、通用性強的經(jīng)典熱力學方法[7].王麗嬌等[8]利用基團貢獻法對大豆油中的三油酸甘油酯和碳酸二甲酯進行酯交換制取脂肪酸甲酯和碳酸甘油酯反應進行了熱力學計算與分析.馬鴻賓等[9]采用基團貢獻法對三油酸甘油酯與甲醇酯交換反應進行了熱力學計算與分析.馬楷等[10]通過基團貢獻法對庚酸與季戊四醇酯化反應進行了熱力學數(shù)據(jù)計算與分析.但關于季戊四醇四油酸酯的合成體系熱力學分析的研究尚未見報道.同時,該反應體系中所涉及中間反應的基礎熱力學數(shù)據(jù)也鮮有報道.
本文通過基團貢獻法對各物質(zhì)進行熱力學數(shù)據(jù)估算,并將估算數(shù)據(jù)與文獻中數(shù)據(jù)進行對比.在反應溫度范圍內(nèi)分析了常壓下合成季戊四醇四油酸酯液相反應體系的標準摩爾反應焓變、標準摩爾反應吉布斯自由能變、反應平衡常數(shù)以及與溫度的關系,進而為該體系反應條件的優(yōu)化和應用提供一定的理論依據(jù)和參考.
1 反應過程及估算路徑設計
由于油酸分子基團較大,在以季戊四醇和油酸為原料合成季戊四醇四油酸酯的反應中,季戊四醇的鄰位酯化反應具有較大的空間位阻效應,反應活性低,鄰位酯化反應要比對位酯化困難的多.正是由于該反應空間位阻的特殊性才避免了無效副產(chǎn)物(鄰位季戊四醇二油酸酯)的生成.根據(jù)相關文獻[11-12],季戊四醇和油酸酯化反應得到季戊四醇四油酸酯是通過“四步”反應來實現(xiàn)的,其化學反應方程式如下所示:
分步反應
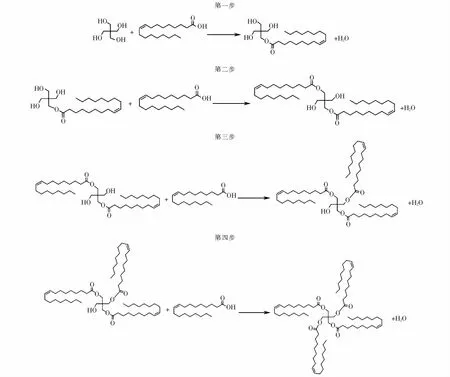

根據(jù)計算需求,采用逆分析法對熱力學計算路徑進行梳理,詳細計算路徑設計如圖1所示.
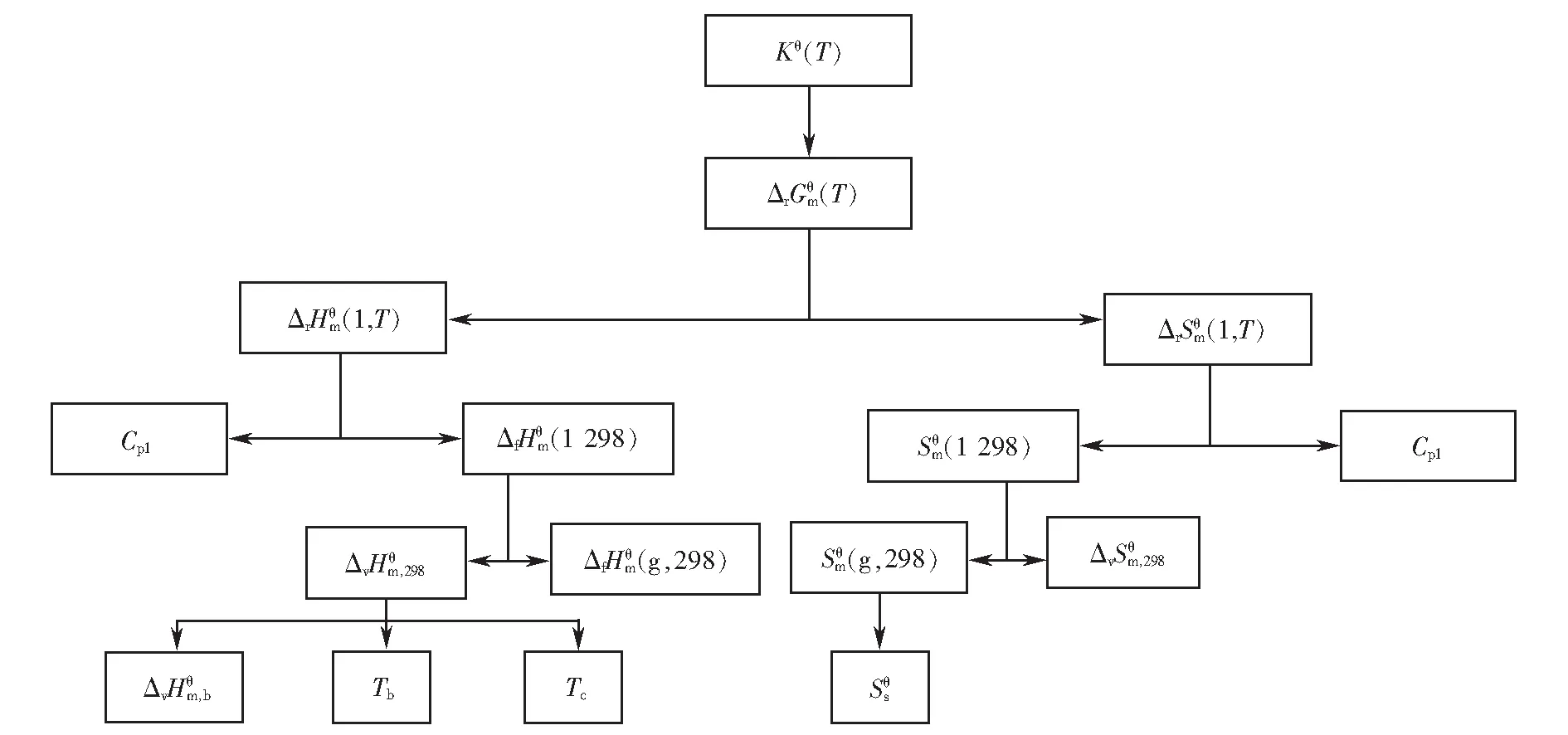
圖1 季戊四醇四油酸酯合成反應的計算路徑設計
2 過程分析與計算
對于不同化學反應體系而言,化學平衡常數(shù)Kθ是評價化學反應進度的重要指標,在工業(yè)生產(chǎn)上具有重要作用.不同溫度下的化學平衡常數(shù)Kθ,其值可以通過范特霍夫方程(1)來計算,表達式為
(1)
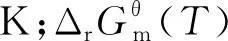
溫度T下液相反應體系標準摩爾反應Gibbs自由能變化量計算公式為
(2)
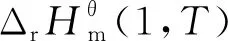
(3)
(4)
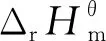
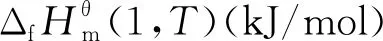
(5)
(6)
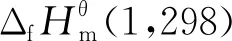
(7)
(8)
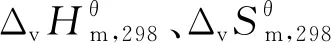
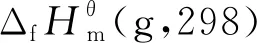
(9)
(10)
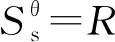
(11)

2.1 氣態(tài)條件下組分生成焓和熵的估算
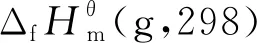
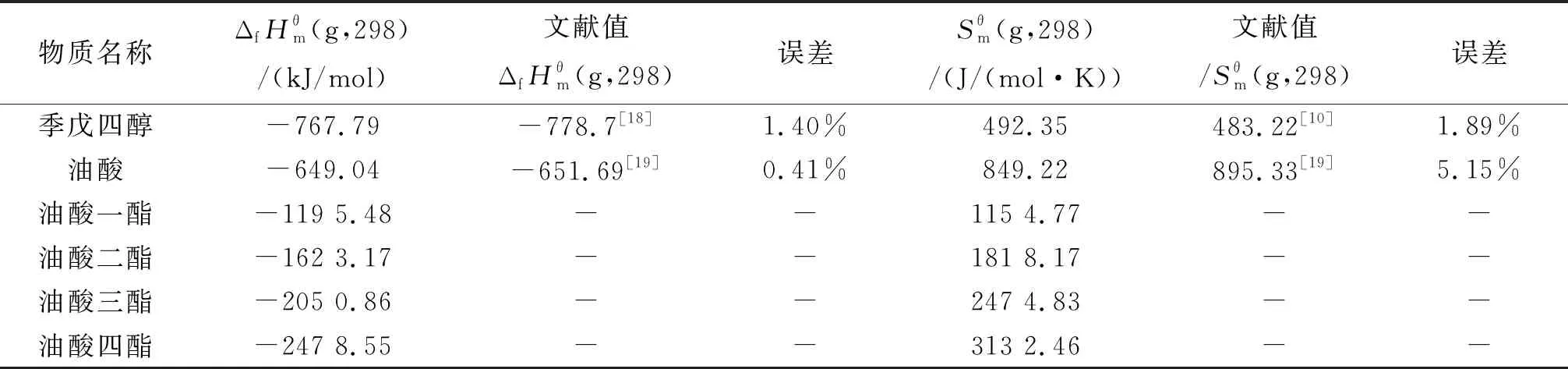
表1 該反應體系中各物質(zhì)在298 K下氣態(tài)的標準摩爾生成焓和標準摩爾熵
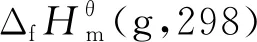
2.2 組分蒸發(fā)焓和蒸發(fā)熵的估算
(12)
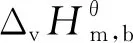
(13)
式(13)為Watson方程[17]、n通常為0.375或0.38,本文n取值為0.38.
(14)
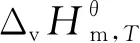
(15)
(16)
(17)
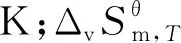
2.3 組分臨界溫度和沸點的估算
對于反應體系各組分的臨界溫度Tc和沸點Tb的計算,采用Marrero-Pardillo(M-P)[17]方法計算,計算公式如式(18)和(19)所示.
(18)
(19)
以Marrero-Pardillo(M-P)[17]方法計算反應體系各物質(zhì)的Tc和Tb,這種方法也被稱作是基團相互作用貢獻法/鍵貢獻法.M為相對分子質(zhì)量;Nk為k類原子數(shù);k類原子貢獻值表示為tcbk和tbbk.
該反應體系中各組分的沸點、臨界溫度、標準摩爾蒸發(fā)焓和標準摩爾蒸發(fā)熵的具體計算結果如表2所列.
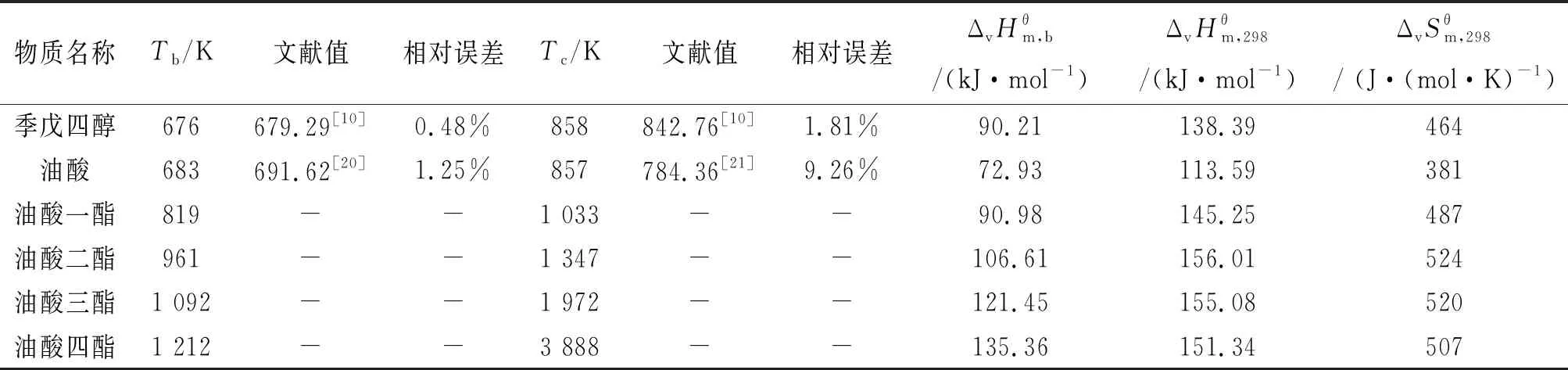
表2 反應體系各物質(zhì)的熱力學數(shù)據(jù)
以Marrero-Pardillo(M-P)[17]基團相互作用法估算該反應體系各物質(zhì)的沸點Tb和臨界溫度Tc的數(shù)值相對可靠,其最大相對誤差為9.26%,其余相對誤差均在2%以下.
2.4 各組分液態(tài)熱容的估算
(20)
(21)
(22)
(23)
式中:R是氣體摩爾常數(shù),數(shù)值為8.314 5 J/(mol·K);A、B、D為相對應的參數(shù),其值依據(jù)基團貢獻法求得,具體計算方法如式(21)~(23)所示,ni為i類基團的個數(shù);k為不同種類基團的總數(shù).
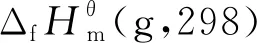
(24)
(25)
(26)
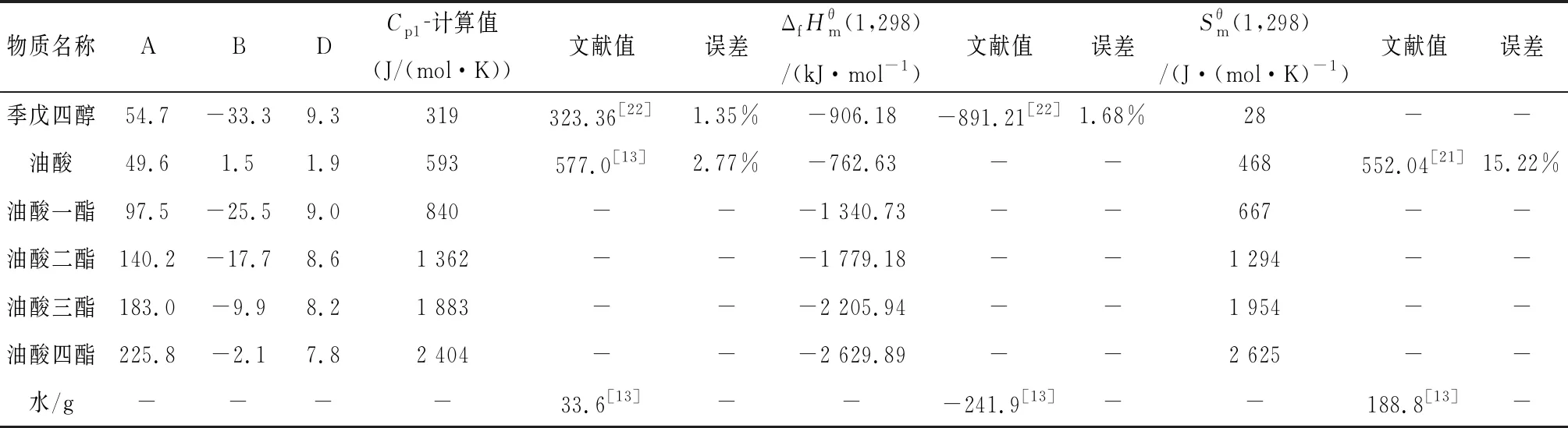
表3 反應體系各物質(zhì)的熱力學數(shù)據(jù)
2.5 季戊四醇四油酸酯合成反應中以及Kθ的計算
(27)
(28)
(29)
3 季戊四醇四油酸酯合成反應熱力學數(shù)據(jù)分析
3.1 四步分反應的以及Kθ隨溫度的變化如下
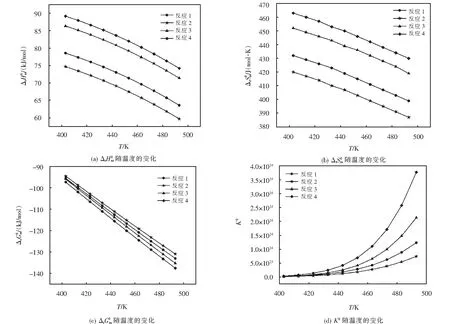
圖2 分步反應和Kθ與溫度T的關系
在實際反應生產(chǎn)過程中,反應平衡常數(shù)Kθ是衡量反應轉換率的重要參數(shù).圖2(d)表明四步反應的Kθ隨著溫度T的升高而升高,說明在計算溫度范圍內(nèi),溫度升高,有利于各步反應的進行.一般情況下將Kθ數(shù)值<10-5的視為反應無法進行,將Kθ>105的反應認為反應較為完全,可作為不可逆反應對待,且數(shù)值越大,反應越完全[24].以季戊四醇和油酸合成季戊四醇四油酸酯的四步連續(xù)分反應的Kθ均遠大于105,其計算數(shù)值均在1.787×1012~3.772×1014范圍內(nèi),說明各分步反應較為完全.
3.2 總反應中溫度對以及Kθ的影響

圖3 總反應的以及Kθ隨溫度T的變化 and Kθ of the total reaction as a function of temperature T
4 結論
1) 以季戊四醇和油酸為原料合成季戊四醇四油酸酯的總反應和四步分反應過程是一個能自發(fā)進行的吸熱反應,在計算溫度(403~493 K)范圍內(nèi)升高溫度有利于正反應的進行;
2) 總反應和四步分反應的吉布斯自由能變均<0,在反應溫度范圍內(nèi),溫度越高,吉布斯自由能變越小,表明升高溫度,有利于正反應的進行;
3) 總反應和四步分反應的平衡常數(shù)均>105,表明各反應在熱力學角度進行的都很完全;
4) 通過估算得到的有關熱力學數(shù)據(jù)不僅可以為季戊四醇四油酸酯的合成開發(fā)以及規(guī)模生產(chǎn)提供依據(jù),更是為各季戊四醇油酸酯(油酸一酯、油酸二酯和油酸三酯)的工業(yè)生產(chǎn)提供了熱力學數(shù)據(jù).

