經皮RFA術與關節腔內MTX-HA注射治療關節滑膜炎的療效比較
徐 琦 朱張茜 劉澤政 朱建碧 丁歡歡 鄭 潔
類風濕關節炎(rheumatoid arthritis,RA)是一種慢性炎癥性關節疾病,病因不明,發病機制復雜[1]。RA的特征是進行性和不可逆的炎癥性關節損傷,導致關節、軟骨、骨骼進行性破壞,從而嚴重影響關節結構與關節功能,降低患者的生活質量[2,3]。改善病情藥物(disease-modifying antirheumatic drugs,DMARDs)是指有效預防或減少關節損傷的藥物[4]。但全身炎癥控制的同時,局部持續的滑膜炎癥是造成疾病復發與靶關節破壞的關鍵因素,因此尋找一種有效的滑膜炎微創治療手段是當前的一大難題[5]。經皮關節腔內甲氨蝶呤-透明質酸偶合物(methotrexate-hyaluronic acid coupling,MTX-HA)注射是一種新興的有潛力的治療關節滑膜炎的方法[7,8]。另外在先前的研究中超聲引導下經皮滑膜射頻消融術(radiofrequency ablation, RFA)被證明是一種值得嘗試的關節滑膜炎微創療法[9]。上述兩種治療方式的治療效果比較尚無報道,值得進行對比研究。本研究采用AIA兔膝關節滑膜炎動物模型模擬RA的病理生理過程,對比超聲引導下經皮關節腔MTX-HA注射與超聲引導下經皮RFA術的療效,初步探討兩種療法的臨床應用前景。
材料與方法
1.實驗動物與分組:本項研究在溫州醫科大學動物實驗中心進行,納入40只6月齡雄性清潔級日本大耳白兔,體質量為2.0~3.0kg,共分為3組:AIA組30只,以AIA動物模型法進行造模[10]。AIA動物模型的建立與造模成功評價標準與之前的研究一致[9]。選擇其中15只進行左側膝關節RFA治療,作為RFA組;另外15只進行左側膝關節MTX-HA關節腔注射治療,作為MTX-HA組。其余10只兔左側膝關節0.9%氯化鈉注射液局部注射,作為對照組。
2.試劑與器具:卵清白蛋白(OVA,美國Sigma公司),弗氏完全佐劑(美國Sigma公司 F5881-10ml)。使用意大利Braco公司生產的聲諾維(Sonovue)為超聲造影劑,按照使用說明化為乳白色溶液后,1次0.1ml經耳緣靜脈注射,再注射1ml 0.9%氯化鈉注射液。使用美國Covidien公司生產的射頻消融儀進行RFA治療,射頻消融針型號為Cool-tip ACT1510,電極長度15cm,裸露長度1cm,進行RFA時采取60W等額輸出功率。
3.超聲儀器與參數:采用GE LOGIQ E9型超聲診斷儀,使用ML6-15線陣探頭進行灰階和能量多普勒超聲檢查,探頭頻率7.0MHz,PWr -15dB,機械指數0.35,使用配備超聲造影軟件的9L線陣探頭進行超聲造影檢查,頻率GEN 7.0MHz,PWr -15dB,機械指數0.35,輸出能量10%。造影前調節增益至適當水平。
4.滑膜射頻消融術操作過程:2%戊巴比妥鈉1.5ml/kg兔耳緣靜脈麻醉,剃毛、消毒后進行滑膜超聲造影,觀察滑膜增強情況。局部注射0.9%氯化鈉注射液作為液體隔離帶,保護關節組織[11]。多點連續消融法逐步消融滑膜組織[12]。完成后即刻第2次超聲造影,觀察有無殘留活性的滑膜組織及是否存在周圍軟組織的誤消融區,如有殘存活性滑膜區域,重復射頻消融至消融完全。
5.MTX-HA制備與注射:HA溶液具有通過混合容易地摻入各種生物試劑的特性,因此通過將HA溶液與MTX混合后可得到MTX-HA溶液,制備為用于局部注射治療的制劑[5]。獲得的MTX-HA為半透明帶紅色的黏稠乳液,可在室溫下流動。以0.5ml MTX-HA(5mg HA當量,300nmol MTX當量)每周1次在超聲引導下進行關節內給藥,注射至滑膜增生明顯的區域,2周注射完畢后開始術后觀察。
6.術后處理與評價:RFA組術后消融處冰敷2h,RFA組與MTX-HA組術后3天予16萬單位/毫升青霉素2.5ml肌內注射預防感染。手術當天及術后第2、4周進行評價,4周后處死白兔。術后評價內容包含:測量關節周徑、超聲評價關節積液、滑膜最大厚度、滑膜炎評分,按3分法進行超聲滑膜炎半定量評分[13]。在AIA模型造模成功后,實驗組內兩位不同觀察者獨立對隨機抽取的15只AIA模型兔膝關節滑膜炎進行半定量評分,以確定不同觀察者間的評分是否具備良好的一致性。髕旁內外并橫斷韌帶聯合切口解剖膝關節,肉眼觀察雙膝關節滑膜、軟組織損傷粘連、軟骨與骨侵蝕情況。根據膝關節大體解剖所見將兩側膝關節軟骨、骨侵蝕進行半定量評價;即軟骨形態正常為0分,軟骨輕微侵蝕并<50%所見面積為1分,軟骨顯著侵蝕并≥50%所見面積為2分;關節面骨皮質光滑、無骨侵蝕為0分,關節面骨皮質輕微侵蝕為1分,關節面骨皮質顯著侵蝕為2分。組織學評價:切取膝關節帶有肌肉、滑膜組織、軟骨下骨組織塊,石蠟包埋,5μm連續切片,HE染色后鏡下觀察。

結 果
40只大耳白兔體質量為2.11~3.05kg,平均體質量為2.56±0.27kg,單因素方差分析結果顯示,實驗開始時3組間體質量比較,差異無統計學意義(F=2.494,P>0.05);而在飼養至手術后第4周處死前,3組白兔體質量比較,差異有統計學意義(F=11.65,P<0.01),組間兩兩比較顯示,RFA組、MTX-HA組體質量均低于對照組,差異均有統計學意義(P均<0.05,圖1)。兩位不同觀察者獨立在對隨機抽取的15只AIA模型兔膝關節進行超聲滑膜炎評分的Bland-Altman散點圖,觀察者間評分的算數平均值-0.067,95%置信區間(95% CI)為-0.46~0.32,結果顯示不同觀察者間的超聲半定量評分重復性良好(圖2)。
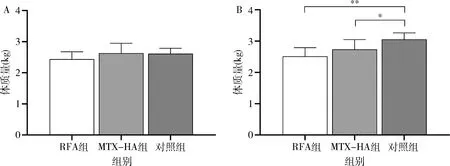
圖1 40只大耳白兔3組間體質量比較A.實驗開始時體質量對比;B.手術后第4周處死前體質量比較。*P<0.05,**P<0.01
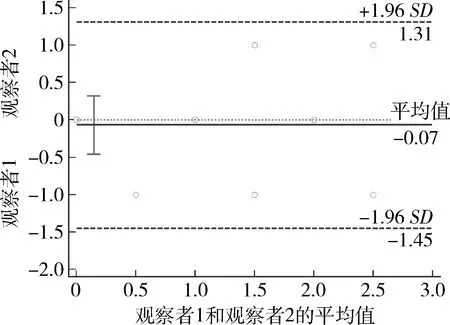
圖2 兩位觀察者對15只大耳白兔膝關節滑膜炎超聲半定量評分的Bland-Altman散點圖
30只兔AIA模型造模均成功;RFA組與MTX-HA組手術經過順利(圖3),術中與術后觀察期內無動物死亡現象,均順利觀察至術后第4周。13只RFA組白兔第1次消融后超聲造影評價提示消融,另外2只RFA組兔1次消融后超聲造影發現尚存在未滅活的滑膜組織,進行2次消融后提示滑膜滅活完全。MTX-HA組15只白兔順利完成連續2周、每周1次關節腔內注射MTX-HA液,注射時全程超聲引導將MTX-HA液注射至關節腔滑膜增厚最明顯處。
圖3 RFA組與MTX-HA組兔膝關節術中超聲圖A、B、C分別為RFA組超聲測定滑膜厚度、滑膜炎及RFA術中;D.RFA組術前CEUS滑膜組織高增強;E.RFA組術后CEUS滑膜組織無增強; F、G、H.MTX-HA組超聲測定滑膜厚度、滑膜炎及關節腔藥物注射術中
手術當天術前及術后2、4周常規評價結果顯示詳見圖4。與術前比較RFA組關節周徑在術后2周無顯著變化(P>0.05),術后4周時則出現顯著減小(P<0.01);而MTX-HA組則是在術后2周開始出現關節周徑減小(P<0.01);組間比較術后4周時RFA組、MTX-HA組與對照組比較關節徑差異均有統計學意義(P<0.01)。RFA組、MTX-HA組超聲評價關節積液、滑膜厚度在術后2、4周時與術前比較,差異均有統計學意義(P<0.01),即兩組積液在術后穩步減少,滑膜厚度逐漸變薄;組間比較表明RFA組滑膜厚度減小對比MTX-HA組更明顯(P<0.05)。超聲半定量評價滑膜炎結果表明RFA組在術后即下降至低值,并在4周時無顯著滑膜炎復發;而MTX-HA組與術前對比,術后滑膜炎評分在4周時才出現顯著的評分降低(P<0.01),并且在術后2周、4周時滑膜炎評分均高于RFA組(P均<0.05)。
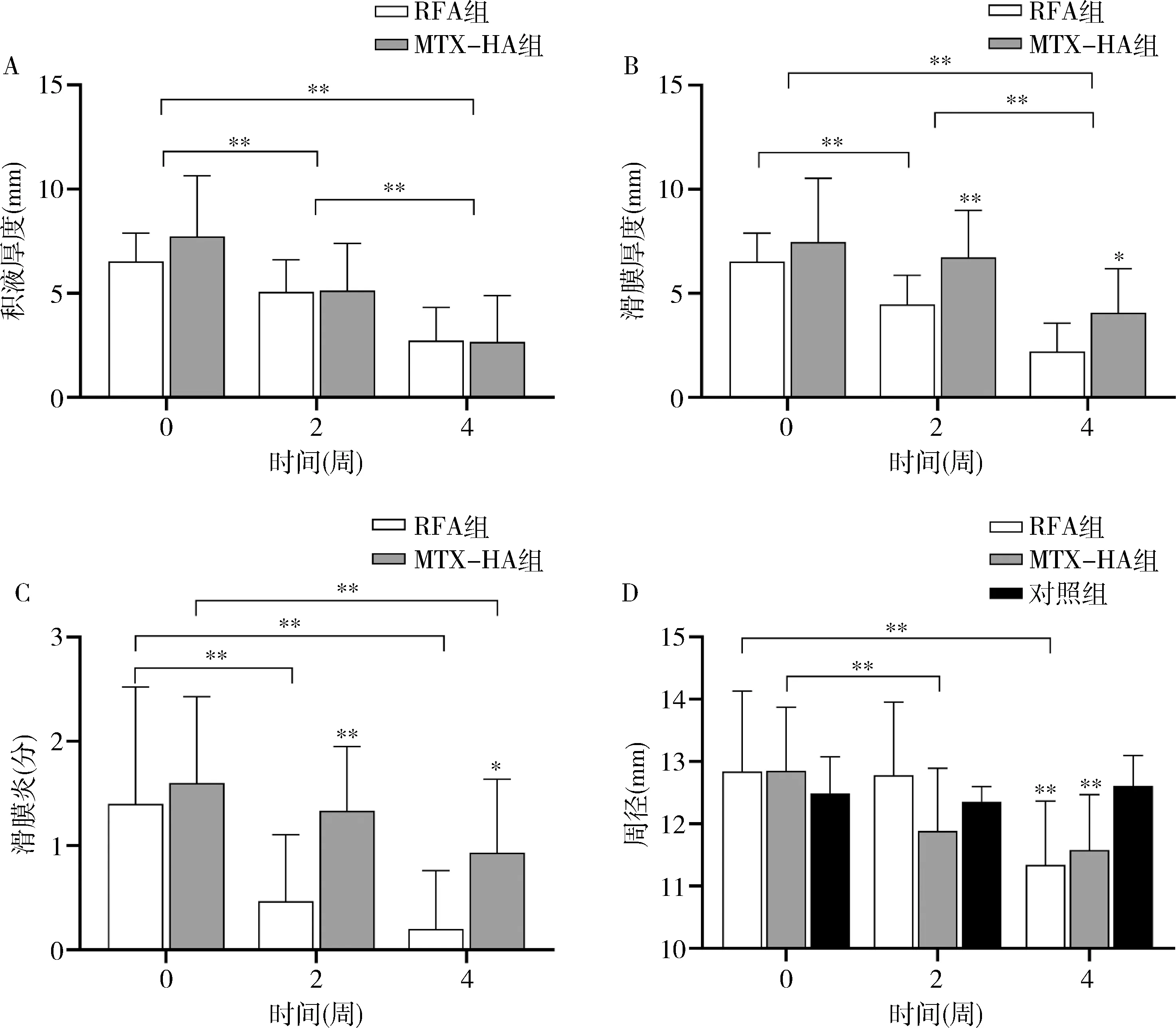
圖4 術前與術后2、4周評價指標組間對比圖A.積液厚度隨時間變化;B.滑膜厚度隨時間變化;C.滑膜炎評分隨時間變化;D.關節周徑隨時間變化。天數0代表手術當天,*P<0.05,**P<0.01
術后4周大體解剖關節軟骨、骨侵蝕半定量評分比較如圖5、圖6所示,RFA組與MTX-HA組左側膝關節(手術側)軟骨、骨評分均低于右側,但僅RFA組兩側比較差異有統計學意義(P<0.01),而MTX-HA組兩側比較差異無統計學意義(P>0.05)。病理組織學顯示(圖7),RFA組觀察到了壞死的滑膜組織細胞,但周邊肌肉組織并無顯著的組織破壞與組織壞死情況,兩者分界清晰。MTX-HA組觀察到了小片狀滑膜組織細胞,并具備完整的細胞形態,表明仍存在一定的組織活性。

圖5 兔膝關節解剖后直視下半定量骨、軟骨評分A.軟骨侵蝕半定量評分;B.骨侵蝕半定量評分。*P<0.01
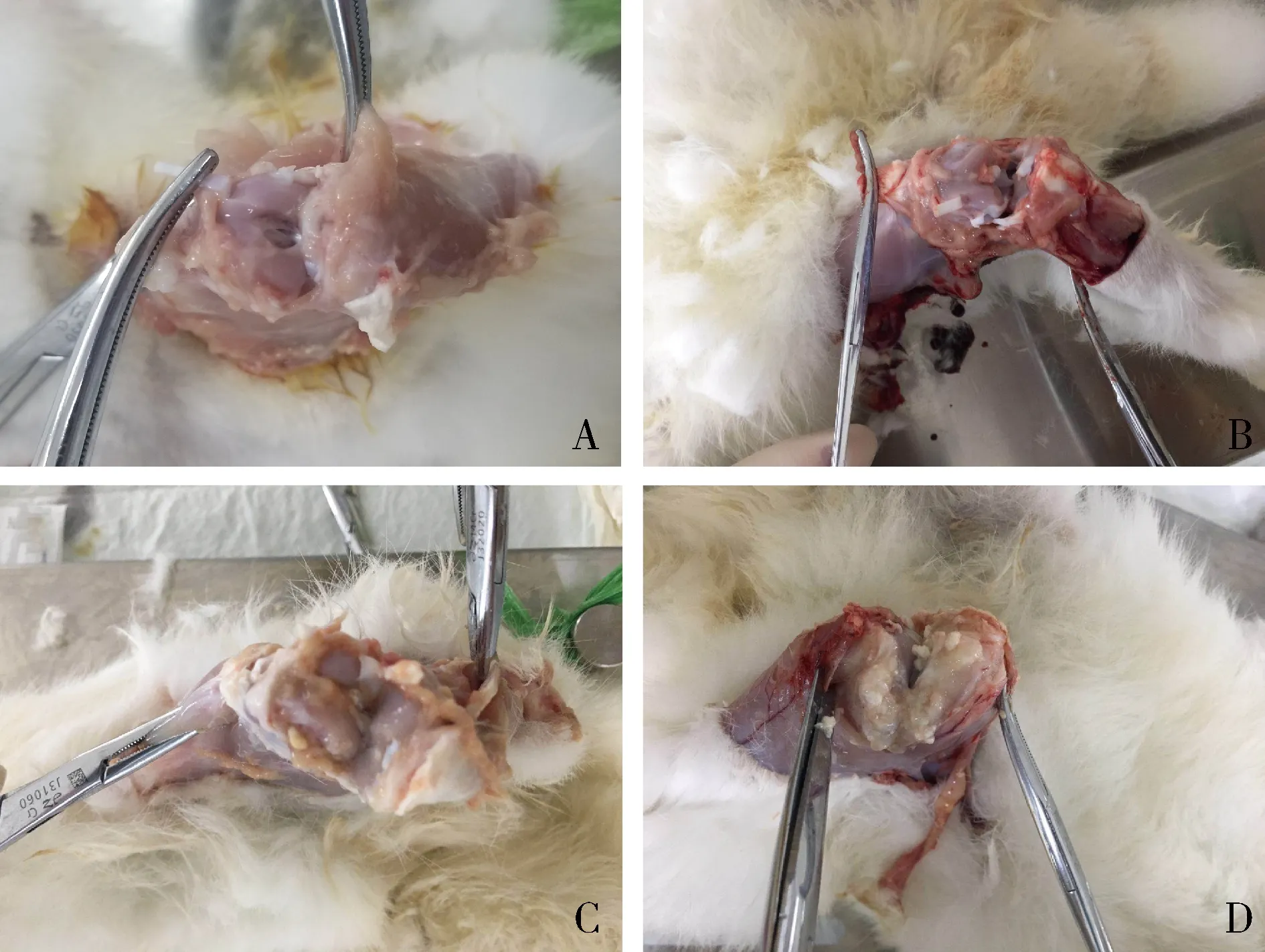
圖6 RFA組與MTX-HA組兔兩側膝關節面大體解剖所見A、C分別顯示RFA組與MTX-HA組術側軟骨、骨侵蝕較輕;B、D分別顯示RFA組與MTX-HA組對側明顯軟骨、骨侵蝕

圖7 RFA組與MTX-HA組兔關節橫紋肌與滑膜病理圖A.RFA組(HE,×10);B.MTX-HA組(HE,×20)
討 論
有效治療與控制關節滑膜炎是各種骨關節病關鍵問題,特別是在以滑膜炎為關鍵病理生理過程的類風濕性關節炎中該問題更加關鍵[1~3]。很多研究結果顯示,當滑膜炎被有效控制后,骨關節病的預后出現明顯好轉[3~5]。尋求一種有潛力的滑膜炎微創治療方式是解決該問題的有效途徑。
甲氨蝶呤(MTX)是最常用于治療RA的DMARDs之一[4]。但系統性毒性、口腔炎、惡心、骨髓抑制和肝毒性限制了MTX的口服給藥[14,15]。MTX關節腔內局部注射給藥是靶向治療手段之一,可以有效減少全身不良反應[7]。但單純的關節腔內注射MTX被證實療效不佳,與目標區域藥物濃度迅速降低有關[16]。因此有研究者研究應用MTX與透明質酸(hyaluronic,HA)偶合物局部關節腔內注射,從而減緩MTX釋放,使關節滑膜炎癥減輕[7,8]。在筆者前期的研究中,超聲引導下膝關節滑膜射頻消融術被用于治療與清除AIA兔膝關節滑膜炎,并取得了較好的療效,并使炎性細胞因子TNFα、VEGF的表達得到了抑制,因此也是一種微創治療局部滑膜炎的手段之一[9]。兩種當前有前景的關節滑膜炎微創治療方式有必要進行療效的對比研究,剖析其中優劣。
本研究采用的AIA動物模型成模穩定,RFA組、MTX-HA組手術經過均順利,治療前后無動物死亡現象[10]。術后動態觀察膝關節腫脹結果顯示RFA組、MTX-HA組膝關節周徑均比術前減小,差異在于RFA組關節腫脹在術后2周內并未顯著好轉,在術后4周時顯著好轉,與RFA術熱沉積造成軟組織重癥有關,與其他部位的RFA術基本一致[11,12]。而MTX-HA組術后關節腫脹則呈現隨時間延長逐步好轉的現象,術后4周兩組比較差異無統計學意義(P>0.05)。此外,在使用超聲觀察評價關節積液、滑膜厚度時RFA組、MTX-HA組也出現了積液在術后穩步減少、滑膜厚度逐漸變薄的現象,從影像學角度證實了兩組的療效。值得注意的是,RFA組滑膜厚度減小更明顯,且滑膜炎半定量評分降低也更顯著(與MTX-HA組比較,P均<0.01),可以認為在滑膜組織滅活方面,RFA組治療效果優于MTX-HA組。其原因可能為RFA術直接滅活滑膜組織的同時抑制了炎性細胞因子如TNF-α、VEGF的表達;而MTX-HA局部注射雖然可以控制滑膜炎癥,減少炎性細胞因子的釋放,但不能完全滅活滑膜組織,在病因持續的情況下造成滑膜炎癥復發,因此不難解釋該現象產生的原因。
術后4周時動物關節解剖結果顯示(圖6),RFA組與MTX-HA組手術側軟骨、骨評分低于對側,但MTX-HA組比較差異無統計學意義,而RFA組比較差異有統計學意義(P<0.01),且病理組織學也印證了這一點,這表明RFA術在完全滅活了滑膜組織后中期關節軟骨、骨侵蝕預后要優于MTX-HA關節腔注射治療。
RFA術在治療腫瘤時可以誘導抗腫瘤免疫效應,活化T細胞并使之浸潤在腫瘤中,調節并增強機體免疫反應,最終起到抗腫瘤作用[17,18]。而RFA術在治療自身免疫性關節病(如RA)時似乎在滅活滑膜組織細胞的同時,調節了關節內細胞炎性細胞因子的表達,抑制局部關節滑膜炎的復發,使關節軟骨、骨侵蝕進展減緩[9]。制備MTX與HA偶合物方便快捷,可較容易制備獲得,并且可以長時間保持局部藥物治療濃度,因此可有效抑制關節炎性細胞因子的產生[19]。通過本研究也進一步證實了其具備較好的抑制關節滑膜炎癥的治療效果。
超聲引導下滑膜RFA術與MTX-HA關節腔內注射術比較,兩者均能明顯抑制局部關節滑膜炎癥,使局部關節癥狀好轉,阻止關節軟骨、骨侵蝕進展;在作用機制方面RFA術與MTX-HA關節腔內注射術均能調節與抑制關節炎性細胞因子表達與釋放,兩者的差異主要在于RFA術有望徹底滅活滑膜組織,在抑制滑膜炎復發方面優于MTX-HA關節腔內注射術。兩者在操作方面均較簡便,MTX-HA注射更易于掌握,并且MTX-HA治療后恢復期較RFA術更快,不容易造成關節腫脹等特點。因此兩者治療方式各有優勢,值得在臨床中進一步推廣應用。但本研究也存在一定的局限性,首先AIA動物模型雖然較精準地模擬了RA的病理生理過程,但與實際RA尚存在一定差異,另外關節解剖半定量評分對于觀察者來說也存在一定差異。

