PRRSV感染原代和傳代PAM的比較轉錄組學分析
周艷榮,郝婉君,衛 瑩,李 洋,柯文婷,肖少波,方六榮
(華中農業大學 動物醫學學院 農業微生物學國家重點實驗室,湖北 武漢 430070)
豬繁殖與呼吸綜合征(porcine reproductive and respiratory syndrome,PRRS)是由PRRSV引起的嚴重危害養豬業發展的傳染病之一,主要表現為母豬繁殖障礙、新生仔豬死亡和生長豬呼吸道疾病,給養豬業造成了巨大的經濟損失[1]。當前,PPRS普遍通過疫苗免疫的方式進行防控,但PRRSV變異速度快,新毒株的不斷出現與演化增加了PRRSV的多樣性和復雜性,給本病的防控帶來了巨大困難和更多的挑戰。因此,深入研究PRRSV與宿主的相互作用機制,挖掘調控PRRSV增殖的新型宿主蛋白,進一步解析PRRSV的致病機理,對PRRS的防制有重要的指導意義。
PRRSV的主要靶細胞為巨噬細胞,其中原代豬肺泡巨噬細胞(PAM)被廣泛應用于PRRSV研究。由于PAM的分離過程較為繁瑣,不能傳代,且存在較強的異質性,導致了其應用的局限性,因此需要替代PAM的傳代細胞系。目前已有研究人員通過SV40大T抗原敲除PAM的抑癌基因,從而將其永生化,但卻導致PRRSV受體CD163的表達模式發生改變,因此不支持PRRSV感染[2]。在此基礎上,LEE等[3]通過外源導入豬源CD163,獲得了對PRRSV易感的傳代PAM細胞系。另外,CALVERT等[4]利用PB轉座系統將外源CD163導入PAM,也成功獲得了傳代PAM細胞系。但以上細胞系的CD163均是外源性的,與原代PAM仍存在較大的差異。為了解決這個問題,在通過SV40大T抗原永生化PAM后,王同云等[5]利用流式細胞術篩選得到了高表達CD163的細胞株,并命名為傳代豬肺泡巨噬細胞(IPAM)。試驗表明IPAM保留了PAM對PRRSV的高度易感性,且感染率高于PAM。與其他PAM傳代細胞系比較[1-4,6],IPAM的優點在于其CD163來源于母細胞。因此,IPAM可能是一種優良的PAM替代細胞模型,但是目前并不清楚兩者在PRRSV感染時是否存在應答差異。
轉錄組測序技術能夠獲得特定狀態下轉錄本的結構、數量等信息[7],在PRRSV的研究中應用廣泛,如利用轉錄組測序技術揭示PRRSV感染誘導宿主免疫應答的分子細節[8-9];研究PRRSV編碼蛋白的功能[10];比較PRRSV不同毒株的致病性以及分析其與宿主的互作機制[11-12];篩選抗PRRSV豬[13];評估PRRSV疫苗的免疫效果等[14-15]。但對PRRSV感染原代和傳代PAM后轉錄譜的比較研究尚未見報道。
本研究通過比較轉錄組學技術,一方面探索PRRSV對IPAM易感性高于PAM的原因,以期發現調控PRRSV增殖的關鍵因子;另一方面比較PAM和IPAM在感染PRRSV后的應答差異性和相似性,為PAM傳代細胞系在科學研究中的實用性和真實性提供理論依據。
1 材料與方法
1.1 細胞和病毒PAM為本實驗室分離并保存,IPAM由哈爾濱獸醫研究所蔡雪輝教授惠贈。PAM和IPAM均在含10%胎牛血清(FBS,PAN-Seratech)的RPM-1640培養基(Hyclone)中,于37℃和5% CO2條件下培養。PRRSV WUH3株為本實驗室分離并保存。
1.2 主要試劑PRRSV N蛋白的單克隆抗體由本實驗室制備并保存;綠色熒光(Alexa Fluor 488)標記驢抗小鼠IgG購自Jackson ImmunoResearch公司;細胞核熒光染料DAPI購自碧云天生物技術有限公司;總RNA提取試劑Trizol購自Omega公司;反轉錄試劑盒購自Roche公司;Real-time PCR試劑(SYBRTMGreen PCR Master Mix)購自Applied Biosystems公司。
1.3 主要軟件及生物學數據庫主要軟件有:HISAT2比對軟件、IGV軟件、StringTie軟件、subread軟件、Cytoscape軟件和DESeq2軟件;分子生物學分析軟件包括:DNAman、DNAuser、Primer 5.0、Graphpad Prism、Image J、ViiATM7 system、FV10-ASW 3.1 Viewer和Image Lab等。
生物學數據庫:Biomart數據庫、CDD數據庫、Ensembl數據庫、GO數據庫、KEGG數據庫、NCBI COG/KOG數據庫、STRING數據庫、Uniprot數據庫和AnimalTFDB數據庫。
1.4 PRRSV一步生長曲線的繪制將PRRSV WUH3株(MOI=10)分別接種PAM和IPAM,于接種后0,6,9,12,15,18,21,24,36 h分別收集病毒懸液,參照文獻[16]的方法測定PRRSV的TCID50,從而繪制一步生長曲線。
1.5 間接免疫熒光試驗(IFA)檢測PRRSV感染率將PRRSV(MOI=10)分別接種PAM和IPAM,同時設置未接毒的空白對照。分別于接毒后6,9,12,15 h固定細胞,參照文獻[16]的方法,通過間接免疫熒光試驗分別檢測PRRSV在PAM和IPAM中的感染率,其中一抗和二抗分別為PRRSV N蛋白的單克隆抗體和綠色熒光標記驢抗小鼠IgG。
1.6 轉錄組測序樣品的準備共設置4組:PRRSV(MOI=10)感染的PAM組(PAMv)和IPAM組(IPAMv)、未接種PRRSV的PAM對照組(PAMm)和IPAM對照組(IPAMm),每組3個重復。PRRSV感染PAM和IPAM 12 h后,通過Trizol法提取總RNA,用于轉錄組測序。
1.7 建庫測序與數據分析對檢測合格的RNA樣品進行建庫測序,由北京諾禾致源科技股份有限公司完成;數據質控合格后,對表達水平進行定量,然后以FDR校正的padj < 0.05且|log2(FoldChange)| > 1.5作為差異表達基因的篩選標準,統計各組間差異表達基因,進行后續分析。
1.8 實時熒光定量PCR驗證轉錄組學數據熒光定量PCR引物如表1。

表1 本研究中所用的熒光定量PCR引物
2 結果
2.1 PRRSV在PAM和IPAM中的感染動力學分析
2.1.1PRRSV感染PAM和IPAM的一步生長曲線 將PRRSV(MOI=10)分別接種PAM和IPAM,于感染后0,6,9,12,15,18,21,24,36 h收集病毒懸液,測定TCID50,繪制一步生長曲線。結果發現PRRSV在PAM和IPAM中的增殖曲線相似,但在感染早期(15 h前),PRRSV在PAM中的增殖滴度低于IPAM,并以感染后12 h的差異最為顯著,而在感染中晚期(15 h后)無明顯差異(圖1A)。
2.1.2PRRSV在PAM和IPAM上的感染率 將 PRRSV(MOI=10)分別接種PAM和IPAM,同時設置未接毒的空白對照組(Mock),利用間接免疫熒光試驗(IFA)比較了感染早期PRRSV在2種細胞中的感染率。結果顯示,在感染早期,PRRSV在IPAM中的感染率明顯高于PAM(圖1B,C,D)。

A.PRRSV感染PAM和IPAM的一步生長曲線;B.IFA檢測PRRSV在PAM中的感染情況;C.IFA檢測PRRSV在IPAM中的感染情況;D.PRRSV在PAM和IPAM中的感染率統計圖1 PRRSV在PAM和IPAM中的感染動力學
2.2 差異表達基因的篩選結合感染動力學差異分析結果,選取PRRSV感染后12 h的PAM和IPAM,進行轉錄組測序分析。主成分分析(PCA)結果顯示,各組組內樣本均相對集中,說明樣本的重復性較好;同時發現,IPAMv與IPAMm之間的主成分差異較PAMv與PAMm之間的主成分差異大,說明PRRSV感染對IPAM基因表達模式的影響大于PAM(圖2A)。利用DESeq2軟件進一步對轉錄組數據進行統計學分析,分別比較PAMv與PAMm、IPAMv與IPAMm之間mRNA表達量的差異,并以FDR校正的padj < 0.05且|log2(FoldChange)| > 1.5作為差異表達基因的篩選標準,統計各組間差異表達基因的數量。如圖2B~D所示,與未感染組(IPAMm)比較,PRRSV感染IPAM(IPAMv)后共產生4 316個差異表達基因,其中上調和下調的差異表達基因分別為2 578,1 738個;與未感染組(PAMm)比較,PRRSV感染PAM(PAMv)后共得到1 285個差異表達基因,其中上調和下調的差異表達基因分別為812,473個。PRRSV感染2種細胞后產生了315個共有差異表達基因,其中上調和下調的差異表達基因分別為159,25個。
2.3 差異表達基因的GO功能注釋和KEGG信號通路富集分析采用clusterProfiler軟件對PRRSV感染PAM和IPAM后的差異表達基因進行GO分析,結果發現PAM中的差異表達基因主要調控免疫系統進程(immune system process)、免疫應答(immune response)和去磷酸化(dephosphorylation)等生物過程(BP),主要分布于細胞外區域(extracellular region)和中間纖維(intermediate filament)等細胞組分(CC)中,主要與細胞因子活性(cytokine activity)和受體結合(receptor binding)等功能分子(MF)相關(圖3A);IPAM中的差異表達基因主要調控囊泡介導轉運(vesicle mediated transport)和有機酸代謝過程(organic acid metabolic process)等生物過程,主要分布于細胞質(cytoplasm)和蛋白質復合體(protein complex)等細胞組分中,主要與氨酰基-tRNA連接酶(aminoacyl t-RNA ligase)和連接酶活性-形成碳氧鍵(ligase activity,forming carbon-oxygen bonds)等功能分子相關(圖3B)。將PRRSV感染PAM和IPAM后的差異表達基因進行KEGG信號通路富集分析,結果表明PAM中的差異表達基因優先富集在細胞因子受體相互作用(cytokine-cytokine receptor interaction)、軸突導向(axon guidance)、MAPK和TNF等免疫相關信號通路(圖3C);IPAM中的差異表達基因優先富集到脂肪酸代謝(fatty acid metabolism)、三羧酸循環(TCA circle)、IL-17、蛋白運輸(protein export)和碳代謝(carbon metabolism)等代謝相關信號通路(圖3D)。以上結果提示,PAM的免疫相關差異表達基因多于IPAM,而IPAM的代謝相關差異表達基因多于PAM。
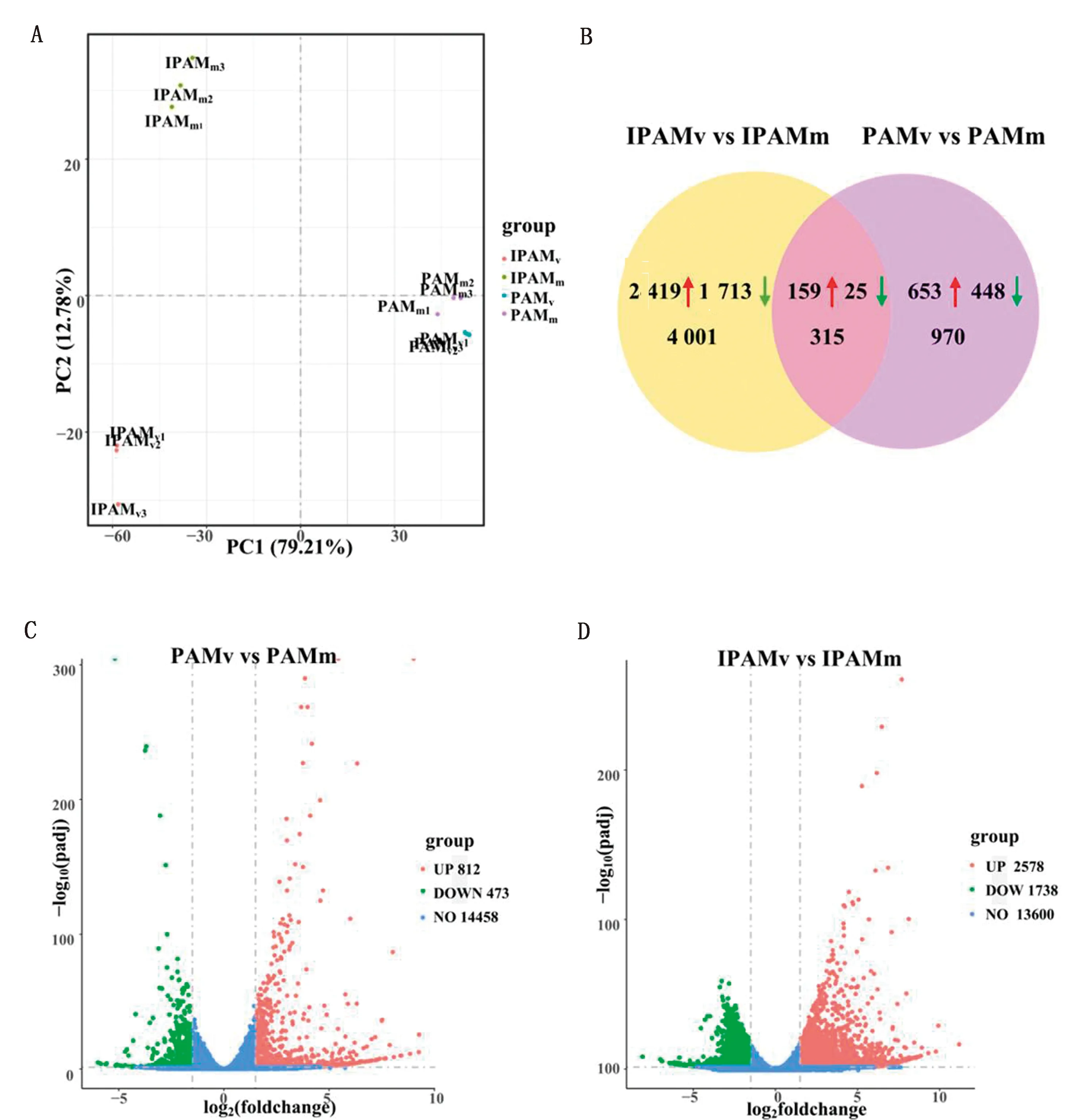
A.PAM和IPAM的主成分分析; B.PRRSV感染PAM和IPAM的差異表達基因數量;C.PRRSV感染PAM的差異表達基因火山圖;D.PRRSV感染IPAM的差異表達基因火山圖圖2 PAM和IPAM差異表達基因的總體分析
2.4 PAM和IPAM共有和特有差異表達基因的GO和KEGG富集分析為了探討PRRSV感染PAM和IPAM后差異表達基因的相似性和差異性,對2種細胞共有和特有的差異表達基因進行篩選,并進一步對其進行GO和KEGG富集分析。
GO功能注釋發現,2種細胞共有的差異表達基因優先富集到免疫應答(immune response)、免疫系統進程(immune system process)和水解酶活性調控(regulation of hydrolase activity)等生物過程;優先富集到細胞黏附(cell adhesion)和細胞外區域(extracellular region)等細胞組分;優先富集到細胞因子活性(cytokine activity)、細胞因子受體結合(cytokine receptor binding)和受體結合(receptor binding)等功能分子(圖4A)。

A.PAM差異表達基因的GO功能分析; B.IPAM差異表達基因的GO功能分析;C.PAM差異表達基因的KEGG信號通路富集分析;D.IPAM差異表達基因的KEGG信號通路富集分析圖3 PAM和IPAM差異表達基因的GO和KEGG富集分析
KEGG富集分析發現,2種細胞共有的差異表達基因優先富集到TNF、MAPK、IL-17等免疫相關信號通路;PAM特有的差異表達基因優先富集到花生四烯酸代謝(arachidonic acid metabolism)、細胞因子受體互作(cytokine-cytokine receptor interaction)和MAPK等信號通路,IPAM特有的差異表達基因優先富集到脂肪酸代謝(fatty acid metabolism)、脂肪酸降解(fatty acid degradation)、纈氨酸/亮氨酸/異亮氨酸降解(valine,leucine and isoleucine degradation)等代謝相關信號通路(圖4B)。

A.PAM和IPAM共有差異表達基因的GO功能分析;B.PAM和IPAM特有和共有(Intersection)差異表達基因的KEGG富集分析圖4 PAM和IPAM特有和共有差異表達基因的GO和KEGG富集分析
2.5 引起PAM和IPAM中PRRSV感染率差異的潛在機制分析
2.5.1細胞周期相關基因 研究表明,細胞周期相關基因參與調控PRRSV增殖[17]。對2種細胞中細胞周期相關的差異表達基因進行統計分析,發現PRRSV感染IPAM后,大部分與細胞周期相關的基因下調表達,如在細胞周期調控中發揮重要作用的BUB1B(mitotic checkpoint serine/threonine kinase B)、BUB3(mitotic checkpoint protein)、CDK2(cyclin-dependent kinase 2)和HDAC1(histone deacetylase 1)等基因(圖5A),而在PAM中這些基因大多上調表達,說明PRRSV感染IPAM后可能通過細胞周期阻滯積極調控PRRSV增殖,從而導致比PAM更高的感染率。
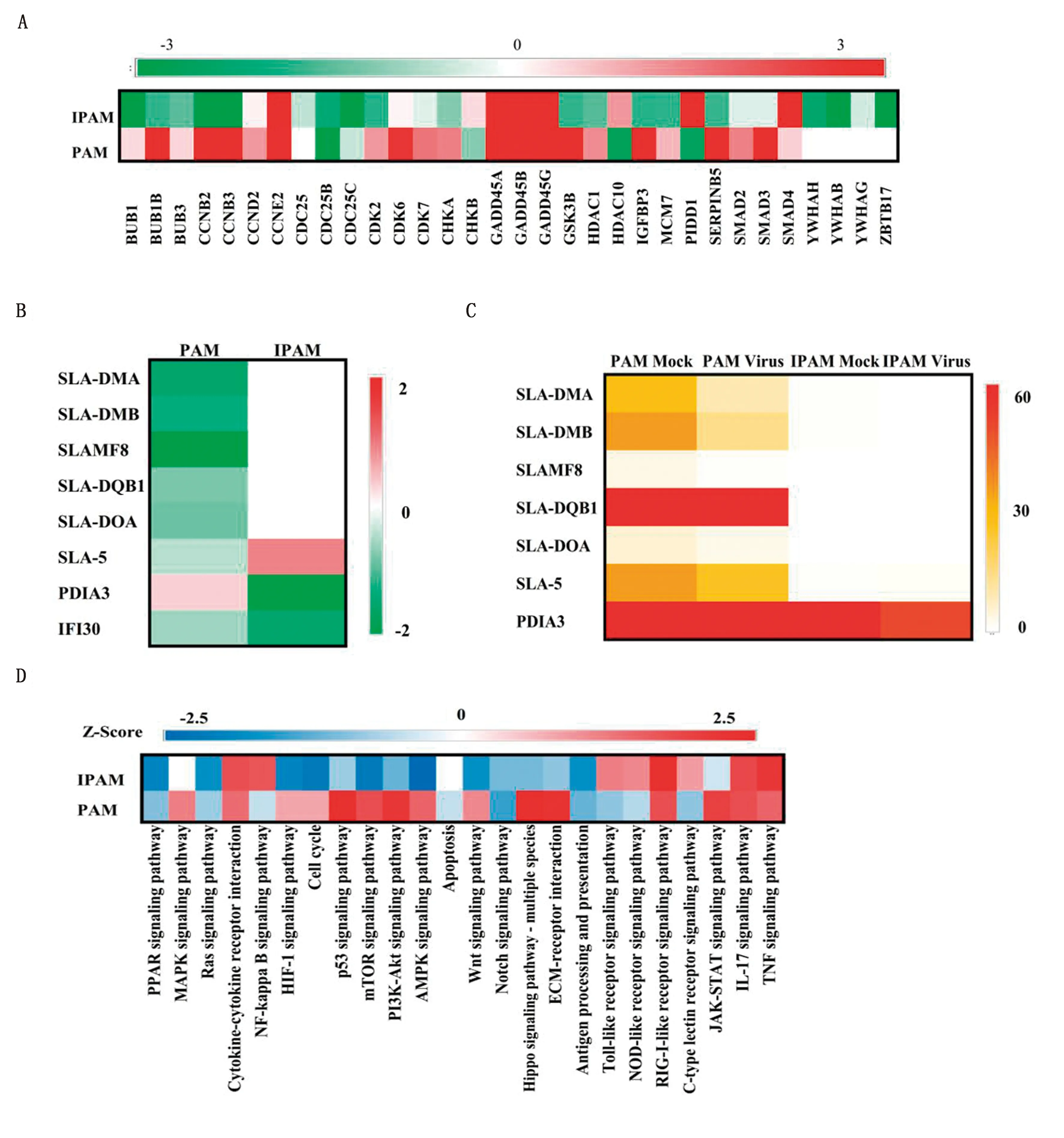
A.細胞周期相關差異表達基因的分析; B.抗原遞呈相關差異表達基因的表達趨勢;C.抗原遞呈相關差異表達基因的表達豐度; D.免疫相關信號通路分析圖5 PAM和IPAM中差異表達基因的功能及免疫相關信號通路分析
2.5.2抗原遞呈相關基因 豬源MHC(major histocompatibility complex)分子也被稱為SLA(swine leukocyte antigen)分子,在抗原遞呈過程中發揮關鍵作用。對PRRSV感染2種細胞后產生的差異表達基因進行分析,發現PRRSV感染PAM后,MHC-Ⅰ類和MHC-Ⅱ類分子(SLA-DMA、SLA-DMB、SLAMF8、SLA-DQB1、SLA-DOA和SLA-5)以及參與調控抗原加工和遞呈過程的IFI30(lysosomal thiol reductase)均下調表達;而在IPAM中,只有IFI30以及參與細胞信號轉導、MHC組裝、T細胞TCR信號通路調控等多種生物學過程的PDIA3(protein disulfide isomerase family A member 3)下調表達,SLA分子并無顯著變化(圖5B)。進一步對2種細胞中SLA分子的表達豐度進行統計分析,結果顯示無論是否接種PRRSV,在IPAM中均未檢測到SLAMF8、SLA-DQB1和SLA-DOA的表達,SLA-DMA、SLA-DMB和SLA-5的表達豐度均極低,PDIA3在IPAM中的表達豐度也顯著低于PAM(圖5C)。以上結果說明,抗原遞呈相關基因在IPAM中的缺失或者低豐度表達可能導致IPAM中的免疫應答反應較弱,最終PRRSV能夠建立更高的感染率。
2.5.3免疫相關信號通路的分析 運用生物通路分析法(IPA),對PRRSV感染2種細胞后免疫相關信號通路的差異性進行了分析。IPA結果顯示mTOR、PI3K-Akt、AMPK、Wnt、Hippo、Toll-like receptor和NOD-like receptor等信號通路相關基因在PAM和IPAM中存在相反的表達趨勢(圖5D)。這進一步說明PRRSV感染PAM和IPAM后存在免疫應答差異,從而導致PRRSV在2種細胞中的感染率差異。
2.6 差異表達基因的驗證隨機挑選出11個差異表達基因,包括LIF(leukemia inhibitory factor)、CXCL10(C-X-C motif chemokine ligand 10)、CDC25B(cell division cycle 25B)、TRIM65(tripartite motif containing 65)、CH25H(cholesterol 25-hydroxylase)、TNFAIP3(TNF alpha induced protein 3)、CD74(major histocompatibility complex class Ⅱ invariant chain)、RELB(RELB proto-oncogene,NF-kB subunit)、TRAF2(TNF receptor associated factor 2)、E2F2(E2F transcription factor 2)和CCL20(C-C motif chemokine ligand 20),通過實時熒光定量PCR(qRT-PCR)分別檢測PRRSV感染PAM和IPAM后,對其mRNA水平的影響。結果顯示,qRT-PCR結果和轉錄組測序(RNA-Seq)結果趨勢一致(圖6)。
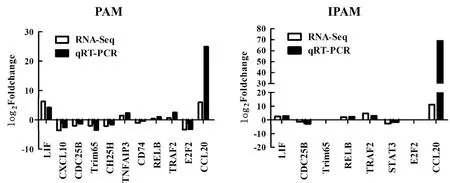
圖6 實時熒光定量PCR驗證差異表達基因
3 討論
PRRSV引起的PRRS自暴發以來給全球養豬業帶來了巨大的經濟損失[18]。PRRSV感染的靶細胞是巨噬細胞,其中PAM是開展PRRSV體外研究的最佳細胞模型。但PAM不能傳代,因此亟需 PAM的替代細胞系。目前已有多株PAM的傳代細胞系被報道,但PRRSV受體基因均是外源導入的[10],而IPAM中的PRRSV受體CD163來源于母細胞(PAM),避免了外源基因插入導致的潛在副作用。
天然免疫反應在宿主抵抗病毒感染中發揮重要作用。通過與Innate DB中的免疫相關參考基因庫比對,發現PRRSV感染PAM和IPAM后大部分的共有免疫相關差異表達基因的表達趨勢相同,說明2種細胞在PRRSV感染后的免疫應答具有一定程度上的相似性。另外,有少部分基因呈現相反的表達趨勢,如CD209、CD27和HERP(homocysteine-inducible ER stress protein)等(數據未顯示)。其中,CD209基因與先天免疫系統相關,且編碼跨膜受體,可識別包括寄生蟲和病毒在內的多種病原體[19-20]。研究表明,逆轉錄病毒(人類免疫缺陷病毒(HIV)、猿免疫缺陷病毒和貓免疫缺陷病毒)、黃病毒科病毒(登革熱病毒、西尼羅河病毒和丙型肝炎病毒(HCV))和絲狀病毒科病毒(埃博拉病毒和馬爾堡病毒)等囊膜病毒均可利用CD209作為病毒的識別和黏附受體,進而促進病毒感染[21-23]。CD209也是PRRSV的潛在受體之一[24]。本研究發現,PRRSV感染IPAM后上調CD209的mRNA水平,這可能是IPAM中PRRSV感染率較高的原因之一。
CD27是一種共刺激免疫檢查點受體,其配體CD70屬于腫瘤壞死因子(TNF)配體家族。CD27-CD70在病原微生物的感染過程中發揮雙重作用,在感染早期促進機體的免疫應答,抵抗病原微生物的感染;在感染晚期破壞機體產生的抗體,導致免疫缺陷。CD27-CD70在抗病毒免疫反應中也發揮著重要作用[25]。在本研究中發現,PRRSV感染PAM后上調CD70的mRNA水平,而感染IPAM后下調CD70的mRNA水平,這是否會導致PRRSV在2種細胞中的增殖差異也是值得進一步探討的。
HERP是內質網應激誘導表達的內質網膜蛋白,通過促進Ⅰ型干擾素(IFN-α和IFN-β)和Ⅲ型干擾素(IFN-λ1)表達發揮廣譜抗病毒作用,能夠抑制腸道病毒71型、仙臺病毒、甲型流感病毒和水皰性口炎病毒等多種RNA病毒的增殖[26]。PRRSV為單股正鏈RNA病毒,且對干擾素敏感。本研究發現,在PAM中PRRSV上調表達HERP,而在IPAM中下調表達HERP,說明HERP的差異表達可能是導致PRRSV在PAM中感染率較低的因素之一,但仍需要進一步的實驗驗證。
值得注意的是,趨化因子類基因在IPAM中嚴重缺失。趨化因子在免疫細胞發育、定位及免疫應答過程中發揮重要作用,能在宿主細胞內形成快速且直接的抗病毒反應,從而抵抗病原微生物的感染。此外,部分趨化因子也可作為病原微生物進入宿主細胞的輔助受體[23]。因此,趨化因子在病毒感染過程中發揮復雜且重要的作用。如CCL3L1低表達的人群對乙型肝炎病毒、HCV和HIV更易感[27-30]。本研究發現,在PAM中CCL3L1的表達豐度最高,且PRRSV感染顯著上調CCL3L1的mRNA水平;而在IPAM中,無論是否感染PRRSV,均未檢測到CCL3L1的表達。那么,CCL3L1的缺失是否導致IPAM對PRRSV更易感?這個問題值得進一步研究和探討。
本研究通過轉錄組學技術,比較了PRRSV感染PAM和IPAM后宿主應答的差異性和相似性,為PAM傳代細胞系在PRRSV相關研究中的使用提供了理論依據;并分析了PRRSV在IPAM中感染率高于PAM的可能原因,發現了調控PRRSV增殖的潛在宿主基因,為抗病毒研究提供了新思路。

