ASFV、CSFV、PRRSV 多重熒光PCR檢測方法的建立與應用
牛偉杰,于學祥,高 宇,庫旭鋼,何啟蓋,3*,羅 銳*
(1.華中農業大學 動物醫學學院,湖北 武漢 430070;2.華中農業大學 農業微生物學國家重點實驗室,湖北 武漢 430070;3.華中農業大學 動物疫病診斷中心,湖北 武漢 430070)
非洲豬瘟(ASF)是一種烈性傳染病,可引起感染豬較高的死亡率,對世界各國養豬業造成了巨大的經濟損失。而自2018年ASF傳入我國以來,目前流行形式依然嚴峻。非洲豬瘟病毒(ASFV)感染可引起患病豬體表及內臟廣泛的出血和水腫,并可導致100%的死亡率[1]。經典豬瘟(CSF)、豬繁殖與呼吸綜合征(PRRS)同樣是目前嚴重損害我國及世界生豬養殖產業的常見傳染性病毒病。CSF在豬群中擴散后發病率高達 80%~100%,皮膚出血、高燒,厭食,胃腸道癥狀,全身無力和結膜炎等均是CSF感染的表現。PRRS可導致發病豬的耳朵及其他部位皮膚發紺,因此得名“豬藍耳病”[2]。我國《國家中長期動物疫病控制規劃(2012—2020年)》要求到2020年優先對種豬場實行CSF、PRRS的凈化,并逐步推行至對全國范圍的豬場。
在不同規模化養豬場中,ASF、CSF、PRRS等疾病不僅嚴重影響經濟效益,且感染豬臨床癥狀的高度相似性,使得養殖技術人員難以通過病豬表現進行鑒別[2-3]。而多重檢測方法,高效的鑒別診斷則提供了有力支持,同時簡化操作步驟、降低實驗污染風險、節約樣品、試劑成本以及試驗時間,可為臨床疾病檢測提供更高效的服務[4]。
1 材料與方法
1.1 材料
1.1.1細胞、病毒和疫苗毒株 豬瘟病毒疫苗毒株(HCLV)及疫苗稀釋液購于武漢科前生物股份有限公司;豬繁殖與呼吸綜合征病毒(JXA1)、豬圓環病毒2型(PCV2)、豬圓環病毒3型(PCV3)、豬偽狂犬病毒(PRV)、豬日本乙型腦炎病毒(JEV)、口蹄疫病毒(FMDV)、豬流行性腹瀉病毒(PEDV)、豬傳染性胃腸炎病毒(TGEV)、豬德爾塔冠狀病毒(PDCoV)以及Marc-145細胞(非洲綠猴胚胎腎細胞)均由本實驗室保存;E.coli5α感受態細胞購于北京全式金生物技術有限公司。
1.1.2主要實驗儀器及試劑 病毒(DNA/RNA)核酸提取試劑盒以及全自動核酸提取儀購自(西安)天隆科技有限公司;RNA反轉錄試劑盒、BIOWEST瓊脂糖、2×Es Taq MasterMix、DL2000 DNA Marker、DMSO、和2×Probe MasterMix購自大連寶生物技術有限公司(TaKaRa);GoldenView核酸染料購自北京艾德萊生物科技有限公司;DEPC水以及50×TAE電泳緩沖液購于生工生物工程(上海)股份有限公司;TSA培養基購自美國BD公司。
1.1.3樣品來源 本研究共收集了839份全血(EDTA抗凝血)樣品,為2019年2月至2020年1月來自湖北省、湖南省和江西省,為保育和育肥階段有皮膚發紺、體溫升高等癥狀豬只的14家規模化豬場。
1.2 方法
1.2.1引物和探針的設計 本研究在設計引物及探針時參考CSFV、PRRSV流行的所有亞型,使用Primer5.0軟件分別對CSFV 保守區域5′UTR基因、PRRSV保守區域ORF6基因設計多對引物和探針以供篩選。ASFV引物及探針序列參考OIE《陸生動物診斷實驗及疫苗手冊2019》推薦序列。ASFV(F:5′-CTGCTCATGGTATCAATCTTATCGA-3′,R:5′-GATACCACAAGATCAGGCCGT-3′,Pro-be:5′-FAM-CCACGGGAGGAATACCAACCCAGTGTAMRA-3′);CSFV(F:5′-AACGGAGGGACTAGCCATAG-3′,R:5′-GTGCTCAC-GTCG-AACTACTGA-3′,Probe:5′-ROX-CCTGGGTGGTCTAAGTCCTGAGTA-BHQ2-3′);PRRSV:(5′-ATCACCTCCAGATGCCGTTT-3′,R:5′-CG-ACAAATGCGTGGTTATCA-3′,Probe:5′-CY5-TACATTCTGGCCCCTGCCCACCAC-BHQ3-3′)。引物和探針均由武漢擎科生物有限公司合成,于-20℃冰箱保存備用。
1.2.2陽性質粒的制備 使用本研究所設計的標準質粒引物,以CSFV、PRRSV的cDNA為模版,按照以下反應體系(表4)和反應條件進行PCR擴增(ASFV B646L標準質粒前期由本實驗室送生物公司合成)。CSFV-5′UTR(F:5′-GTATACGAGGTTAGCTCATTCTCG-3′,R:5′-GTGCCATGTAC-AGCAGAGATTTTTTA-3′);PRRSV-ORF6(F:5′-CTTTTGGCGTTTTCCATTACC-3′,R:5′-CA-ACACGAGGCTTTTCAACC-3′)。擴增標準質粒PCR反應條件:95℃ 5 min;95℃ 30 s、60℃ 30 s、72℃ 30 s,40個循環;72℃ 終延伸10 min,產物4℃短暫保存。
將產物膠回收純化,鏈接 pMD18-T 載體后轉化感受態細胞大腸桿菌DH5α。經培養后挑取陽性菌落進行PCR鑒定并測序,將陽性質粒測定濃度并計算拷貝數,進行倍比稀釋后-20℃保存。
1.2.3多重qPCR反應條件優化 在多重實時熒光定量 PCR 反應的條件下,使用DEPC H2O將引物及探針濃度分別稀釋為4,6,8,10,12,14,16,18 μmol/L,在體系中加入1 μL的引物以及探針,使其終濃度分別為0.16,0.24,0.32,0.40,0.48,0.56,0.64 μmol/L,摸索最佳濃度;退火溫度采用 58,59,60,61,62℃,循環數采用40次;反應總體系采用25 μL。
1.2.4標準曲線建立 分別選取標準模板濃度梯度分別為103~107copies/μL的ASFV、CSFV、PRRSV標準模板為陽性模板,以去離子水為陰性對照模板,進行多重qPCR體系擴增。分別將結果分析繪制擴增曲線,使用Microsoft Office Excel 2013軟件繪制標準曲線。
1.2.5特異性試驗 用建立的多重qPCR方法分別檢測PEDV、TGEV、PCV2、PRV、PPV和JEV,驗證所建立的多重實時熒光定量PCR方法的特異性。
1.2.6敏感性試驗 選取濃度梯度為 100~108copies/μL 的標準質粒模板,使用DEPC H2O做10倍倍比稀釋后反轉錄獲得cDNA,作為陽性模板,以去離子水為陰性對照模板,進行擴增,探究其檢測下限。
1.2.7重復性試驗 選取標準模板濃度梯度為 104~106copies/μL 的標準模板為陽性模板,以雙蒸水為陰性對照模板,進行同一批次和不同批次的多重實時熒光定量 PCR 擴增,計算組內和組間變異系數。
1.2.8方法對比 本研究收集了自2019年12月至2020年1月來自湖北省6個規模化豬場的180份樣品(組織樣2份、口腔液34份、全血144份),分別使用OIE推薦的ASFV qPCR檢測方法和CSFV RT-qPCR、PRRSV-qPCR國標檢測方法與本研究建立的多重RT-qPCR進行比較。
1.3 ASFV、CSFV和PRRSV的病原學調查應用所建立的多重qPCR方法檢測 2019年12月至2020年1月份送檢的 839 份保育和育肥階段豬只的抗凝血樣品,調查ASFV、CSFV、PRRSV 3種病原的流行情況和特點,并使用卡方檢驗進行顯著性分析。
2 結果
2.1 重組質粒的制備將過夜培養的菌液提取質粒作為模版,使用標準質粒引物進行常規 PCR 檢測,結果均為預期大小目的片段,PRRSV-ORF6:414 bp,CSFV-5′UTR:373 bp(圖1),其中ASFV-B602L質粒由本實驗室保存(1.39×1010copies/μL)。經測序均與目的基因相符。所構建的CSFV質粒的濃度為1.65×1010copies/μL,PRRSV質粒的濃度為2.62×1010copies/μL。
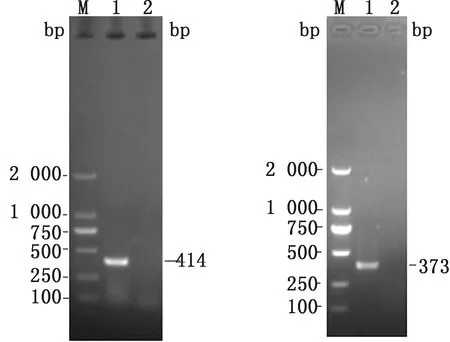
左.PRRSV-ORF6;右.CSFV-5′UTR。M.DL2000 DNA Marker;1.PCR 產物;2.陰性對照圖1 質粒PCR產物電泳圖
2.2 反應條件的優化通過對引物和探針濃度及退火溫度進行優化,選擇熒光強度高,Ct值較小、擴增效率接近100%,非特異性信號未出現時最大循環數的條件。在調整其他影響因素的過程中,不同退火溫度差異較小,最終選擇為60℃。ASFV、CSFV、PRRSV引物的最佳濃度均為0.48 μmol/L,探針濃度均為0.40 μmol/L,結果見圖2~4。
2.3 標準曲線建立以優化的反應條件(體系25 μL:Mix 12.5 μL、引物和探針各1 μL(濃度分別為0.48和0.40 μmol/L)、質粒1 μL、H2O 5.5 μL,溫度:60℃)。標準模板的擴增曲線及相應的標準曲線見圖5~7。在 101~108copies/μL 的梯度濃度區間內,顯示良好的線性關系,所得拷貝數(x)與Ct 值(y)的線性方程以及相關系數R2為:
ASFV:y=-3.558x+38.88,R2=0.998;
CSFV:y=-3.155x+39.55,R2=0.992;
PRRSV:y=-3.143x+38.23,R2=0.999。

左.ASFV引物;右.ASFV探針圖2 ASFV引物/探針濃度優化
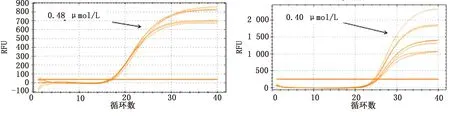
左.CSFV引物;右.CSFV探針圖3 CSFV引物濃度優化
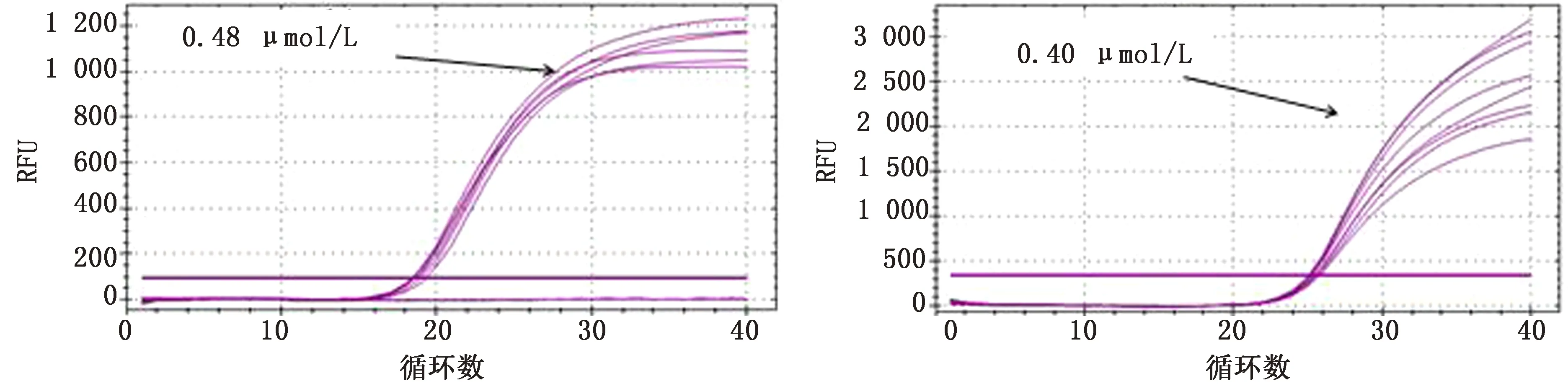
左.PRRSV引物;右.PRRSV探針圖4 PRRSV引物濃度優化

左.擴增曲線;右.標準曲線圖5 ASFV擴增曲線及標準曲線
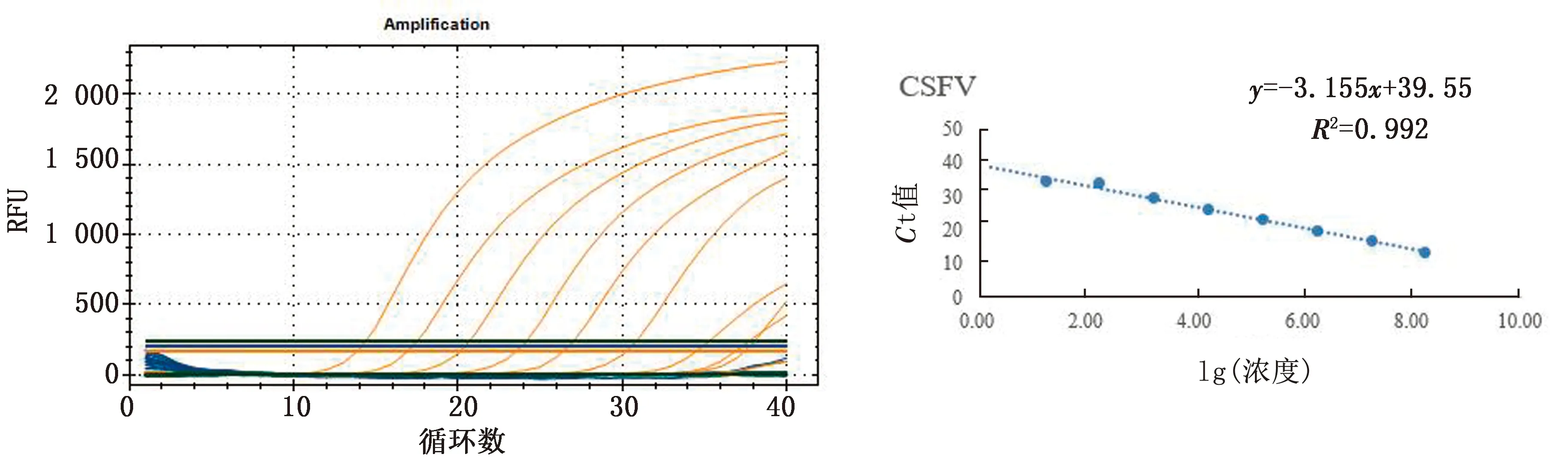
左.擴增曲線;右.標準曲線圖6 CSFV擴增曲線及標準曲線

左.擴增曲線;右.標準曲線圖7 PRRSV擴增曲線及標準曲線
2.4 特異性試驗分別以 PEDV、JEV、TGEV、PRRSV、CSFV、PPV、PCV2 和 PRV 的核酸為反應模板,用所建方法擴增,結果表明只有陽性模板有熒光信號(圖8),說明所建方法特異性良好。

1.ASFV;2.CSFV;3.PRRSV;4~11.分別為PCV2、PCV3、PRV、JEV、FMDV、PED、TGE、PDCoV;12.陰性對照圖8 特異性試驗
2.5 敏感性試驗選取標準模板濃度梯度為100~108copies/μL的標準模板進行多重實時熒光定量 PCR 擴增擴增,結果顯示,多重qPCR方法檢測ASFV、CSFV、PRRSV的拷貝數最低分別為 13,16,26個拷貝,說明所建方法靈敏性高(圖9~11)。
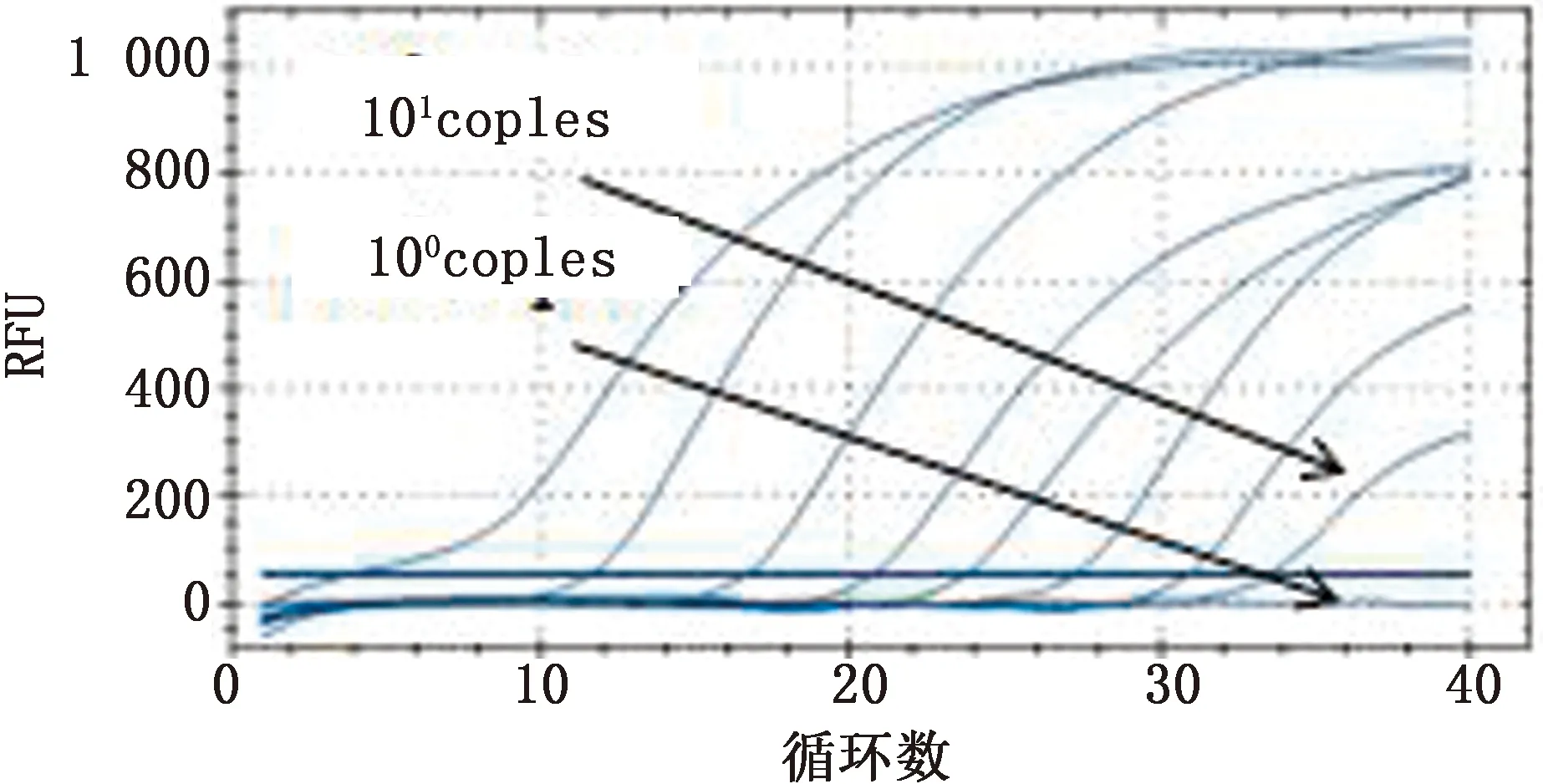
圖9 ASFV靈敏性實驗
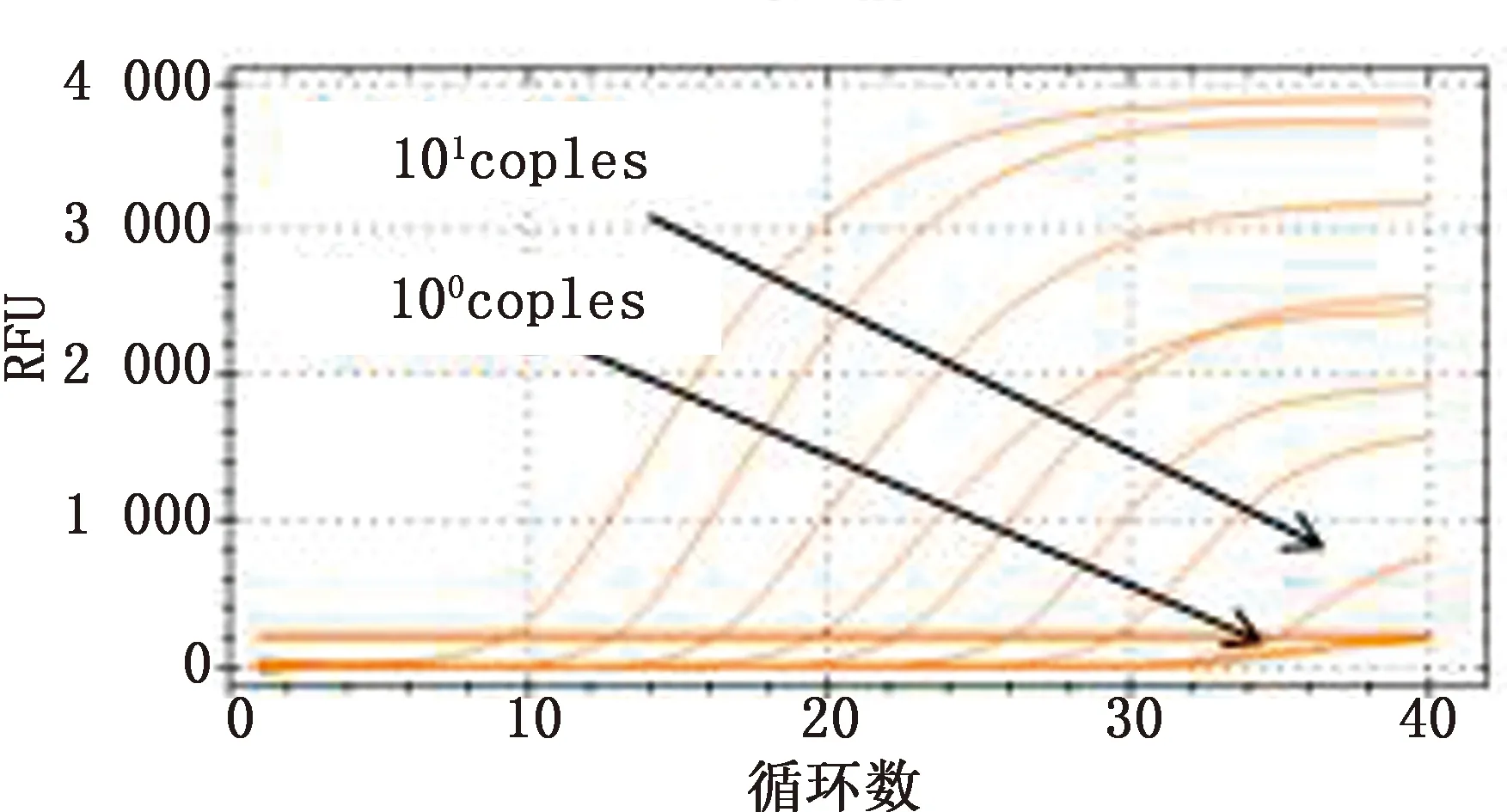
圖10 CSFV靈敏性試驗

圖11 PRRSV靈敏性試驗
2.6 重復性試驗選取104~106copies/μL 的標準模板進行組內、組間重復試驗,結果見表8。結果表明變異系數均在2%以下,說明所建立的多重實時熒光定量PCR方法在重復性方面表現優秀。
表8 重復性試驗結果
2.7 方法對比OIE ASFV qPCR與所建方法均未檢出ASFV陽性核酸。
國標CSFV RT-qPCR檢出核酸陽性37份,陰性143份;所建方法檢出CSFV陽性核酸35份,陰性145份。其中35份陽性樣品、143份陰性樣品結果一致,共2份樣品檢測結果不一致。敏感性性為94.59%(35/37),特異性為100.00%(143/143),總符合率為98.89%。
PRRSV多重RT-qPCR檢出陽性核酸41份,陰性139份;所建方法檢出PRRSV陽性核酸40份,陰性140份。其中份38陽性樣品、137份陰性樣品結果一致,共5份樣品結果不一致。敏感性為92.68%(38/41),特異性為98.56%(137/139),總符合率為97.22%(177/180)。CSFV與PRRSV混合感染4份,結果完全一致。
2.8 臨床應用對2019年12月至2020年1月華中農業大學動物疫病診斷中心收到的來自湖北省、湖南省、江西省14家規模化豬場的保育及育肥階段的839份抗凝血樣品進行檢測。
在共計檢測樣品839份中,使用本研究建立的檢測方法,共檢出ASFV陽性核酸0份,陽性率0.00%;CSFV陽性核酸103份,陽性率12.28%;PRRSV陽性核酸249份,陽性率29.68%。混合感染份27,混合感染率3.22%(圖12)。
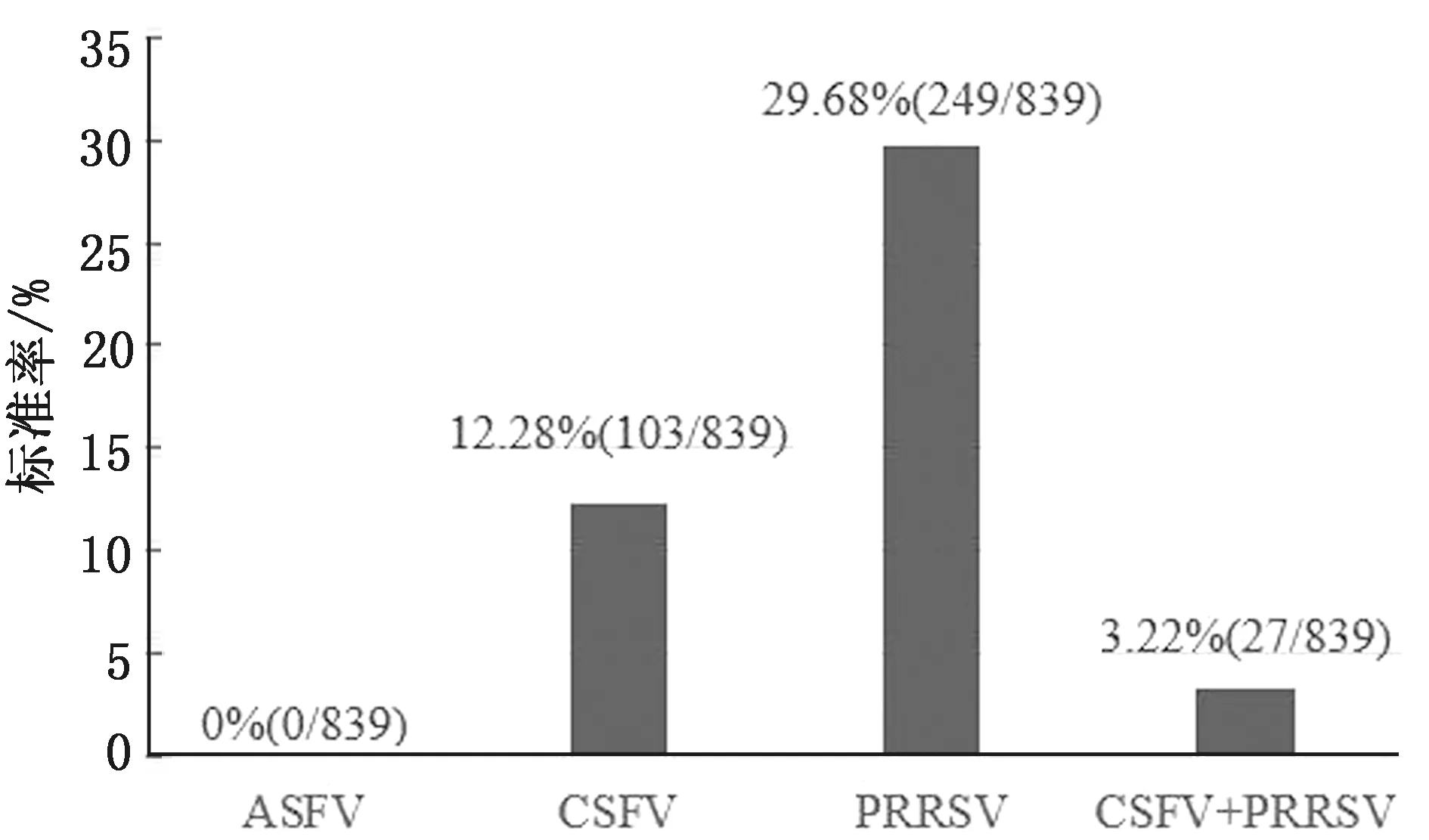
圖12 ASFV、CSFV、PRRSV及混合感染檢出率
3 討論
3.1 方法的建立本研究設計的通用型檢測方法,對可疑樣品進行初步檢測,針對陽性樣品須再進行測序依據基因組分析進行分型[5-6],這與目前大部分實驗室檢測工作方向一致,并且本研究方法優勢在于可檢測多種病原。本研究以國標方法作為金標準,進行Kappa檢驗,結果表明所建方法具有較高的敏感性。
CSFV 5′UTR序列保守性很高,常根據這一區域設計特異性引物,進行感染CSFV的診斷工作。絕大多數已建立的RT-qPCR方案都使用高度保守的5′UTR作為CSFV檢測的目的基因[7]。本研究在設計引物時,參考了CSFV已報道的所有的亞型,從而盡可能地避免漏檢。在PRRSV基因組中,ORF6基因最為保守,其在歐洲型和美洲型毒株間同源性高于包括ORF7在內的其他片段[8],因此本研究選用ORF6作為PRRSV通用型檢測的候選目的基因。
3.2 檢測樣品的選擇對于ASFV、CSFV、PRRSV這3種病原的檢測來說,血液樣品以及組織樣品具有較高的病毒載量[9-12],而口腔液樣品采樣更為便捷[13-15]。本研究在方法對比中選用了血液、口腔液和組織等樣品,可對比不同類型樣品檢測的效果,而在方法應用中血液樣品則能更加真實地反映臨床情況。
3.3 方法對比為了最大限度驗證本研究方法的可靠性,與國家標準方法或國家推薦診斷方法進行了對比試驗,結果表明該方法具有較高的敏感性和特異性。而本研究方法的優勢是可同時檢測3種病原,節省檢測的時間和成本。對于疾病凈化來說,漏檢可能引起嚴重的后果。本研究方法立足于通用型檢測,在具有較高靈敏性、特異性的同時,可檢測ASFV、CSFV、PRRSV各個亞型毒株,盡可能降低漏檢概率。
3.4 數據分析在對839個臨床樣品的檢測結果中,PRRSV檢出率最高達到29.68%,CSFV為12.28%,CSFV與PRRSV混合感染率為3.22%。
綜上所述,本研究建立了可以同時檢測ASFV、CSFV、PRRSV的多重qPCR方法,為用于臨床監測、鑒別和凈化ASF、CSF、PRRS這3種豬病提供了有效支持。從臨床應用中的結果整體來看,CSFV、PRRSV總核酸檢出率穩定。

