血尿酸與B型腦鈉肽在腦卒中患者預后評估中的作用分析
魏越
(睢縣人民醫院神經內科二病區,河南 商丘,476900)
腦卒中是神經內科的常見疾病,包括出血性卒中和缺血性卒中兩類,此類疾病的預后較差,患者死亡率高,盡管目前腦卒中已經有著較為完善的治療手段,但仍有患者因此類疾病死亡,或生存質量受到嚴重影響,尋求評估腦卒中預后的相關指標,對于此類疾病的預防、治療都有著十分重要的意義[1]。
尿酸(Uric acid,UA)屬于嘌呤核酸在人體內代謝后的最終產物,目前研究認為UA與多種免疫反應、炎癥反應有著密切的相關性,血清UA水平也與動脈粥樣硬化病變有一定的相關性[2]。B型腦鈉肽(Brain Natriuretic Peptide,BNP)是心、腦分泌的一種循環激素,BNP水平的異常 ,會影響機體的血管阻力,因此對心腦血管疾病都有一定的影響。
目前UA、BNP的研究主要集中在心肌梗死、冠心病等心血管系統疾病上,其與腦血管疾病的相關性研究較少。本文就血清UA、BNP水平在腦卒中患者預后評估中的作用進行研究分析,現報道如下。
1 資料與方法
1.1 一般資料
研究時間為2017年2月至2019年7月,選取期間收治的144例腦卒中患者作為對象開展研究,設為觀察組,選取同期的140例健康體檢者作為對照參考,設為對照組。
觀察組包括男性79例,女性65例,年齡43~76歲,平均58.5S7.3歲;對照組包括男性73例,女性67例,年齡41~74歲,平均58.1S6.9歲。兩組患者基本資料均衡可比(P>0.05)。本次研究經醫院倫理委員會審批通過。
納入標準:符合WHO腦卒中診斷標準;發病后72 h內入院;均為初診初治;年齡40~80歲之間;患者、家屬知情同意。
排除標準:入院昏迷或精神異常者;合并血液系統、免疫系統疾病者;合并嚴重臟器功能不全者;合并惡性腫瘤者;合并感染性疾病者;本次研究3個月內發生過急性心肌梗死者。
1.2 方法
觀察組患者入院后按照腦梗死常規方案進行治療,給予吸氧、溶栓、利尿、擴張血管、營養神經等藥物,連續用藥7 d,7 d后評價預后。對照組取體檢當天清晨空腹靜脈血3 mL,觀察組取入院當天(即治療前)、入院后3 d、入院后7 d時清晨空腹靜脈血3 mL,3000 r·min-1下離心5 min,取上清液,保存在-20 ℃待檢。采用磷鎢酸還原法進行血清UA水平測定,采用電化學發光免疫法進行血清BNP水平測定,檢驗試劑由杭州浙大迪迅生物基因工程有限公司提供,檢驗過程嚴格按照試劑說明書進行。
對比治療前觀察組、對照組的血清UA、BNP水平,并根據觀察組患者的預后情況進一步分組為預后良好組和預后不良組,采用美國國立衛生研究院卒中量表(National Institute of Health stroke scale, NIHSS)對患者的神經功能缺損情況進行評價,治療后NIHSS評分下降>70%或治療后評分<6分均視為預后良好,未達到以上標準包括死亡病例在內,均視為預后不良。對比不同預后患者在入院當天、入院后3 d、入院后7 d時的血清UA、BNP水平差異。
1.3 統計學方法
2 結果
2.1 觀察組、對照組血清UA、BNP水平
治療前觀察組患者的血清UA、BNP水平均明顯高于對照組(P<0.05)。見表1。
表1 觀察組、對照組血清UA、BNP水平對比(±SD)
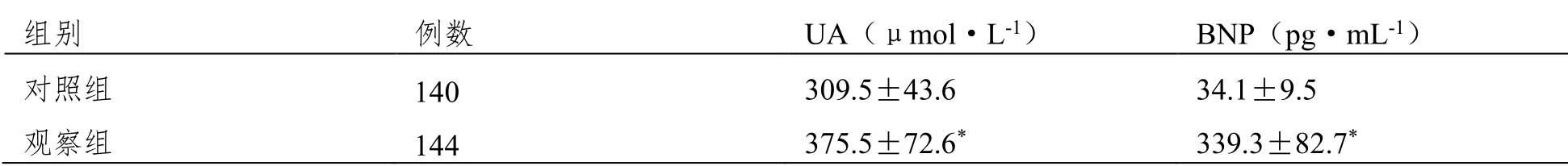
表1 觀察組、對照組血清UA、BNP水平對比(±SD)
注:與對照組相比,*P<0.05。
組別 例數 UA(μmol·L-1) BNP(pg·mL-1) 對照組 140 309.5±43.6 34.1±9.5 觀察組 144 375.5±72.6* 339.3±82.7*
2.2 不同預后患者的血清UA水平
144例患者預后良好86例,預后不良58例,入院當天、入院后3 d、入院后7 d時預后良好組UA、BNP明顯低于預后不良組(P<0.05)。表2。
表2 不同預后患者的血清UA、BNP水平對比(±SD)
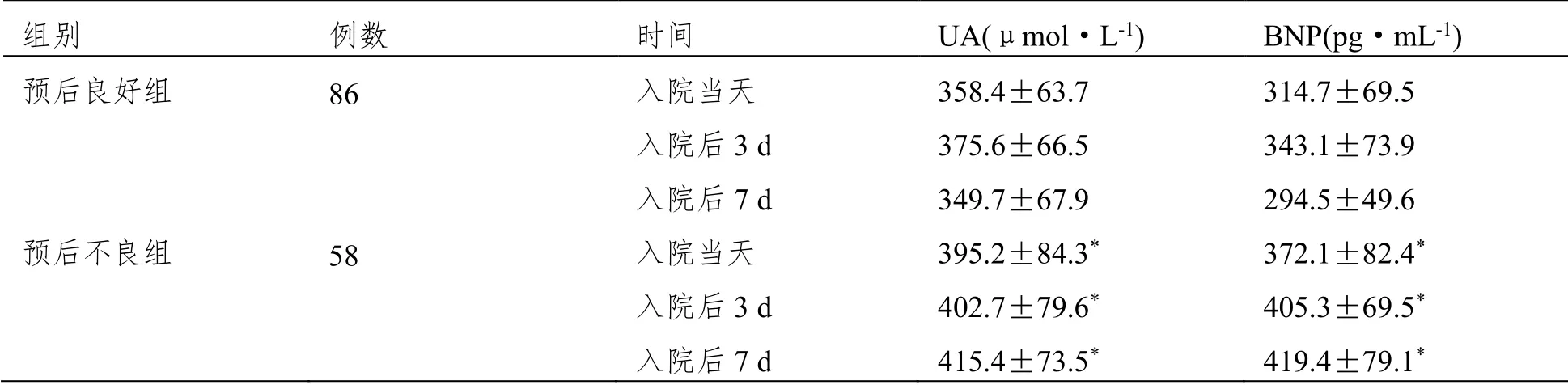
表2 不同預后患者的血清UA、BNP水平對比(±SD)
注:與預后良好組相比,*P<0.05。
組別 例數 時間 UA(μmol·L-1) BNP(pg·mL-1) 預后良好組 86 入院當天 358.4±63.7 314.7±69.5 入院后3 d 375.6±66.5 343.1±73.9 入院后7 d 349.7±67.9 294.5±49.6 預后不良組 58 入院當天 395.2±84.3* 372.1±82.4* 入院后3 d 402.7±79.6* 405.3±69.5* 入院后7 d 415.4±73.5* 419.4±79.1*
3 討論
腦卒中目前的預后評估,只能通過NIHSS量表等工具進行判斷,這種評估方法局限性較大,且敏感性有限,難以作為評估腦卒中預后的主要依據[3]。隨著分子生物學研究的不斷深入,腦卒中預后的評判也有更多的依據。
UA是機體發生免疫反應、炎癥反應的一個重要信號,UA能夠促進LDL-C的過氧化反應,這是導致動脈粥樣硬化發生的主要機制,同時UA還能夠參與到自由基的形成過程中,能夠促進血小板聚集,在心腦血管疾病的發生發展中有著重要的作用[4]。近年來的研究顯示[5],UA水平的異常增高,會導致血管內皮細胞功能損害,對各種心腦血管疾病都有著不良的影響。
BNP是腎素-血管緊張素-醛固酮系統的天然拮抗劑,主要由心室分泌,能夠降低循環阻力,既往研究表明,BNP的升高,會導致外周阻力和交感神經張力的下降,導致腦血流量降低,進而引發梗死區域的組織壞死,且BNP具有利尿的作用,會進一步導致血容量減少[6]。
既往對UA、BNP水平的研究,主要集中在心肌梗死、冠心病等心血管疾病上,目前已有較多文獻證實UA、BNP水平與缺血性心臟病的預后相關[7-8]。
從本次研究數據來看,觀察組患者的血清UA、BNP水平均顯著高于對照組。說明腦卒中患者伴隨血清UA、BNP水平的異常增高。從預后情況來看,入院當天、入院后3 d、入院后7 d時預后良好組的UA和BNP水平明顯低于預后不良組。這說明血清UA、BNP水平的異常增高反應腦卒中患者的預后變差。
從數據可以看出,預后良好組患者入院7 d后的UA、BNP水平得到有效控制,逐漸降低,而預后不良組患者的UA、BNP水平表現出持續增高的趨勢,這說明經過治療患者的炎癥反應并未得到有效控制,腦組織供血仍未得到改善,因此患者預后較差。
綜上所述,腦卒中患者的血清UA、BNP水平明顯增高,且UA、BNP水平與患者的預后有關,應當引起臨床重視。
Adjustable intragastric balloon for treatment of obesity: a multicentre, open-label, randomised clinical trial
Barham K Abu Dayyeh, et al.
Background: Intragastric balloons are anatomy-preserving, minimally invasive obesity therapies. Enhanced tolerance and durability could help broaden clinical adoption. We investigated the safety and efficacy of an adjustable intragastric balloon (aIGB) in adults with obesity.
Methods: In this prospective, multicentre, open-label, randomised clinical trial done at seven US sites, adults aged 22-65 years with obesity were randomly assigned (2:1) to aIGB with lifestyle intervention or lifestyle intervention alone (control) for 32 weeks. Balloon volume could be increased to facilitate weight loss or decreased for tolerability. Coprimary endpoints included mean percentage total bodyweight loss and responder rate (≥5% total bodyweight loss) at 32 weeks. We used a multiple imputed intention-to-treat population analysis. This study was registered with ClinicalTrials.gov, NCT02812160.
Findings: Between Aug 9, 2016, and Dec 7, 2018, we randomly assigned 288 patients to aIGB (n=187 [65%]) or control (n=101 [35%]) groups. Mean total bodyweight loss at 32 weeks was 15·0% (95% CI 13·9-16·1) in the aIGB group versus 3·3% (2·0-4·6) in the control group (p<0·0001). Clinical response was observed in 171 (92%) patients in the aIGB group. Adjustments to the aIGB occurred in 145 (80%) patients for weight loss plateau or intolerance. Upward volume adjustment facilitated an additional mean 5·2% total bodyweight loss. Downward volume adjustment allowed 21 (75%) patients in the aIGB group to complete the full duration of therapy. Intolerance caused early removal of the device in 31 (17%) patients. No micronutrient deficiencies were observed in the aIGB cohort. Device-related serious adverse events were observed in seven (4%) patients, without any deaths.
Interpretation: When aIGB was combined with lifestyle modification, significant weight loss was achieved and maintained for 6 months following removal. Balloon volume adjustability permitted individualised therapy, maximising weight loss and tolerance.
Funding: Spatz Medical.
Lancet. 2021 Nov 15;S0140-6736(21)02394-1. doi: 10.1016/S0140-6736(21)02394-1.

