增加餐后體能活動對于初發2 型糖尿病患者代謝基因表觀遺傳的影響
林如海 ,柯智元 ,陳曉珊 ,劉麗云 ,黃銀瓊 ,黃惠斌
1.福建醫科大學附屬第二醫院內分泌與代謝病科,福建泉州 362000;2.福建醫科大學附屬第二醫院臨床營養科,福建泉州362000;3.廈門大學附屬中山醫院感染科,福建廈門 361004;4.泉州市第一醫院兒科,福建泉州 362000
2 型糖尿病(type 2 diabetes mellitus, T2DM)是一種以高血糖為主要特征的慢性代謝性疾病,長期高血糖狀態可導致多種糖尿病慢性并發癥,嚴重降低人們生活質量[1]。近年來,2 型糖尿病的患病率在全球范圍內迅速增加。我國T2DM 的患病率已從2013 年的10.4%[2]增加至2018 年的 11.2%[3]。 因此,深入探究 T2DM 的發病機制對該疾病的治療及預后意義深遠。 除藥物治療外,飲食、運動等生活方式干預有利于降低T2DM 高危人群的發病風險。有研究指出,基因-環境相互作用可能通過表觀遺傳學機制影響機體胰腺β 細胞功能和外周組織的胰島素抵抗狀態而導致糖尿病的發生發展[5-6]。 表觀遺傳學是指通過細胞分裂實現代間遺傳而不改變DNA遺傳物質堿基序列的現象,其機制失調可能導致T2DM等多種疾病[7]。 其中尤以DNA 甲基化為最重要的一種表觀遺傳修飾方式。 最新研究報道提示體能運動可影響T2DM 相關基因的DNA 甲基化[8]。 因此該研究選取2018 年 12 月—2020 年 12 月該院收治的 40 例初發 2型糖尿病患者作為研究對象,旨在探討增加餐后體能活動對于初發2 型糖尿病患者代謝基因的表觀遺傳影響,從表觀遺傳學層面上探討體能活動在初發T2DM發生發展中的作用,為臨床診治T2DM 提供思路和線索,現報道如下。
1 資料與方法
1.1 一般資料
選取該院收治的40 例初發2 型糖尿病患者作為研究對象。 其中男性 22 例(55%),女性 18 例(45%),平均年齡為45 歲。 該研究已獲得醫院醫學倫理委員會批準,且患者均知曉并同意研究內容。
1.2 納入與排除標準
納入標準:①初發成人2 型糖尿病患者,符合WHO提出的關于T2DM 診斷及分型標準;②年齡18~65 歲(包括界值);③HbA1c≥6.5%;④愿意接受餐后體能活動的人員;⑤未曾接受降糖藥物治療。
排除標準:①合并認知功能障礙或無法正常交流者;②合并嚴重糖尿病急性及慢性并發癥者;③存在運動禁忌證者;④合并心、肝、腎等嚴重器質性疾病者;⑤依從性極差或無法遵從研究方案者;⑥合并高血壓者,即收縮壓≥140 mmHg 和/或舒張壓≥90 mmHg;⑦三酰甘油≥5.6 mmol/L。
1.3 方法
全部患者入組后均提供糖尿病標準化飲食,在此基礎上每日增加三餐后體能活動,患者佩戴運動手環,于餐后0.5 h 進行快走或慢跑,每次運動時間≥10 min,持續運動兩周,所有患者均未應用降糖、降脂藥物治療。
1.3.1 臨床資料收集 收集患者的體質量、體質指數(BMI)、血壓[舒張壓(DBP)、收縮壓(SBP)]、腰圍、臀圍等數據資料。 隔夜禁食至少10 h,抽取所有患者晨空腹靜脈血15 mL,取5 mL 血液標本用于測量糖化血紅蛋白(HbA1c)、空腹血糖(FPG)、空腹胰島素(FINS)、總膽固醇(TC)、低密度脂蛋白膽固醇(LDL-C)、三酰甘油(TG)等生化指標,并利用公式計算 HOMA-IR(HOMA-IR=FINS×FPG/22.5)。取10 mL 血液標本采用二代測序分析法進行炎癥及代謝基因(TFAM、FOXA2、CCL2、ICAM1、POMC、NPY、LEP、TH、DAT、GLUT 4、miR-138、miR-15b、miR-376a、miR-130b)的表觀遺傳檢測。 增加餐后體能運動兩周后,重新檢測上述指標。
1.3.2 二代測序分析 提取運動干預前后患者的外周血白細胞DNA,應用重亞硫酸鹽測序法(BSP 法)檢測相關炎癥及代謝易感基因的DNA 甲基化水平,比較體能運動干預前后DNA 甲基化水平差異。
1.4 觀察指標
①比較增加餐后體能活動前后患者的腰圍、臀圍、體質量、BMI 的變化差異。②比較增加體能活動前后患者的血糖、血脂、血壓水平變化差異。 ③比較增加體能活動前后患者上述炎癥及代謝基因的甲基化水平變化差異。 ④比較基線狀態下不同HbA1c 組別之間上述炎癥或代謝基因的甲基化水平差異。
1.5 統計方法
采用SPSS 18.0 統計學軟件進行數據分析,計量資料以()表示,采用 t 檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 增加餐后體能活動前后一般資料比較
增加餐后體能活動后,患者的血糖、血脂、血壓改善均優于增加體能活動前,差異有統計學意義(P<0.05)。而腰圍、臀圍、體質量、BMI 與增加體能活動前比較,差異無統計學意義(P>0.05)。 見表 1。
表1 增加體能活動前后一般資料比較()
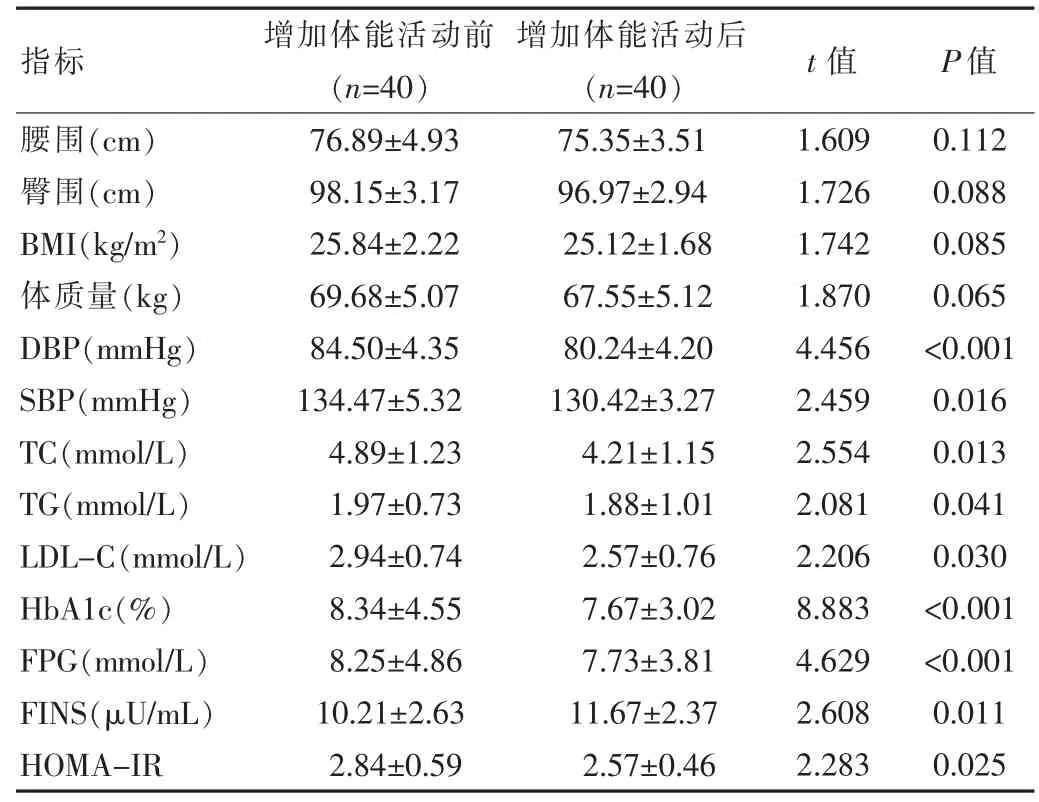
表1 增加體能活動前后一般資料比較()
指標 增加體能活動前(n=40)增加體能活動后(n=40) t 值 P 值腰圍(cm)臀圍(cm)BMI(kg/m2)體質量(kg)DBP(mmHg)SBP(mmHg)TC(mmol/L)TG(mmol/L)LDL-C(mmol/L)HbA1c(%)FPG(mmol/L)FINS(μU/mL)HOMA-IR 76.89±4.93 98.15±3.17 25.84±2.22 69.68±5.07 84.50±4.35 134.47±5.32 4.89±1.23 1.97±0.73 2.94±0.74 8.34±4.55 8.25±4.86 10.21±2.63 2.84±0.59 75.35±3.51 96.97±2.94 25.12±1.68 67.55±5.12 80.24±4.20 130.42±3.27 4.21±1.15 1.88±1.01 2.57±0.76 7.67±3.02 7.73±3.81 11.67±2.37 2.57±0.46 1.609 1.726 1.742 1.870 4.456 2.459 2.554 2.081 2.206 8.883 4.629 2.608 2.283 0.112 0.088 0.085 0.065<0.001 0.016 0.013 0.041 0.030<0.001<0.001 0.011 0.025
2.2 增加體能活動前后炎癥及代謝基因甲基化比較
增加體能活動后,患者的 POMC、GLUT 4、miR-138、miR-15b、miR-376a、miR-130b6 個基因的甲基化程度均較前降低;而 TFAM、FOXA2、CCL2、ICAM1、LEP、DAT6 個基因的甲基化程度均較前升高,差異有統計學意義(P<0.05)。NPY、TH 基因的甲基化程度與增加體能活動前比較,差異無統計學意義(P>0.05)。 見表 2。
表2 增加體能活動前后基因甲基化比較()
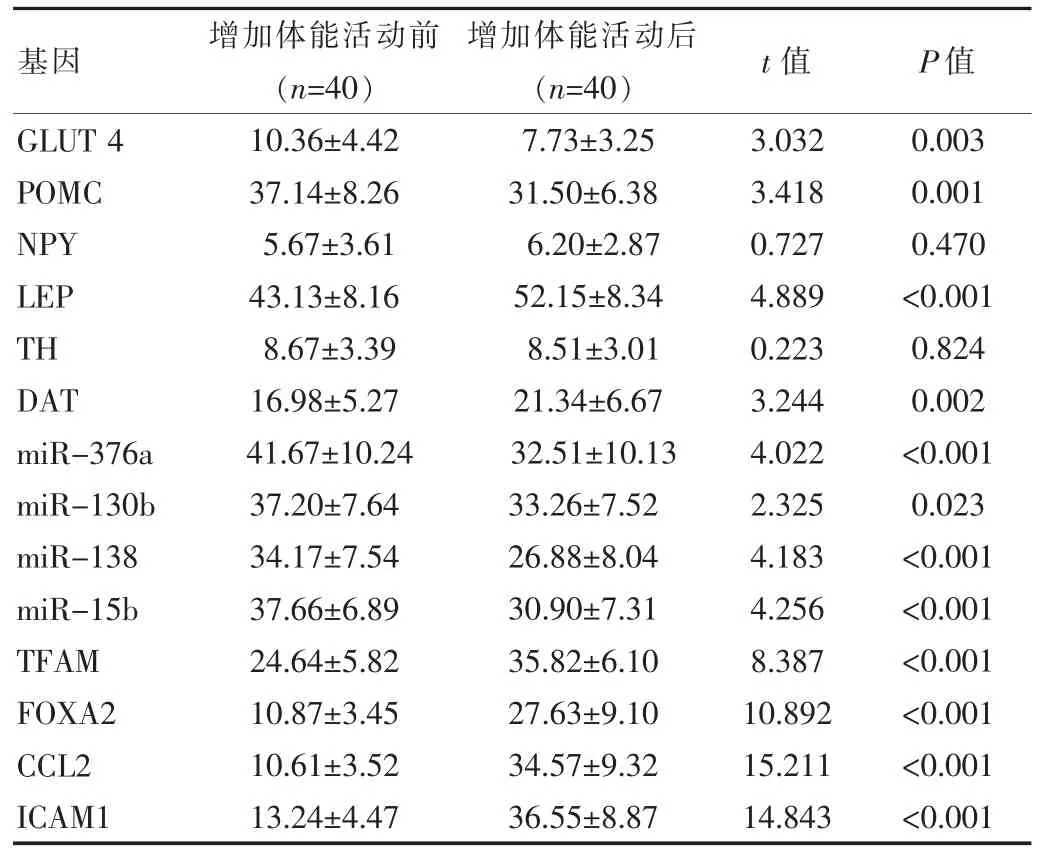
表2 增加體能活動前后基因甲基化比較()
基因 增加體能活動前(n=40)增加體能活動后(n=40) t 值 P 值GLUT 4 POMC NPY LEP TH DAT miR-376a miR-130b miR-138 miR-15b TFAM FOXA2 CCL2 ICAM1 10.36±4.42 37.14±8.26 5.67±3.61 43.13±8.16 8.67±3.39 16.98±5.27 41.67±10.24 37.20±7.64 34.17±7.54 37.66±6.89 24.64±5.82 10.87±3.45 10.61±3.52 13.24±4.47 7.73±3.25 31.50±6.38 6.20±2.87 52.15±8.34 8.51±3.01 21.34±6.67 32.51±10.13 33.26±7.52 26.88±8.04 30.90±7.31 35.82±6.10 27.63±9.10 34.57±9.32 36.55±8.87 3.032 3.418 0.727 4.889 0.223 3.244 4.022 2.325 4.183 4.256 8.387 10.892 15.211 14.843 0.003 0.001 0.470<0.001 0.824 0.002<0.001 0.023<0.001<0.001<0.001<0.001<0.001<0.001
2.3 不同HbA1c 分組的基因甲基化比較
增加體能活動前不同HbA1c 分組之間的炎癥及代謝基因的甲基化水平比較,差異無統計學意義(P>0.05)。見表3。
表3 不同HbA1c 分組的基因甲基化比較()
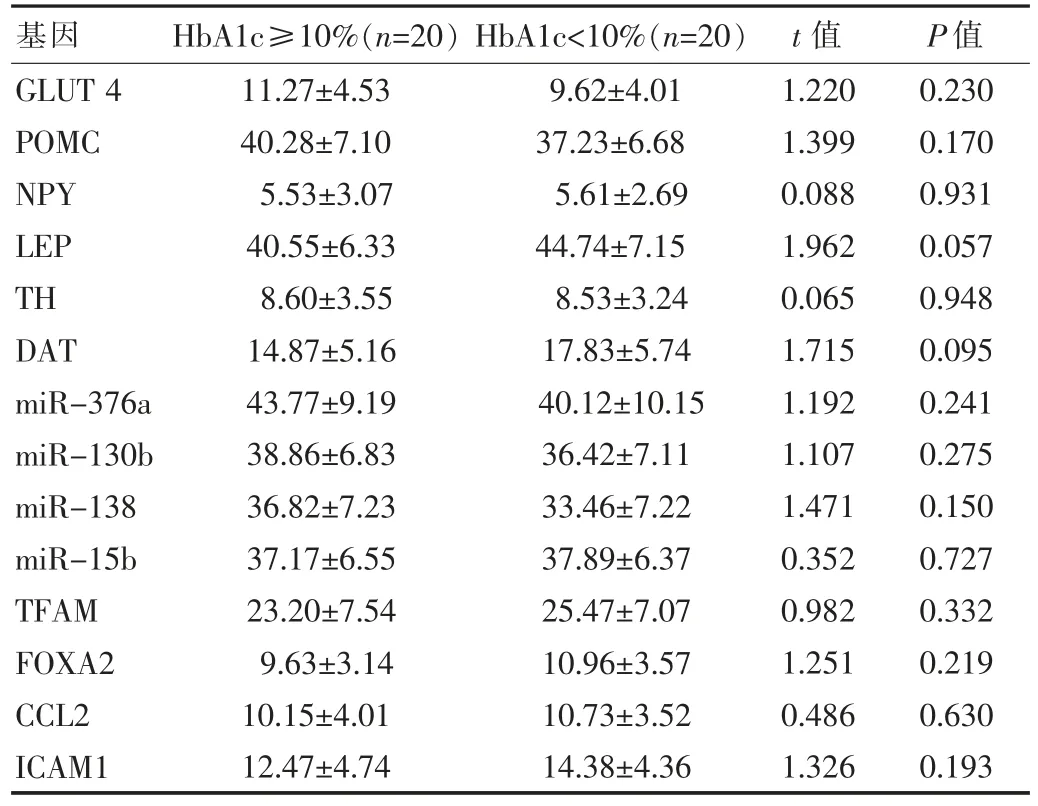
表3 不同HbA1c 分組的基因甲基化比較()
基因 HbA1c≥10%(n=20) HbA1c<10%(n=20) t 值 P 值GLUT 4 POMC NPY LEP TH DAT miR-376a miR-130b miR-138 miR-15b TFAM FOXA2 CCL2 ICAM1 11.27±4.53 40.28±7.10 5.53±3.07 40.55±6.33 8.60±3.55 14.87±5.16 43.77±9.19 38.86±6.83 36.82±7.23 37.17±6.55 23.20±7.54 9.63±3.14 10.15±4.01 12.47±4.74 9.62±4.01 37.23±6.68 5.61±2.69 44.74±7.15 8.53±3.24 17.83±5.74 40.12±10.15 36.42±7.11 33.46±7.22 37.89±6.37 25.47±7.07 10.96±3.57 10.73±3.52 14.38±4.36 1.220 1.399 0.088 1.962 0.065 1.715 1.192 1.107 1.471 0.352 0.982 1.251 0.486 1.326 0.230 0.170 0.931 0.057 0.948 0.095 0.241 0.275 0.150 0.727 0.332 0.219 0.630 0.193
3 討論
研究表明,環境因素改變引發的表觀遺傳修飾如甲基化改變可影響多種與糖尿病相關基因的表達, 使胰島素分泌減少和發生抵抗[9-10]。 餐后運動有利于改善高血糖,是預防和延緩T2DM 發生和發展進程的重要干預方式。 該研究從表觀遺傳水平上探討初發T2DM 患者增加餐后體能活動的作用,為臨床預防糖尿病提供理論依據。
該研究結果顯示,增加體能活動后,患者的血糖、血脂、血壓改善均優于增加體能活動前。 由于該研究中采取的運動干預方式較為溫和,且持續時間僅為兩周,故患者腰圍、BMI 等指標雖有所降低,但差異無統計學意義。 T2DM 是環境與遺傳因素共同作用的結果,但有研究指出,不良的生活方式誘發T2DM 的風險較遺傳因素更高[11-15]。 運動作為一種綠色健康的生活方式,在糖尿病預防中的作用非常重要。
該研究中,增加體能活動后POMC、GLUT 4、miR-138、miR-15b、miR-376a、miR-130b 6 個基因的甲基化程度均降低;而 TFAM、FOXA2、CCL2、ICAM1、LEP、DAT 6個基因的甲基化程度升高。 提示餐后體能活動能影響T2DM 患者相關基因的甲基化水平,與Margaryan S 等[16]的結論相似。一般情況下,基因高甲基化會抑制其表達,而低甲基化則可激活該基因表達[17]。 促A 片-黑素細胞皮質素原(POMC)基因、瘦素(LEP)基因為食欲調節因子。 研究表明,肥胖狀態下瘦素基因甲基化程度降低,同時存在瘦素表達增加及瘦素抵抗現象[18-19];而一項兒童研究提出POMC 高甲基化與空腹血脂及胰島素升高之間存在聯系。多巴胺轉運體蛋白(DAT)為參與多巴胺合成的因子,在高脂飲食喂養后于下丘腦呈低甲基化,上述三者均與肥胖有關。肥胖患者常處于低度的慢性炎癥狀態,而長期低度的慢性炎癥被證實為引發T2DM 與其他心血管疾病的重要原因。此外,miR-138、miR-15b、miR-376a、miR-130b 均是與肥胖及T2DM 有關的影響因子,其表達可抑制脂肪生成和減少脂質在脂肪細胞中的沉積。 而葡萄糖轉運蛋白4(GLUT 4)是胰島素敏感性葡萄糖轉運體,T2DM 患者體內GLUT 4 基因高甲基化改變了GLUT 4 水平,與胰島素抵抗及糖尿病的發病相關。 因此增加餐后體能活動可通過調控上述代謝基因甲基化水平而改善血脂、血糖及胰島素分泌,從而發揮體內代謝調節作用。
此外,研究證實,高糖環境誘導的炎癥基因甲基化下調進而促使炎癥因子的高表達可能是糖尿病發病的一種潛在機制。 線粒體轉錄因子TFAM 蛋白產生的減少與炎癥因子IL-6 表達增加有關。 單核細胞趨化因子CCL2 是一類促炎細胞因子,其與ICAM1 的甲基化與高糖環境引起的免疫因子有關。 當機體處于高糖狀態時,炎癥基因 TFAM、FOXA2、CCL2、ICAM1 甲基化程度下降,進一步激活上述炎癥介質表達增加,加劇T2DM 患者體內的慢性炎癥狀態。 而餐后體能活動能增加炎癥基因的甲基化程度,減少基因表達,改善機體內炎癥狀態,減緩T2DM 的進展速度。
綜上所述,增加餐后體能活動可能通過調控初發2型糖尿病患者代謝基因的甲基化程度而參與維持患者內分泌及代謝功能的穩態平衡,進而延緩初發2 型糖尿病的進展。因此,初發2 型糖尿病患者在飲食和藥物治療的基礎上,應進行科學的餐后體能活動,進一步調控血糖水平。 但該研究樣本量較小,結果可能存在局限性,故在未來仍需通過進一步的前瞻性大樣本研究以驗證。

