高通量分子測序技術在男性新生兒G6PD缺乏癥篩查中的應用研究*
楊金玲,陳大宇,黃麗華,韋江艷
廣西科技大學附屬婦產醫院/廣西科技大學附屬兒童醫院/廣西壯族自治區柳州市婦幼保健院新生兒疾病篩查中心,廣西柳州 545001
葡萄糖-6-磷酸脫氫酶(G6PD)缺乏癥是由于G6PD基因缺陷導致紅細胞膜的G6PD生成障礙。G6PD缺乏在某些誘因引起急性溶血性貧血,并導致高膽紅素血癥,新生兒期重癥可發展為核黃疸,導致腦癱[1-2]。由于G6PD基因突變與其表型之間的關系尚未完全明確、G6PD缺乏癥有明顯遺傳多樣、一些特殊病理狀態下G6PD酶活性并不降低和截斷值設置不合理等原因,致使男性新生兒G6PD缺乏癥并未全部檢出[3-4]。本研究采用高通量分子測序(NGS)技術檢測男性新生兒G6PD缺乏癥,探討男性新生兒G6PD基因型與表型的相關性,并合理設置男性新生兒G6PD酶活性篩查截斷值,為臨床診療提供依據。
1 資料與方法
1.1一般資料 隨機收集柳州市婦幼保健院新生兒疾病篩查中心男性新生兒足跟干濾紙血片1 092例。本項目通過柳州市婦幼保健院倫理委員會批準,監護人均簽署知情同意書。
1.2方法
1.2.1標本采集 出生72 h后采集男性新生兒足后跟血制成干濾紙血片,5個工作日內送檢。
1.2.2儀器與試劑 G6PD酶活性分析采用豐華公司的全自動時間分辨熒光免疫分析儀及配套分析試劑盒。采用Lab Aid 824核酸提取試劑及提取儀器提取干濾紙血片中的DNA 。采用NGS技術對G6PD基因外顯子2~13測序,不一致的結果采用多色探針熒光聚合酶鏈反應(PCR)熔解曲線法驗證(廈門致善生物G6PD基因檢測試劑盒) 。
1.3評估方法 G6PD酶活性<2.6 U/gHb,篩查結果為陽性。本研究檢出的G6PD基因變異,查詢公共數據庫gnomAD、千人項目中國人群、ExAC數據庫等,并通過多種計算機軟件預測該變異對基因或基因產物致病結論是否一致。PCR熔解曲線結果判讀按G6PD基因檢測試劑盒說明書進行。WHO根據G6PD缺乏癥患者酶活性等級及臨床表現,將G6PD缺乏癥分為5種類型:Ⅰ型酶活性最低,為0%;Ⅴ型酶活性最高,>200%;Ⅱ型酶活性小于正常酶活性的10%,患者有間斷溶血發作,尤其是在攝食蠶豆及其制品或藥物后誘發急性溶血,不伴慢性溶血;Ⅲ型酶活性為正常酶活性的10%~60%,少數抗瘧疾藥物(如伯氨喹)或感染(如傷寒、大葉性肺炎、肝炎)可誘發溶血;Ⅳ型酶活性大于正常酶活性的60%,無特殊臨床表現。通過WHO的G6PD基因突變分型數據庫可查詢突變基因所屬G6PD缺乏癥的類型。
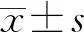
2 結 果
2.1NGS技術與酶活性檢測中假陰性結果分析 本研究共檢測1 092例男性新生兒,121例檢出G6PD基因突變:G6PD缺乏癥為X連鎖不完全顯性遺傳,男性檢測到突變基因即表現為G6PD酶活性降低,本地區男性新生兒G6PD缺乏癥陽性率為11.08%(121/1 092)。G6PD缺乏癥男性新生兒酶活性為(1.20±0.72)U/gHb,健康男性新生兒G6PD酶活性為(6.66±0.91)U/gHb。酶活性分析檢出G6PD酶活性缺乏114例,假陰性7例;NGS技術檢出G6PD基因變異115例,假陰性6例,見表1。NGS技術的靈敏度、特異度、陽性預測值和陰性預測值分別為95.04%、100.00%、100.00%和99.39%;G6PD酶活性分析的靈敏度、特異度、陽性預測值和陰性預測值分別為94.21%、100.00%、100.00%和99.28%。兩種檢測方法差異無統計學意義(P>0.05)。
2.2G6PD基因型與G6PD酶活性分析 本研究共檢測到7種G6PD基因突變,所有突變均已被報道。c.1388G>A等位基因型檢出率最高,占G6PD等位基因的41.32%,c.1376 G > T、c.95 A > G、c.1024 C > T、c.871 G > A、c.392 G > T和c.487G>A檢出率依次降低。最常見的4種變異位點c.1376G>T、c.95A>G、c.1388G>A、c.1024C>T酶活性依次增高,4種變異位點酶活性比較差異有統計學意義(F=16.2,P<0.05)。本地男性新生兒G6PD酶活性WHO分型為Ⅱ型和Ⅲ型,以Ⅱ型為主,占85.12%(103/121),見表2。
2.3ROC曲線分析男性新生兒G6PD缺乏篩查截斷值 對男性新生兒G6PD基因正常和基因突變標本的酶活性進行ROC曲線分析,約登指數最大為0.992 8,G6PD缺乏篩查截斷值<4.24 U/gHb為陽性標本,靈敏度為99.28%,特異度為100.00%,曲線下面積(AUC)為0.999,見圖1。

表1 NGS技術與G6PD酶活性檢測的假陰性結果比較
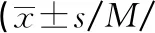
表2 G6PD基因型與G6PD酶活性檢測范圍)
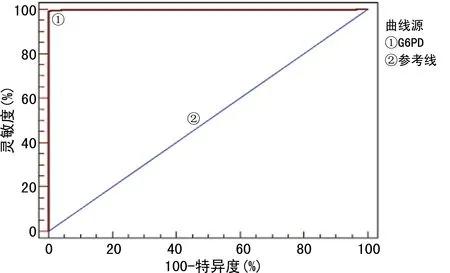
圖1 男性新生兒G6PD缺乏癥截斷值ROC曲線分析
3 討 論
G6PD缺乏癥為X連鎖不完全顯性遺傳,男性發病多于女性;G6PD缺乏癥患者臨床表現差異極大,重者可危及生命。有研究報道,本地區人群G6PD缺乏陽性率為7.66%,本研究中男性新生兒G6PD缺乏陽性率為11.08%,在G6PD缺乏癥發生率高的地區進行新生兒G6PD缺乏癥篩查具有重要意義[5-7]。
截至目前,已報道的G6PD基因突變超過210種,95%為點突變[8]。本研究中c.1388G>A、c.1376 G > T、c.95 A > G 和c.1024 C > T 4種突變基因型占95.04%,c.1388G>A突變基因型檢出率最高(41.32%),與其他地區報道的結果相似[9-10]。按照WHO分型,檢出的7種基因型變異屬于Ⅱ型或Ⅲ型[11]。除Ⅲ型變異c.487G>A的酶活性相對較低外,所有Ⅱ型變異的酶活性均遠遠低于Ⅲ變異,差異有統計學意義(P<0.05)。本研究Ⅱ型突變中,酶活性降低程度因基因型而異,c.1376G>T酶活性最低,c.95A>G、c.1388G>A 和c.871G>A酶活性依次升高。Ⅱ型突變酶活性范圍<10%,酶活性降低程度大,在本實驗室酶活性檢測中未出現假陰性結果[11]。Ⅲ型突變中檢測到1例c.487G>A變異,其G6PD酶活性最低,其余c.1024C>T、c.392G>T酶活性依次升高。
本研究中NGS技術和G6PD酶活性檢測中均出現假陰性結果。NGS技術的假陰性結果經驗證為常見的G6PD基因突變位點,G6PD酶活性檢測結果為陽性。理論上,NGS技術可檢出G6PD基因中常見變異,由于標本質量不合格、實驗過程中DNA含量不足及生物信息分析人員的熟練程度等亦可能出現假陰性結果。本研究中G6PD酶活性檢測假陰性結果均為Ⅲ型變異中c.1024C>T突變或c.392G>T突變。Ⅲ型酶活性缺乏不明顯甚至酶活性不缺乏的病例通常無法檢出,但這些病例仍然可以因為抗瘧疾藥物或感染等因素誘發溶血。在做好質量控制的基礎上,NGS技術可以彌補因不同基因突變導致酶缺乏程度不一或其他急性溶血情況下出現酶活性較高所致的漏檢。NGS技術靈敏度、特異度、陽性預測值和陰性預測值與G6PD酶活性檢測比較,差異均無統計學意義(P>0.05),兩種方法可互為補充。
本研究G6PD酶活性檢測中有7例男性新生兒使用常規截斷值無法檢出,可見篩查截斷值的設置很重要[12]。本研究發現,G6PD缺乏男性新生兒酶活性平均值為(1.20±0.72)U/gHb,健康男性新生兒G6PD酶活性為(6.66±0.91)U/gHb,二者酶活性基本不存在交叉。本研究取約登指數最大時的截斷值4.24 U/gHb,其靈敏度為99.28%,特異度為100.00%,AUC為0.999,以提高檢測男性新生兒G6PD缺乏癥檢出率。截斷值重新設定后,G6PD酶活性檢測可以檢出可疑Ⅱ型變異,通過G6PD基因檢測可確定是否攜帶致病基因,實現早診斷、早預防。
綜上所述,NGS技術可用于男性新生兒G6PD缺乏癥檢測,精準指導臨床早診斷、早預防;G6PD酶活性檢測截斷值設置合理時,價格低廉、快速且容易實施;兩種檢測方法結合臨床相關資料綜合判斷可用于臨床用藥指導、急性溶血鑒別診斷、預防新生兒核黃疸等。本研究僅探討NGS技術在男性新生兒G6PD缺乏癥篩查中的應用,女性新生兒G6PD缺乏癥篩查未做研究。由于女性有2條X染色體,并且X染色體隨機失活,存在不完全顯性遺傳,女性攜帶者酶活性可完全正常或稍微降低,生化檢測漏檢率高,今后應考慮NGS技術應用于急性溶血期患者及女性雜合子診斷。

