miR-181通過調控TGFBR1表達抑制顱內動脈瘤中平滑肌細胞的表型轉換*
王如科,孫源源,李克芬,李一帆,于國淵△
1.河北省邯鄲市中心醫院神經外科,河北邯鄲 056001 ;2 河北省邯鄲市第一醫院影像科,河北邯鄲 056001
顱內動脈瘤(IA)是腦動脈主要分叉的病理性擴張,是一種常見的腦血管疾病,急性病死率約為50%[1-2]。3%~5%的成年人患有未破裂的IA[3]。IA發生和破裂的機制仍不清楚,IA的病因可能與血流對血管壁的剪切力應激、炎癥、氧化應激和凋亡等因素有關。炎癥級聯反應觸發后大量炎癥因子和氧化因子被釋放,會導致許多病理過程,包括中膜彈力層中斷、血管平滑肌細胞(VSMC)表型轉換和細胞外基質重塑等[4-5]。當血管壁退化時,顱內動脈變得太薄弱,無法抵抗血液動態力,腦動脈管壁發生囊狀擴張。VSMC是血管壁中主要的細胞類型,VSMC有兩種表型:收縮型和合成型[6]。在炎癥和氧化應激等病理刺激下,收縮型VSMC可以轉換為合成型[7]。VSMC表型轉換在幾種心血管疾病中發揮重要作用[8]。microRNAs (miRNAs)是一種短鏈單鏈非編碼RNA,廣泛參與許多轉錄后調控過程,在調控各種細胞過程中發揮重要作用[9]。miRNAs除參與腫瘤的發生和發展外,也參與IA的發生和發展。有研究報道,miR-370-3p通過靶向IA中的KDR/AKT信號通路抑制平滑肌細胞增殖[10]。有研究發現,VSMC中miR-181的異常表達可能與動脈粥樣硬化和腦血管疾病的發生相關[11-12]。例如,在VSMC中血管緊張素Ⅱ(Ang Ⅱ)降低了miR-181的表達水平,過表達miR-181抑制了Ang Ⅱ誘導的合成表型基因骨橋蛋白(OPN)的表達和平滑肌細胞與膠原的黏附[13],提示miR-181可能通過調節OPN介導的VSMC功能,參與動脈粥樣硬化的病理生理過程。本研究旨在探究IA中miR-181在平滑肌細胞表型轉換中的作用,采用TargetScan預測其靶蛋白并驗證其作用機制。
1 資料與方法
1.1標本收集 收集邯鄲市中心醫院神經外科2016年11月至2019年5月確診為IA并進行手術的患者80例,并收集同期健康體檢中心年齡、性別匹配無IA家族史的健康對照者80例作為研究對象。手術中取出的IA組織在液氮中快速冷凍。收集接受開顱治療的創傷患者的正常顳淺動脈。本研究經邯鄲市中心醫院倫理委員會批準,所有研究對象均簽署知情同意書。
1.2主要材料 Trizol試劑購自美國Thermo公司,TaqMan反轉錄試劑盒購自日本Takara公司,實時熒光定量反轉錄聚合酶鏈反應(qRT-PCR)試劑盒購自美國 Biotuim 公司。miR-181模擬物(miR-181 mimics)由上海吉凱基因公司合成,人腦VSMC購自美國ScienCell公司。Lipofectamine 2000轉染試劑購自美國Thermo公司。α-平滑肌肌動蛋白(SMA)、平滑肌22α蛋白(SM22α)、β-actin抗體均購自武漢三鷹生物技術有限公司。OPN、基質金屬蛋白酶(MMP)-2、MMP-9抗體均購自美國Abcam公司。轉化生長因子β受體1(TGFBR1)的3′非翻譯區(3′-UTR)熒光素酶報告基因載體[TGFBR1野生型(wt)及突變型(mut)]由上海吉凱基因公司構建,雙熒光素酶活性檢測試劑盒購自上海翊圣生物科技有限公司。DMEM培養基、胎牛血清(FBS)均購自美國Gibco公司。辣根過氧化物酶標記的山羊抗兔二抗購自武漢三鷹生物技術有限公司。PVDF膜購自美國Mllipore公司。
1.3實時熒光定量聚合酶鏈反應(qPCR) IA患者和健康對照者均抽取空腹肘靜脈血約5 mL,室溫靜置30 min,3 000 r/min 離心5 min,吸取上清液置于-80 ℃冰箱保存。標本收集完畢后,向200 μL上清液中加入1 mL Trizol裂解液吹打混勻后室溫裂解5 min。每管中加入200 μL氯仿,室溫放置15 min,12 000 r/min,4 ℃離心15 min。吸取上清液加入等體積異丙醇,室溫放置10 min,12 000 r/min,4 ℃離心10 min,棄掉上清液,用1 mL 75%乙醇(DEPC水配制)重懸沉淀,8 000 r/min,4 ℃離心5 min,晾干沉淀。用去離子水溶解RNA。
將RNA進行反轉錄得到模板單鏈cDNA,然后采用 qPCR試劑盒對cDNA 進行qPCR。按照試劑盒說明書配制20 μL體系,收集熒光信號。每個樣品做3個復孔。Ct值為熒光信號達到設定閾值的循環數。用2-ΔΔCt法計算miR-181的相對表達水平。miR-181引物F:GCGAACATTCATTGCTGTCG;R:GCAC TGGATACGACACCCAC。用U6作為內參,U6引物F:GCGCGTCGTGAAGCGTTCT;R:CACTGGA TACGACAAATATG。
1.4細胞培養 人腦VSMC快速復蘇后,800 r/min離心5 min,棄掉凍存液,采用含10% FBS的DMEM高糖培養基重懸細胞,放置在37 ℃、5% CO2培養箱中培養,每隔2 d更換一次細胞培養基。當細胞生長至80%~90%融合時用0.25%胰酶進行消化,磷酸鹽緩沖液(PBS)沖洗3次后,細胞計數,以每孔1×105個接種到6孔培養板中,放置在37 ℃、5% CO2培養箱中繼續培養。
1.5細胞轉染 人腦VSMC呈對數生長期時,采用0.25%胰酶消化細胞,PBS沖洗3次,采用含10% FBS的DMEM高糖培養基重懸制成單個細胞懸液。細胞計數后以每孔1×105個鋪至6孔板中,分為miR-181 mimics和NC mimics,細胞貼壁18~24 h后,按照Lipofectamine 2000說明書將miR-181 mimics和NC mimics分別與無血清培養基混勻后加入各組待轉染的細胞中,置于培養箱中培養48 h后進行后續實驗。
1.6Western bolt 收集轉染完成的細胞,每孔中加入100 μL蛋白裂解液,在冰上裂解20 min。加入適量上樣緩沖液,以100 ℃水浴煮沸5 min使蛋白變性。按照50 μg總蛋白加入上樣孔進行十二烷基硫酸鈉聚丙烯酰胺凝膠電泳,轉膜封閉完成后,在4 ℃冰箱孵育一抗過夜,第2天洗膜后孵育相應的二抗,洗膜后進行增強化學發光法。條帶用Image J進行灰度值半定量計算,采用β-actin作為內參,分析各目的蛋白的相對表達水平。
1.7熒光素酶報告基因實驗 取對數生長期的人腦VSMC,接種于24孔板中(每孔細胞2×104個),培養至細胞達70%~80%融合時將TGFBR1的3′-UTR熒光素酶報告基因載體及NC mimics導入細胞,分為4組,每組設置3個復孔:miR-181 mimics+TGFBR1-wt共轉染組;miR-181 mimics+TGFBR1-mut共轉染組;NC mimics+TGFBR1-wt共轉染組;NC mimics+TGFBR1-mut共轉染組。培養24 h后棄去培養液,用預冷的PBS沖洗2次后,加入100 μL 1×被動裂解液,孵育15 min后每孔吸取20 μL上清液加入96孔發光檢測板中,放入發光檢測儀中讀數,數據用GrahPad Prism 8進行作圖與分析。
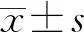
2 結 果
2.1IA患者和健康對照者血清miR-181表達水平比較 采用qPCR檢測IA患者和健康對照者血清miR-181表達水平,結果顯示,IA患者血清miR-181表達水平與健康對照者比較明顯降低,差異有統計學意義(P<0.05),見圖1。
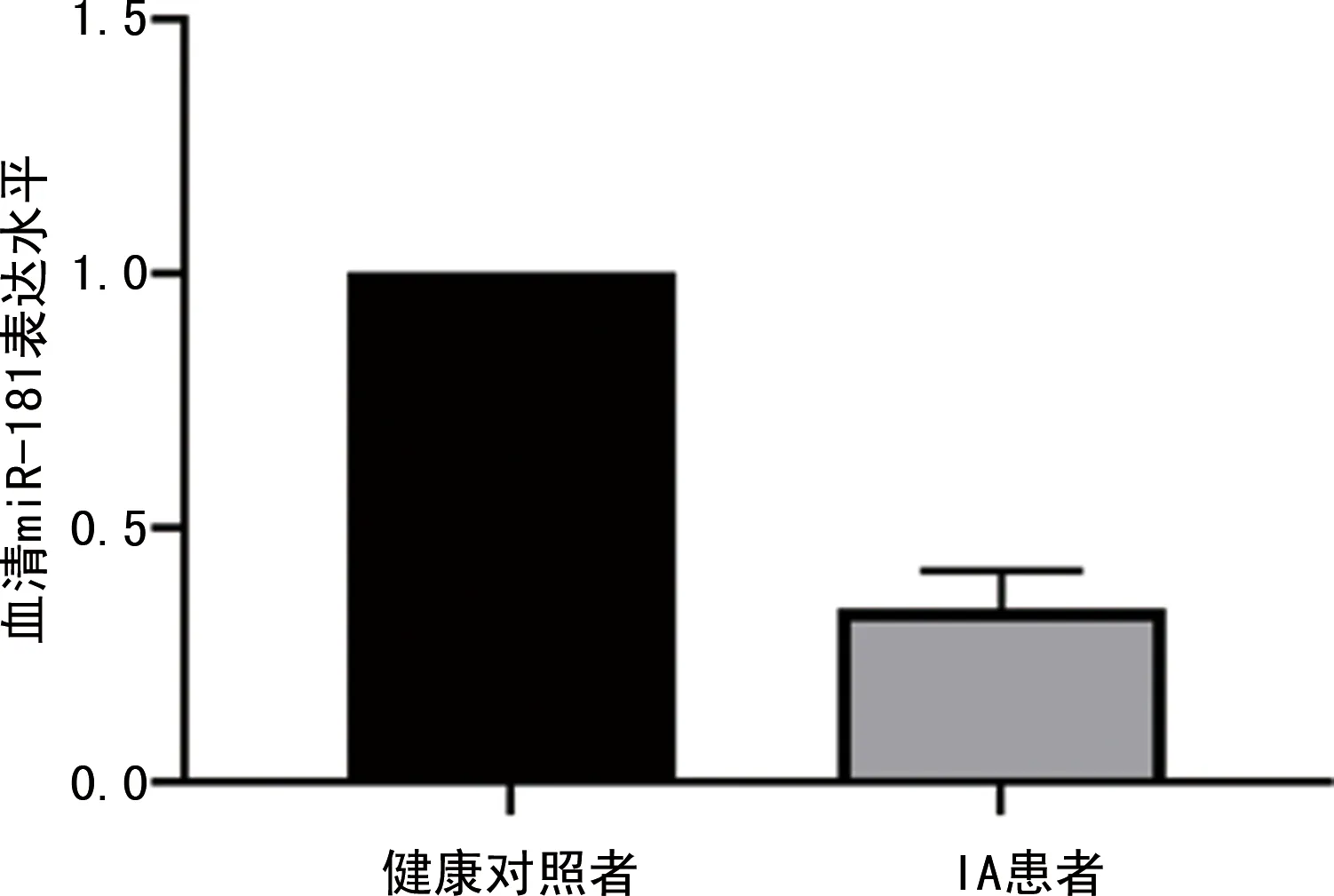
圖1 IA患者和健康對照者血清miR-181表達水平
2.2miR-181抑制VSMC表型轉換 人腦VSMC細胞轉染miR-181 mimics和miR-181抑制劑(miR-181 inhibitor)后采用Western bolt檢測VSMC收縮表型基因SMA和SM22α及合成表型基因OPN的表達水平,以及其分泌的MMP-2和MMP-9的表達水平,結果顯示,轉染miR-181 mimics升高了SMA和SM22α的表達水平,降低了OPN的表達水平,同時MMP-2、MMP-9的表達水平也降低。轉染miR-181 inhibitor降低了SMA和SM22α的表達水平,上調了OPN的表達水平,同時MMP-2、MMP-9的表達水平也上調。見圖2。
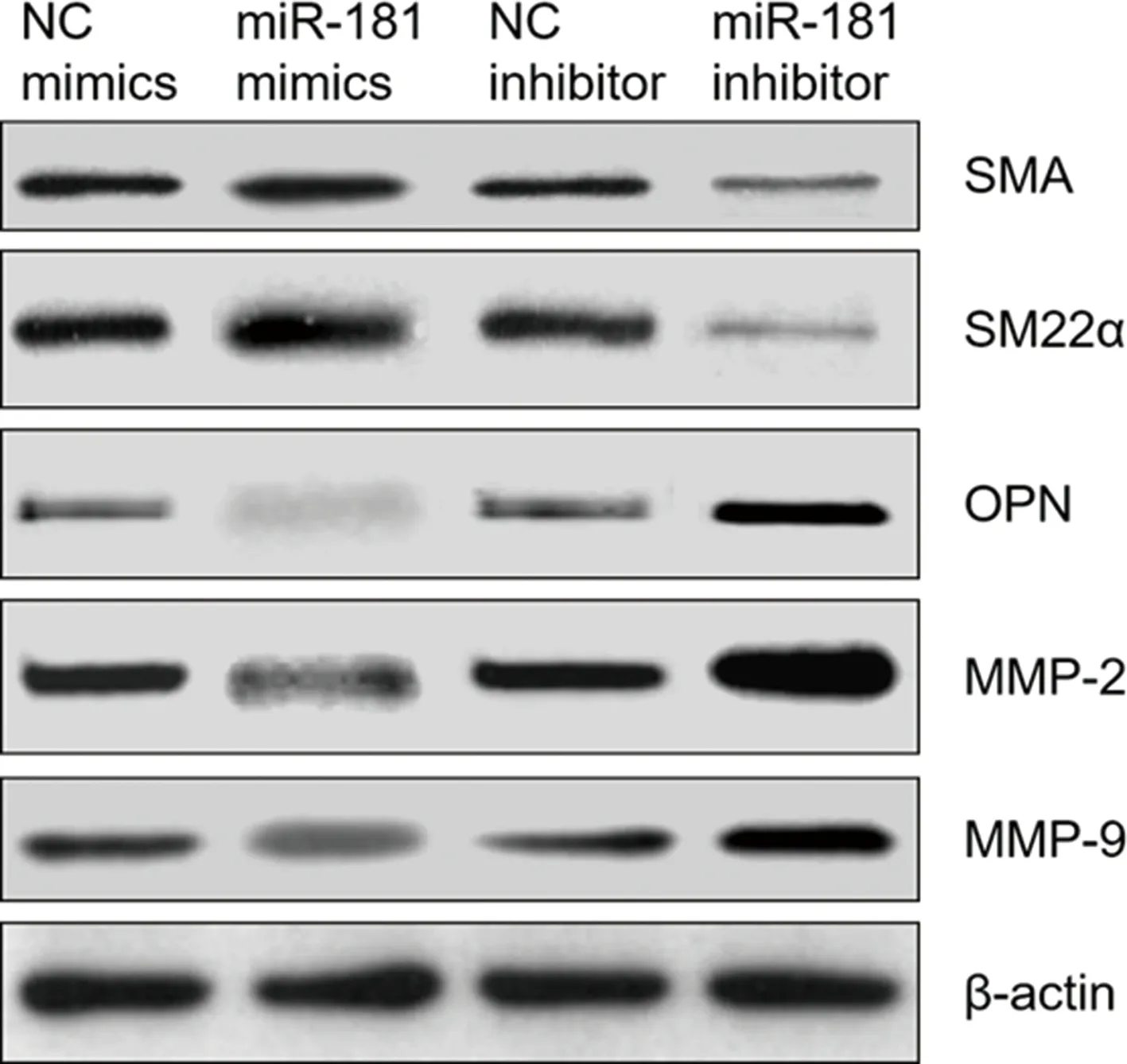
圖2 miR-181對腦動脈VSMC表型轉換的影響
2.3TGFBR1是miR-181的直接靶點 TargetScan軟件預測結果顯示,miR-181與TGFBR1的3′-UTR存在互補結合位點(圖3A),miR-181可能通過靶向調控TGFBR1的表達水平而發揮作用。雙熒光素酶報告基因檢測結果顯示,TGFBR1-wt與miR-181 mimics共轉染組熒光素酶活性明顯低于陰性對照組,差異有統計學意義(P<0.05);而TGFBR1-mut各組間熒光素酶活性比較,差異無統計學意義(P>0.05),圖3B。
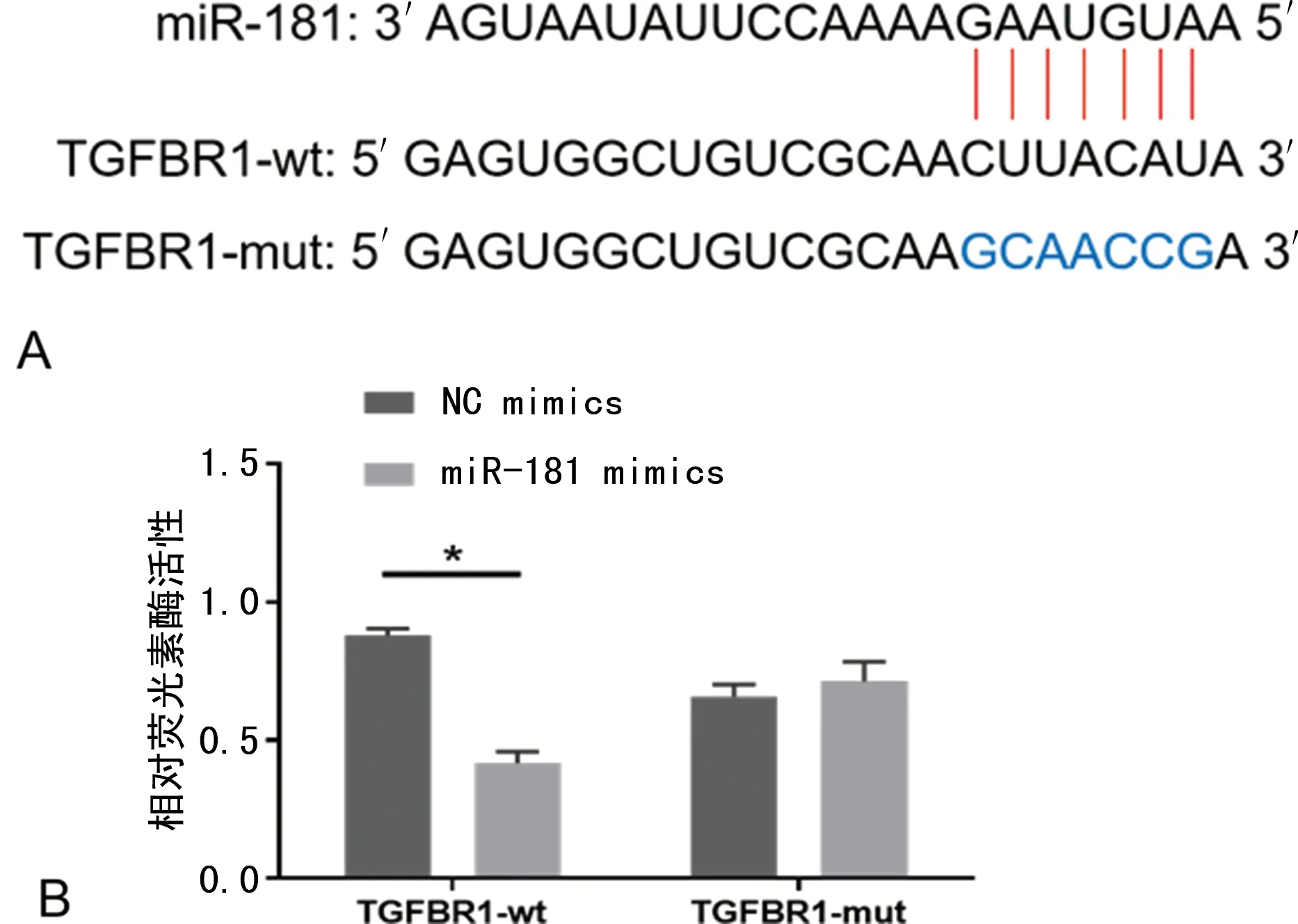
注:A為TargetScan軟件預測TGFBR1是miR-181的靶基因;B為雙熒光素酶報告基因檢測結果,與NC mimics比較,*P<0.05。
2.4IA組織中TGFBR1蛋白表達水平 采用Western blot檢測IA患者手術切除的IA組織中TGFBR1蛋白表達水平,并采用接受開顱治療的創傷患者的正常顳淺動脈作為對照。結果顯示,與對照者比較,IA患者IA組織標本中TGFBR1蛋白表達水平升高,見圖4。

圖4 IA組織中TGFBR1表達水平
2.5miR-181靶向調控TGFBR1的蛋白表達水平 Western blot分析表明,轉染miR-181 mimics降低了TGFBR1的蛋白表達水平,轉染miR-181 inhibitor升高TGFBR1的蛋白表達水平。見圖5。
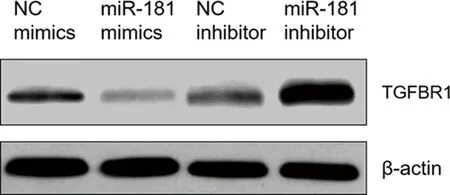
圖5 miR-181靶向調控TGFBR1的蛋白表達水平
3 討 論
雖然IA的發病機制尚不清楚,但氧化應激、炎癥、血流動力學失調和細胞外基質降解均有助于IA的形成和發展。VSMC表型轉換在IA、動脈粥樣硬化和動脈瘤等疾病中發揮重要作用。有研究表明,miR-181通過調控VSMC表型轉換參與動脈粥樣硬化的發生和發展[11]。有研究表明,VSMC表型調控與IA的形成、生長和破裂相關[14-15]。VSMC由收縮型轉換為合成型,合成型VSMC刺激促炎過程、細胞外基質重構和細胞凋亡,最終促進IA的形成和破裂。本研究結果顯示,IA患者血清miR-181表達水平低于健康對照者。為了探究IA中miR-181對VSMC表型轉換的作用,采用miR-181 mimics和miR-181 inhibitor轉染人腦VSMC檢測收縮表型的標記SMA、SM22α及 OPN的表達水平,結果表明,VSMC過表達miR-181基因細胞SMA、SM22α表達水平升高,OPN表達水平降低。同時抑制miR-181表達水平后SMA、SM22α表達水平降低,OPN表達水平升高。VSMC合成表型與收縮基因的表達降低有關,雖然VSMC失去了收縮能力,但有助于招募促炎細胞和血管壁細胞外基質重構。本研究結果提示,抑制miR-181基因VSMC MMP-2、MMP-9表達水平均升高。
miRNA可通過調控基因轉錄后水平抑制mRNA的降解和翻譯。miRNA與其靶基因轉錄體序列互補,通過切斷靶基因的mRNA分子和(或)抑制靶基因的翻譯來發揮作用。幾個miRNA可以共同調控某一基因的表達[16]。TargetScan軟件預測結果表明,TGFBR1為miR-181的靶向調控基因。TGFBR1是一種特異性TGF-β受體,介導TGF-β的生理和病理功能,已有文獻證明TGFBR1是動脈粥樣硬化過程的主要成分[17]。TGFBR1在TGF-β介導的心血管疾病涉及的幾乎所有細胞類型中均起作用,包括內皮細胞、VSMC、肌成纖維細胞和巨噬細胞[18]。本研究采用Western blot檢測了IA患者手術切除的IA組織中TGFBR1的蛋白表達水平,并用接受開顱治療的創傷患者的正常顳淺動脈作為對照,結果顯示,與對照者比較,IA組織中TGFBR1的蛋白表達水平升高。因此猜測,在IA中miR-181通過調控TGFBR1的蛋白表達水平調控VSMC表型轉換。
為了研究miR-181與TGFBR1的靶向調控關系,本研究采用TargetScan軟件預測及熒光素酶報告基因檢測驗證上述猜測。結果表明,TGFBR1是miR-181直接調控的靶基因。通過Western blot檢測發現,過表達miR-181后TGFBR1的蛋白表達水平降低;而抑制miR-181后TGFBR1的蛋白表達水平升高。
綜上所述,IA患者血清中miR-181表達水平下降,過表達miR-181抑制VSMC收縮表型向合成型表型轉換。miR-181直接靶點是TGFBR1,IA組織中TGFBR1的蛋白表達水平升高。因此,IA中miR-181可能通過調控TGFBR1的蛋白表達水平抑制VSMC的表型轉換,這為治療IA及控制蛛網膜下腔出血提供了新的靶點。

