大黃素增強紫杉醇對人小細胞肺癌細胞的體內抗腫瘤作用研究
張美珍 李登云 胡丹蘭
肺癌是臨床最為常見的惡性腫瘤,其發病率和死亡率高居所有腫瘤首位[1]。目前,肺癌的治療手段主要有手術切除、化學治療、免疫治療、放射治療等,但治療效果仍未達到理想狀態,且患者術后生存率較低[2]。紫杉醇是肺癌治療常見的有效藥,但易發生耐藥,且不良反應多[3]。因而開展相關研究以尋求治療肺癌的有效藥或增強抗癌藥的抗腫瘤作用具有重要的意義。近年來,研究發現大黃素能夠有效抑制多種腫瘤疾病的發生發展[4-6]。本文旨在觀察大黃素能否增強紫杉醇對肺癌細胞的抗腫瘤作用,為今后肺癌診療提供新思路。
1 材料與方法
1.1 實驗材料 小細胞肺癌H466 細胞株購自武漢普諾賽生命科技有限公司;大黃素購自東明格魯斯生物科技有限公司,紫杉醇購自哈爾濱三聯藥業股份有限公司;青霉素、鏈霉素和胎牛血清均購自上海Sigma公司;二喹啉甲酸(BCA)蛋白定量試劑盒(批號:P0009)購自上海碧云天生物技術有限公司,CCK-8 試劑盒購自上海MedChem Express 公司;B 淋巴細胞瘤-2(Bcl-2)(批號:ab224077)、BCL2-Associated X 的蛋白質(Bax)(批號:ab193573),及甘油醛-3-磷酸脫氫酶(GAPDH)(批號:ab181602)抗體均購自大連寶生物公司;Transwell 小室購自中國樂博生物公司。
1.2 實驗方法 (1)細胞培養、用藥與分組:取小細胞肺癌H466 細胞株復蘇后,置入含10%胎牛血清的培養基培養,置于37 ℃、5% CO2恒溫培養箱中常規培養。取對數生長期的A549 細胞用于實驗,將對數生長期細胞懸液濃度調整為(1×105個/mL)接種于96 孔板中,每孔加入100 μL,設置培養箱室溫條件為37 ℃、濕度條件為5% CO2,培養24 h。配制不同濃度的大黃素溶液[7],0 μmol/、10 μmol/、50 μmol/、100μmol/L,設置5 組復孔,分為空白組(0 μmol/L 大黃素+0 μmol/L 紫杉醇)、大黃素組(10 μmol/L 大黃素+0μmol/L 紫杉醇)、紫杉醇組(0 μmol/L 大黃素+10 μmol/L 紫杉醇)、低劑量組(10 μmol/L 大黃素+10 mol/L 紫杉醇)、中劑量組(50 μmol/L 大黃素+10 μmol/L 紫杉醇)、高劑量組(100 μmol/L 大黃素+10 μmol/L 紫杉醇),每組設置8 個復孔。(2)2CCK-8 法檢測細胞增殖:分別在加入大黃素和紫杉醇預處理培養48 h后,以換液形式加入比例為10 ∶1 的CCK-8 試劑,孵箱繼續培養2 h,設置酶標儀波長為450 nm,檢測各組OD 值,計算癌細胞增殖率細胞增殖抑制率=(1-實驗組OD 值/空白組OD 值)×100%。(3)流式細胞術檢測細胞凋亡:在加入大黃素和紫杉醇預處理培養48 h 后,收集懸浮及貼壁細胞,1000 r/min 離心5 min,加入膜聯蛋白V-FITC(AnnexinV-FITC)結合液重新懸浮細胞,避光室溫孵育10 min,離心,棄上清,碘化丙啶(PI)冰盒中避光孵育10 min,加400 μL 緩沖液,流式細胞儀檢測細胞凋亡率。(4)Transwell 法檢測細胞侵襲能力:在加入大黃素和紫杉醇預處理培養48 h 后,往Transwell 小室上層加入分別加入五組不同的培養細胞,下層加入500 μ含10%胎牛血清的RPMI1640 培養基,再培養24 h 后,棄去培養基,用棉簽輕輕拭掉膜上的細胞,利用0.5%的結晶紫對上室底部細胞進行染色,并用棉簽除去上室內側的細胞,顯微鏡下觀察細胞并統計細胞數量。(5)劃痕實驗檢測細胞遷移能力:加入大黃素和紫杉醇預處理培養,過夜培養至形成單層細胞,用10 μL 的槍頭在各組單層細胞上劃橫線,再用PBS 洗去因劃線而脫落的細胞,分別拍照并記錄0 h 和48 h 的細胞遷移情況,計算細胞遷移率,細胞遷移率=(0 h 劃痕間隙距離-48 h 劃痕間隙距離)/0 h 劃痕間隙距離。(6)蛋白質免疫印跡(WB)檢測A549 細胞凋亡蛋白表達:收集各組培養細胞,Trizol 法提取細胞總蛋白,使用聚氰基丙烯酸正丁酯蛋白定量試劑盒對提取的總蛋白進行定量測定,按比例加入4×蛋白上樣緩沖液,95 ℃ 變性 5 min,置于-20 ℃ 保存備用。設置濃縮膠電壓為80 V,分離膠電壓為 120 V 進行烷基硫酸鈉-聚丙烯酰胺凝膠電泳,轉印。取氟乙烯膜用洗滌緩沖液洗膜5 min,共3 次,封閉、室溫搖床孵育2 h。洗膜后先后加入一抗工作液(Bcl-2、Bax、GAPDH 抗體)和二抗工作液,進行一抗孵育和二抗孵育后,將新鮮配制的化學發光液滴加到氟乙烯膜表面,轉移至成像分析系統暗箱中曝光,采集圖像并分析。蛋白定量以相對光密度值代表蛋白相對表達量,以GAPDH 為內參進行分析。
1.3 統計學方法 采用SPSS 22.0 統計軟件。計量資料符合正態分布以(±s)表示,方差齊的多組均數比較采用單因素方差分析,兩兩比較采用LSD-t檢驗;方差不齊采用Kruskal-wallis H 檢驗,兩兩比較采用Tamhane's T2 檢驗。以P<0.05 為差異有統計學意義。
2 結果
2.1 各組的細胞增殖抑制率比較 不同劑量大黃素聯合紫杉醇預處理48 h 后,空白組、大黃素組、紫杉醇組、低劑量組、中劑量組和高劑量組細胞增殖抑制率分別(2.24±0.98)%、(6.43±1.21)%、(13.32±1.42)%、(23.91±4.50)%、(36.24±3.69)%和(57.37±9.52)%。與空白組比較,大黃素組、紫杉醇組、低劑量組、中劑量組和高劑量組的細胞增殖抑制率均升(P<0.05);與大黃素組比較,紫杉醇組、低劑量組、中劑量組和高劑量組的細胞增殖抑制率均升高(P<0.05);與紫杉醇組比較,低劑量組、中劑量組和高劑量組細胞增殖抑制率均升高(P<0.05);低劑量組、中劑量組和高劑量組比較,細胞增殖抑制率呈劑量依賴式升高,差異均有統計學意義(P<0.05)。
2.2 各組的細胞凋亡率比較 不同劑量大黃素聯合紫杉醇預處理48 h 后,空白組、大黃素組、紫杉醇組、低劑量組、中劑量組和高劑量組細胞凋亡率分別為(5.42±0.97)%、(7.94±1.23)%、(11.37±1.51)%、(16.82±1.67)%、(28.66±6.94)%和(35.54±6.98)%,差異均有統計學意義(P<0.05)。見圖1。
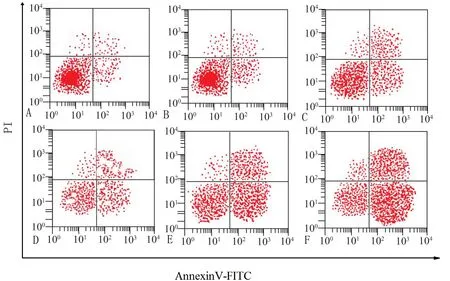
圖1 流式細胞術檢測細胞凋亡結果
2.3 各組A549 細胞凋亡蛋白表達水平比較 見圖2、表1。
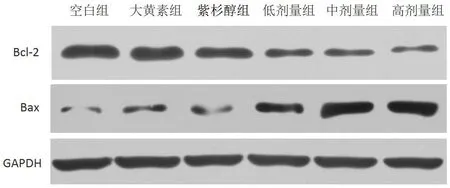
圖2 Westerblot檢測A549細胞凋亡蛋白表達結果
表1 各組A549細胞凋亡蛋白表達水平比較(±s)
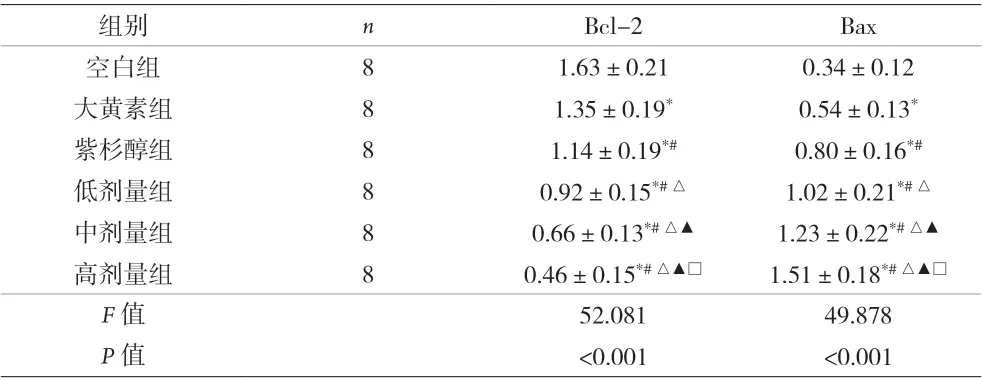
表1 各組A549細胞凋亡蛋白表達水平比較(±s)
注:與空白組比較,*P<0.05;與大黃素組比較,#P<0.05;與紫杉醇組比較,△P<0.05;與低劑量組比較,▲P<0.05;與中劑量組比較,□P<0.05
組別nBcl-2Bax空白組81.63±0.210.34±0.12大黃素組81.35±0.19*0.54±0.13*紫杉醇組81.14±0.19*#0.80±0.16*#低劑量組80.92±0.15*#△1.02±0.21*#△中劑量組80.66±0.13*#△▲1.23±0.22*#△▲高劑量組80.46±0.15*#△▲□1.51±0.18*#△▲□F 值52.08149.878 P 值<0.001<0.001
2.4 各組的細胞遷移率比較 不同劑量大黃素聯合紫杉醇預處理48 h 后,空白組、大黃素組、紫杉醇組、低劑量組、中劑量組和高劑量組的細胞遷移率分別(36.35±1.12)%、(29.37±3.69)%、(20.54±1.94)%、(13.36±1.81)%、(7.75±2.66)%和(3.57±1.07)%,差異均有統計學意義(P<0.05)。見圖3。

圖3 細胞劃痕實驗結果
2.5 各組的侵襲細胞數比較 不同劑量大黃素聯合紫杉醇預處理48 h 后,空白組、大黃素組、紫杉醇組、低劑量組、中劑量組和高劑量組的侵襲細胞數分別(89.50±8.47)個、(88.50±7.78)個、(84.63±10.08)個、(61.50±6.48)個、(54.1±6.36)個和(15.88±3.80)個,差異均有統計學意義(P<0.05)。
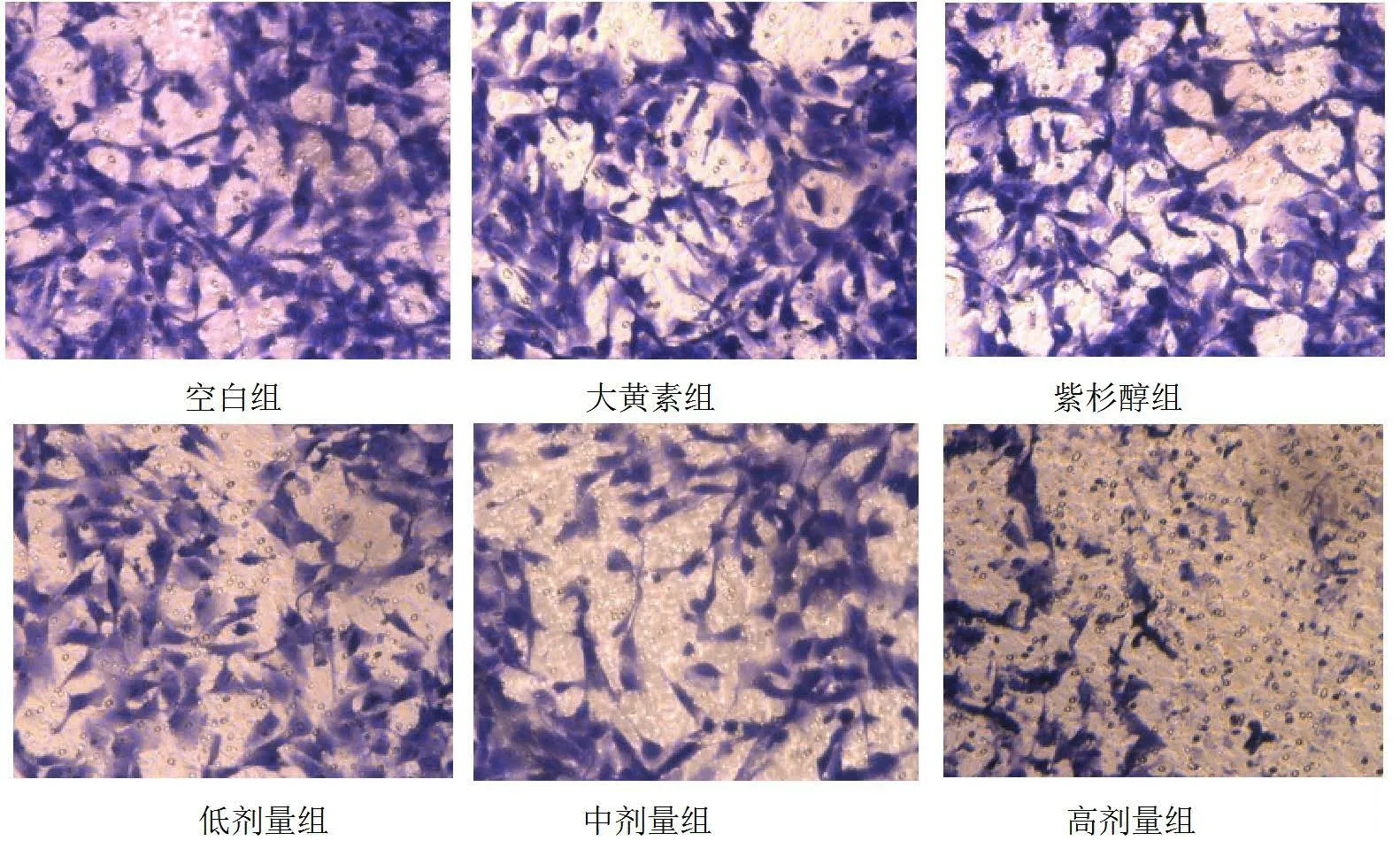
圖4 各組侵襲細胞數(結晶紫染色×200)
3 討論
肺癌按細胞類型可分為非小細胞肺癌和小細胞肺癌(SCLC)兩大類型。SCLC 是起源于支氣管黏膜或腺體的一類肺惡性腫瘤,占全部原發性肺癌的14.18%[8],相較于非小細胞肺癌,SCLC 的惡性程度較高,生長速度迅速,倍增時間較短,易發生轉移,且初期癥狀不明顯,確診時多已有遠處轉移病灶。目前,SCLC 除采用以化療為主的綜合治療外,尚未找出理想的治療方法。紫杉醇是廣譜抗癌藥物,適用于多種腫瘤疾病的治療,然而長期使用會增加心血管毒性、肝臟毒性、脫發等不良反應的發生率,甚至會出現支氣管痙攣性呼吸困難、蕁麻疹和低血壓現象,其中過敏反應發生率較高[9]。大黃素的化學名為1,3,8-三羥基-6-甲基蒽醌,是掌葉大黃根莖中重要活性成分,能夠誘導大腸癌細胞內質網應激依賴性凋亡[10],通過內質網應激和Tribbles 同源物3/核轉錄因子途徑誘導肺癌細胞凋亡[11],通過Wnt/β-Catenin 途徑抑制上皮間充質轉化抑制結腸癌細胞侵襲和遷移[12]。
本研究結果顯示,大黃素組和紫杉醇組的細胞增殖抑制率明顯高于空白組,且紫杉醇組高于大黃素組,說明大黃素和紫杉醇兩種藥物均有抑制癌細胞增殖的作用,紫杉醇效果更明顯。另一方面,大黃素組與低劑量組設置的大黃素預處理濃度相同,多加紫杉醇的低劑量組的細胞增殖抑制率增大,提示大黃素與紫杉醇聯用更能抑制癌細胞增殖,紫杉醇組與低、中、高各劑量組比較,由于各組設置的大黃素預處理濃度不一致,導致癌細胞增殖抑制率呈劑量依賴式升高,結果表明大黃素能增強紫杉醇抑制癌細胞增殖的能力,且大黃素濃度越高效果越明顯。采用流式細胞術檢測各組的細胞凋亡情況及WB 檢測細胞凋亡蛋白表達水平發現,各組的細胞凋亡率、Bax 蛋白表達趨勢與細胞增殖抑制率一致,Bcl-2 蛋白表達趨勢與細胞增殖抑制率完全相反,Bcl-2 蛋白抑制癌細胞凋亡,而Bax 蛋白與Bcl-2 蛋白拮抗起到促進作用,因此兩種檢測方法均能反映細胞凋亡情況。研究顯示,大黃素能增強紫杉醇促進癌細胞凋亡的作用,且大黃素濃度越高效果越明顯。進一步檢測細胞遷移能力發現,大黃素和紫杉醇均能抑制癌細胞遷移,紫杉醇效果比大黃素明顯,聯用效果更明顯,亦有明顯的劑量-效應關系,結果提示大黃素能增強紫杉醇抑制細胞遷移的作用,且大黃素濃度越高效果越明顯。觀察各組癌細胞侵襲個數,空白組、大黃素組和紫杉醇組的癌細胞侵襲數無明顯差異,與上述3 組比較,低、中、高各劑量組的癌細胞侵襲數明顯降低,且高劑量組低于低劑量和中劑量組,說明聯用大黃素和紫杉醇能夠降低癌細胞的侵襲能力,高劑量組更為明顯。
綜上,大黃素和紫杉醇均能抑制癌細胞的增殖、遷移和侵襲,促進人肺癌A549 細胞凋亡,大黃素能夠增強紫杉醇的抗腫瘤作用,抑制腫瘤效果與大黃素劑量密切相關。

