基于轉錄組學研究雷公藤甲素對倉鼠卵巢細胞毒性的分子機制
程 坦,高 寧,鄭曉玲,應牡英,*
1南昌大學瑪麗女王學院,南昌 330006;2黑龍江中醫藥大學,哈爾濱 150040;3南昌大學基礎醫學院,南昌 330006
雷公藤甲素(triptolide)屬環氧二萜內酯化合物,是中藥雷公藤的主要有效成分。現代藥理學研究表明,雷公藤甲素能夠誘導細胞凋亡、調節自噬、抑制細胞周期、抑制血管生成、抑制促炎細胞因子表達,從而具有抗腫瘤、抗炎、免疫調節、神經保護等多種藥理學作用,雷公藤甲素相關制劑在臨床應用中也得到廣泛認可[1]。然而,與其優良藥效相對應的,雷公藤甲素在臨床應用中亦表現出了明顯的毒副作用。多項體內外研究均表明,雷公藤甲素能夠對于肝臟、腎臟、卵巢等多個器官造成損傷,極大地限制了雷公藤甲素的臨床應用與開發[2]。因此,深入了解雷公藤甲素毒副作用的分子機制,對于優化臨床用藥、設計新的衍生物、降低毒性、提高安全性等均具有重要意義。
雷公藤甲素的生殖毒性一直受到研究者的關注,然而多數研究均集中于雷公藤甲素引起的卵巢等器官的病理學改變及相關生理生化指標異常,對于毒性相關的分子機制研究并不深入[3]。由于雷公藤甲素能夠通過調節多條途徑實現其藥效作用[1],因此對其毒性機制研究也應從整體考慮。本研究以中國倉鼠卵巢細胞為模型,利用轉錄組測序技術研究雷公藤甲素給藥前后卵巢細胞基因表達整體變化,以期為雷公藤甲素引起卵巢損傷的分子機制研究提供參考。
1 材料與方法
1.1 材料
1.1.1 細胞系
中國倉鼠卵巢細胞(Chinese hamster ovary cells,CHO),購自中科院上海細胞庫,由本實驗室傳代并液氮保存。
1.1.2 藥品與試劑
雷公藤甲素(成都格利普生物科技有限公司);DMEM培養基(Sigma,美國);胎牛血清(BI,以色列);青霉素-鏈霉素溶液(賽默飛(北京)公司);胰蛋白酶(Gibco,美國);PBS緩沖液(北京索萊寶科技有限公司);SV Total RNA Isolation System總RNA提取試劑盒(Promega,美國)。
1.1.3 儀器設備
CO2細胞培養箱(施都凱(上海)有限公司);低速離心機(Beckman,德國);低溫離心機(Eppendorf,德國);超凈工作臺(上海博迅實業有限公司);超純水系統(Mllipore,美國);RT-6000酶標分析儀(深圳雷杜生命科學股份有限公司)。
1.2 方法
1.2.1 細胞培養與給藥
凍存的CHO細胞經常規方法復蘇,培養條件為:含10%胎牛血清的DMEM培養基,培養溫度37 ℃,CO2濃度5%。取對數生長期的CHO細胞,按1×106cells/mL的濃度接種于6孔板中,每孔2 mL,培養24 h后,棄去培養基,參照文獻[2]及課題組前期預實驗結果,加入含有80 nM雷公藤甲素的無血清培養基(給藥組),以無血清培養基培養作為對照組,每組設3個重復。培養24 h后,提取RNA進行轉錄組測序。
1.2.2 RNA提取與轉錄組測序
細胞給藥結束后,經胰酶適當處理,按總RNA提取試劑盒說明書提取細胞總RNA,采用瓊脂糖凝膠電泳及紫外分光光度法檢測總RNA的濃度與純度,要求18S rRNA與28S rRNA電泳條帶清晰、無拖尾,A260/A280在1.9~2.0之間。檢測合格的總RNA用Oligo(dT)磁珠法富集純化mRNA,片段化后逆轉錄合成雙鏈cDNA,添加測序接頭、USER酶解、PCR擴增、AMPure XP beads純化,最終構建鏈特異性cDNA文庫。經質檢合格的文庫進行HiSeq測序,得到原始數據raw reads,采用Trimmomatic v0.36軟件對原始數據過濾,去除接頭序列及低質量序列,得到clean reads。采用HISTA2軟件,將clean reads與ENSEMBL數據庫(www.ensembl.org)中參考基因組(GCF_000223135.1_CriGri_1.0_genomic.fa)進行比對。利用featureCounts v1.5.0軟件通過HISTA比對產生的SAM比對文件和基因組的GTF注釋文件來計算每一個基因擁有的reads數量,然后根據外顯子的長度以下述公式計算基因的FPKM值(fragments per kilobase million,即在每百萬個Reads值中,來自某基因每千個堿基長度的Reads數)來表示基因的表達量。利用DESeq2軟件基于負二項分布比較對照組與給藥組間基因表達差異,以差異倍數|log2FoldChange|>1,且校正后P值(p.adj)Q<0.05為標準篩選得到差異基因(differentially expressed genes,DEGs)。轉錄組測序及差異基因篩選部分由武漢博越致和生物科技有限公司協助完成。
1.2.3 差異基因功能分析
基于基因本體數據庫(Gene Ontology,GO)與京都基因與基因組百科全書數據庫(KEGG),利用ClueGO軟件對差異基因所涉及的GO生物學過程(biological process)進行富集分析,并利用Cytoscape 3.1軟件繪制各GO條目間相互關系。利用在線數據庫STRING 11(https://string-db.org/)分析差異基因所涉及的KEGG通路(KEGG pathway)并建立差異基因所表達的蛋白間相互作用關系網絡。綜合分析結果,探討雷公藤甲素對卵巢細胞CHO毒性作用的分子機制。
1.2.4 統計學方法
DEGs的功能富集分析,如文中設計的GO、KEGG分析,采用Fisher精確檢驗,并以P<0.05作為閾值。
2 結果
2.1 差異基因的篩選
原始測序序列經過濾除去低質量reads后,與倉鼠基因組數據進行比對分析,結果顯示各實驗組Q30(測序質量分數大于30的堿基占所有堿基的百分數)大于95%,整體比對率大于80%,測序質量良好(表1)。基于FPKM值比較給藥組與對照組基因表達差異,共篩選得到差異基因740條,其中上調286條,下調454條;同時,以不同樣本間表達量方差最大的50個基因用于樣本層次聚類分析,結果如圖1。
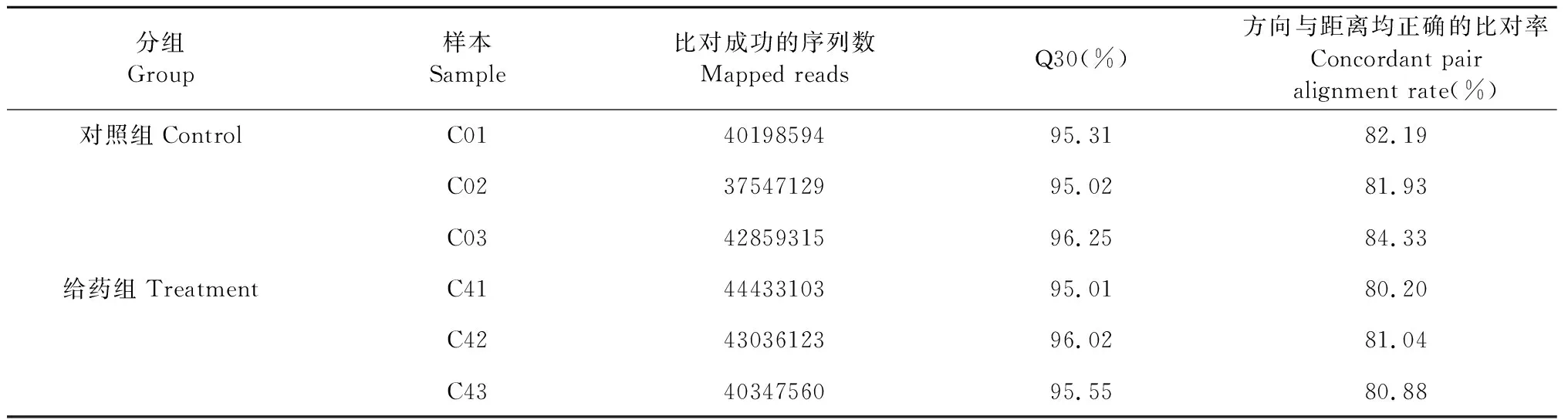
表1 Clean reads的質量與比對結果Table 1 Quality and mapped rate of clean reads

圖1 基因表達水平分析結果Fig.1 Results of genes expression analysis注:A.樣本表達量分布圖;B.樣本聚類結果。Note:A.Violin plot for expression level;B.Hierarchical clustering analysis results of samples.
2.2 差異基因的GO生物學功能分析
基因本體(Gene Oncology,GO)是由基因本體聯合會(Gene Ontology Consortium)建立的在線生物數據庫,用于對基因及其蛋白功能進行注釋,主要分為生物學過程(biological process,BP)、細胞組件(cellular component,CC)和分子功能(moelcular function,MF)三個類別。基因本體已成為從整體掌握差異基因功能變化的重要工具。將上調的286條差異基因導入ClueGO中,以Cricetulusgriseus為物種背景,利用Functional Analysis富集分析差異基因涉及的BP、CC和MF。結果表明,上調基因共富集于16個生物學過程、4個細胞組件和5個分子功能(見圖2)。通過分析GO功能間的關系可知,上調基因所涉及的生物學過程(BP)主要分為異戊二烯類成分的合成與代謝(GO:0008299、GO:0006720)、細胞及器官發育(GO:2000026、GO:0045595、GO:0050793等)、細胞粘連(GO:0098609、GO:0098742、GO:0007156)與細胞對內源性刺激的應答(GO:0071495)幾個方面(見圖3)。
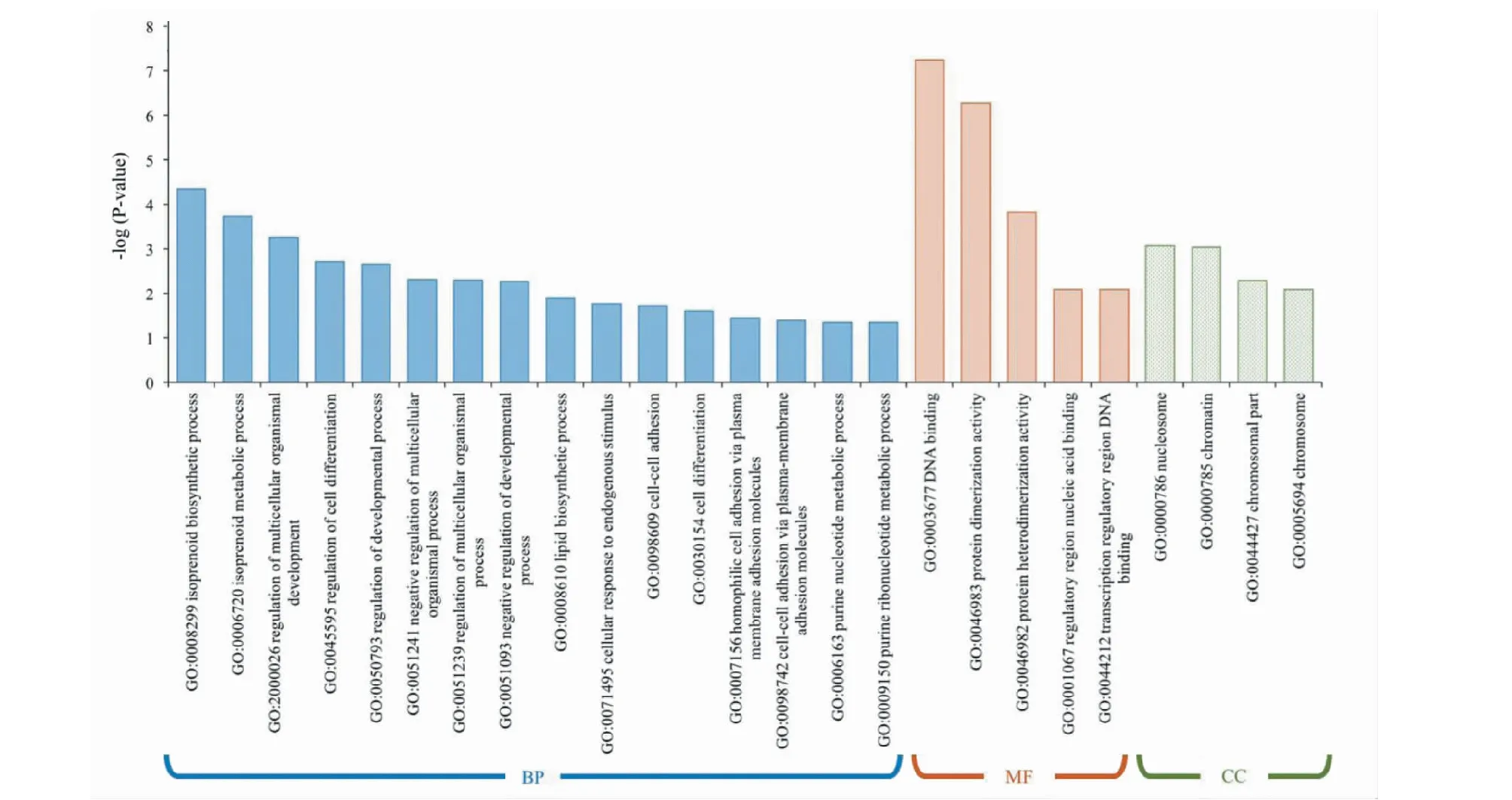
圖2 上調差異基因GO富集結果Fig.2 Enrichment results of up-regulated DEGs based on GO function
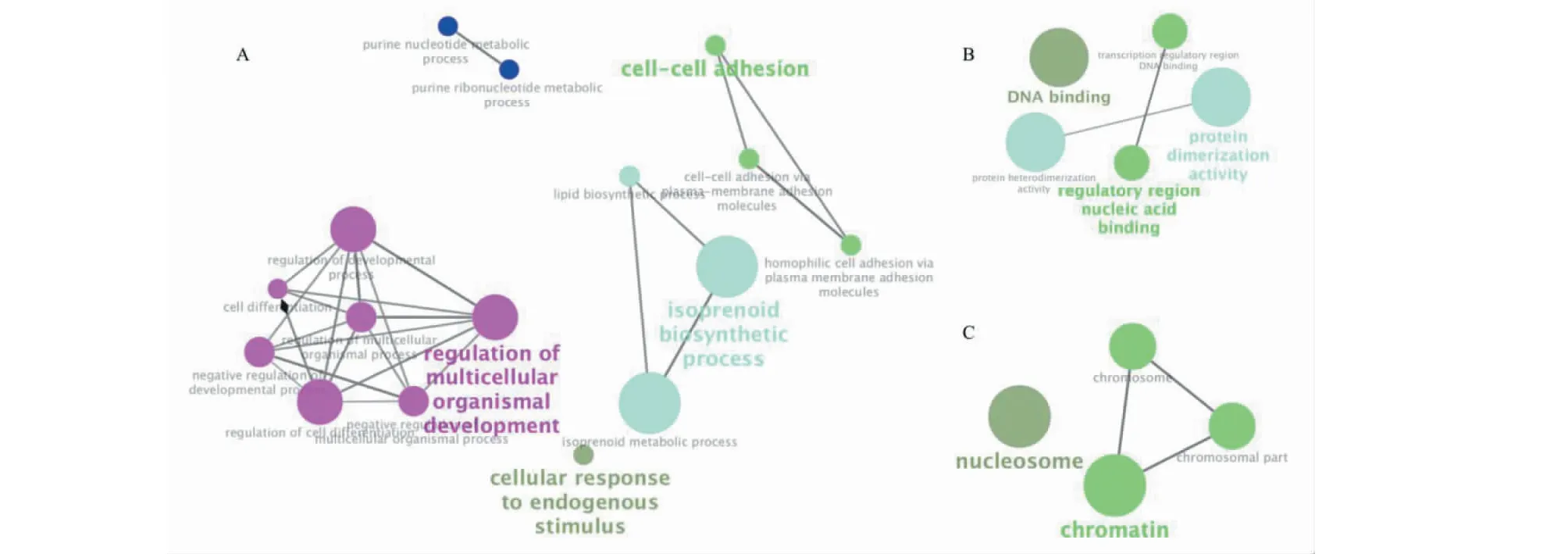
圖3 上調基因涉及的GO功能間相互關系Fig.3 Relationship between the GO term of up-regulated DEGs注:A.BP;B.MF;C.CC。
在利用ClueGO對下調基因進行GO功能分析時發現,受雷公藤甲素抑制的454條基因富集于18個生物學過程、7個細胞組件和2個分子功能(見圖4)。其主要的生物學功能以形態發生(GO:0009653、GO:0032989、GO:0000902等)與信號轉導通路的調控(GO:0007166、GO:0009966、GO:0010469等)兩個方面最為重要(見圖5)。
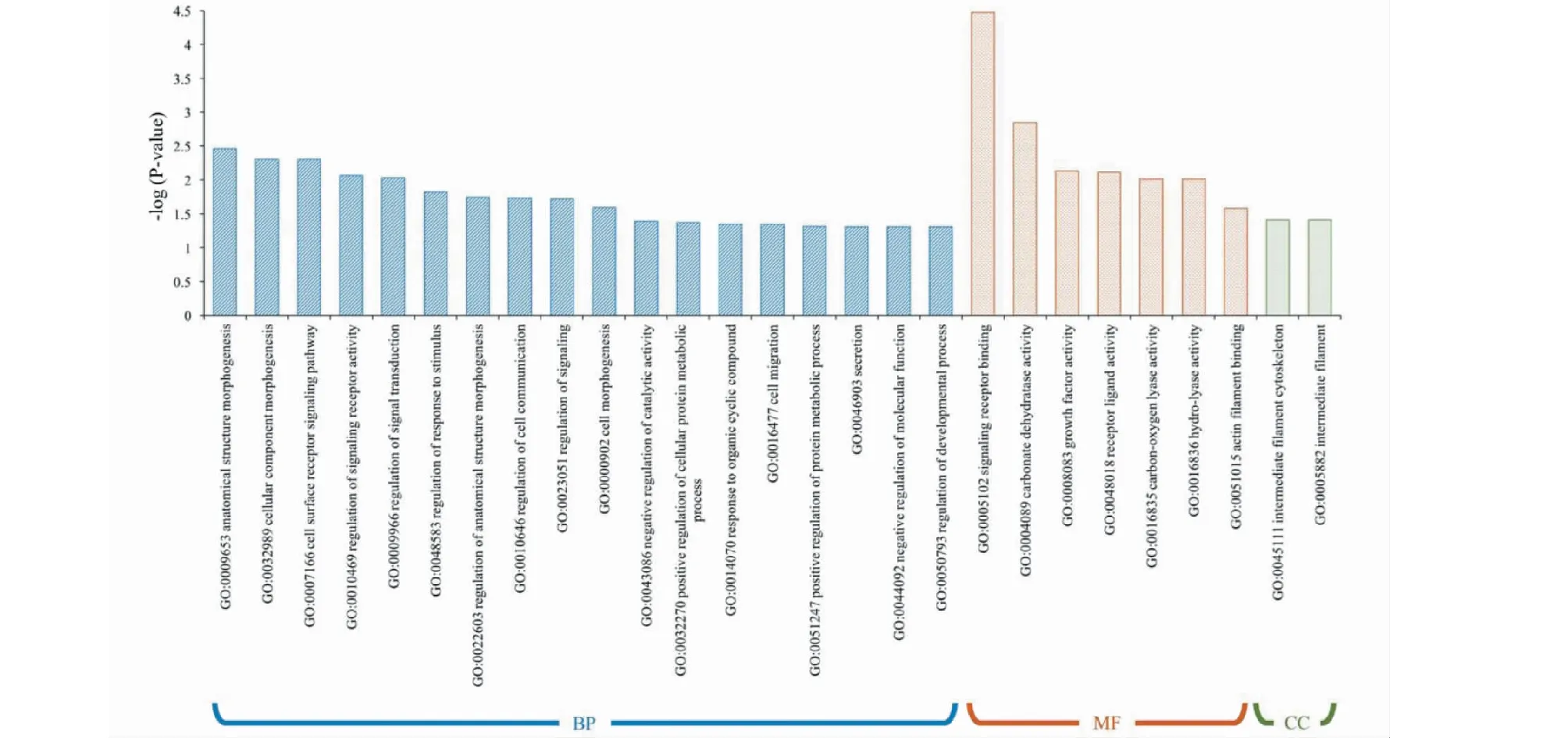
圖4 下調差異基因GO富集結果Fig.1 Enrichment results of down-regulated DEGs based on GO function
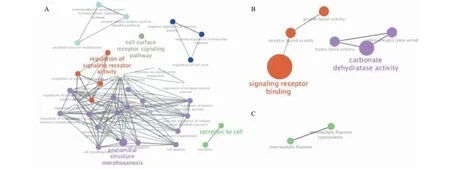
圖5 下調基因涉及的GO功能間相互關系Fig.5 Relationship between the GO term of down-regulated DEGs注:A.BP;B.MF;C.CC。
2.3 差異基因的KEGG代謝與信號通路分析
KEGG全稱為京都基因與基因組百科全書(Kyoto Encyclopedia of Genes and Genomes),其集成了近7 000種生物的基因功能信息及其所參與的代謝與信號轉導通路,并利用圖形界面將各基因間相互關系展現出來,使研究者能夠直觀掌握分析數據的生物學意義。利用STRING 11對差異基因參與的KEGG通路進行分析發現,差異基因共涉及22條KEGG通路,其中富集顯著性前3位的分別是膽固醇生物合成(cge00100)、MAPK信號通路(cge04010)以及癌癥中的轉錄失調(cge05202)。其他富集顯著性較高的KEGG pathway則主要包括多種信號轉導通路(cge04151、cge04657、cge04668、cge04068等)以及癌癥(cge05210、cge05220)、類風濕關節炎(cge05323)等疾病相關通路(見表2)。
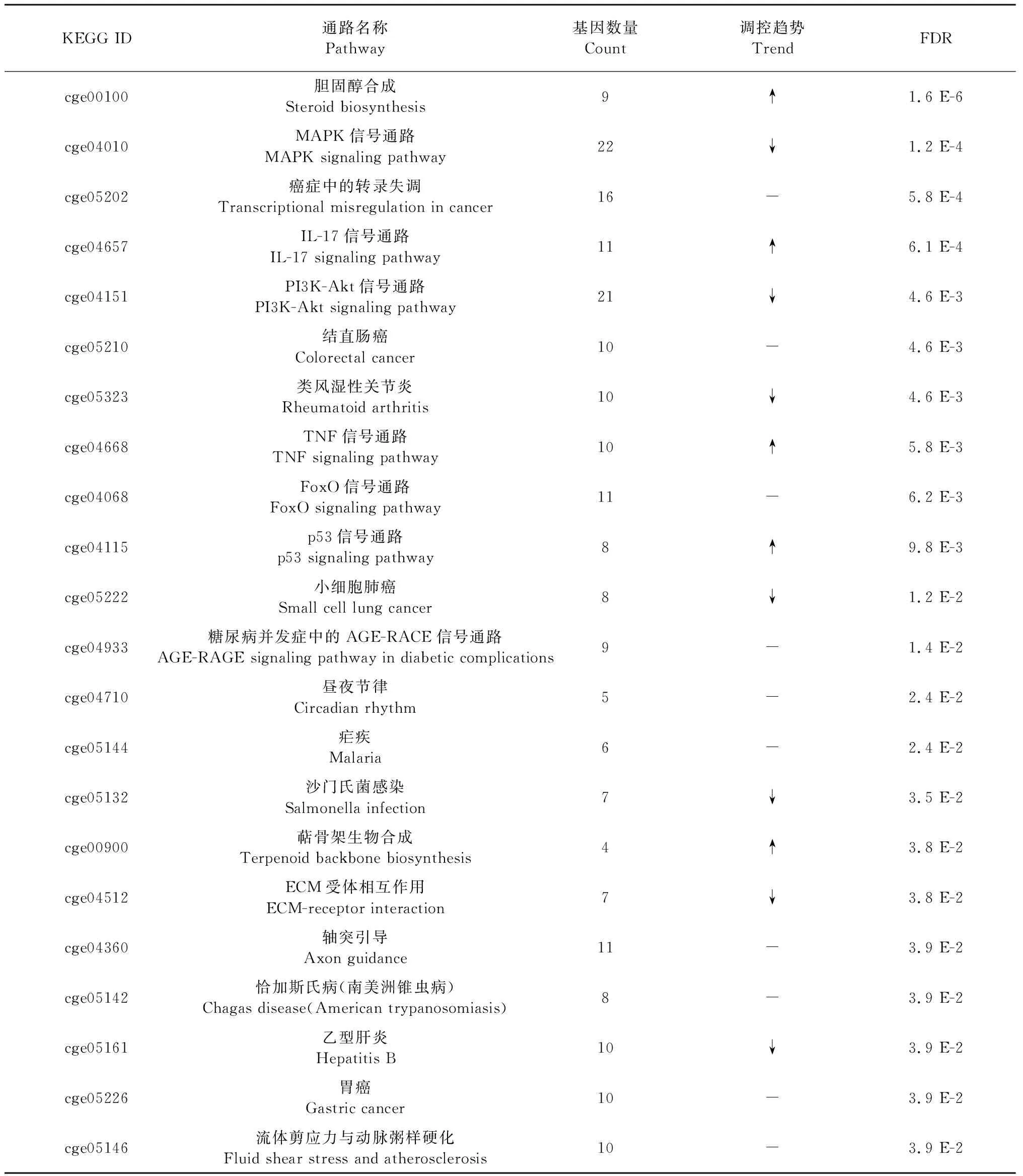
表2 差異基因的KEGG通路富集結果Table 2 Enrichment results of DEGs based on KEGG pathway
3 討論
雷公藤甲素具有抗炎、抗腫瘤、免疫抑制等多種藥理作用,臨床上常用于類風濕性關節炎等多種自身免疫性疾病的治療,取得了較好的應用效果。然而,其同樣能夠損害卵巢功能、誘導卵巢細胞凋亡,引起月經不調、閉經、卵巢早衰等多種生殖系統問題,但對于其卵巢毒性的分子機制尚不清晰[3]。本研究以倉鼠卵巢細胞系為模型,檢測并分析了雷公藤甲素對卵巢細胞基因表達的影響。綜合GO生物學功能及KEGG代謝及通路分析結果發現,雷公藤甲素對IL-17信號通路(cge04657)與TNF信號通路(cge04668)具有促進作用,對于PI3K-Akt信號通路(cge04151)則顯示抑制作用。
白細胞介素-17(Interleukin 17,IL-17)家族目前共發現6個成員,依次編號為IL-17A至IL-17F,其通過與受體相互作用,激活包括NF-κB、MAPKs和C/EBPs等下游通路,誘導抗菌肽、細胞因子和趨化因子的表達,從而在保護宿主免受細胞外病原體的侵襲方面發揮重要作用[4]。然而,大量研究顯示,IL-17信號通路異常,是許多炎癥性疾病的關鍵誘因[5]。IL-17的表達水平與銀屑病、多發性硬化、強直性脊柱炎、癌細胞的侵襲等均密切相關[4]。在卵巢相關疾病的研究中,IL-17與卵巢癌的關系研究最為普遍,研究證實IL-17能夠促進卵巢癌惡化并可作為預后不良的潛在標志物[6],而卵巢子宮內膜異位[7]、多囊卵巢綜合征[8]以及卵巢早衰[9]也被證實與IL-17的表達異常有關,同時,雷公藤多苷片也已被用于大鼠卵巢早衰疾病模型的建立[10]。通過轉錄組測序及富集分析結果可以發現,雷公藤甲素能夠提高il17c、traf6、fos、cxcl1、cxcl3、ptgs2等基因表達水平,從而促進卵巢細胞IL-17信號通路及下游基因表達(見表3、圖6),這可能是雷公藤甲素卵巢細胞毒性甚至誘發卵巢早衰的主要因素。
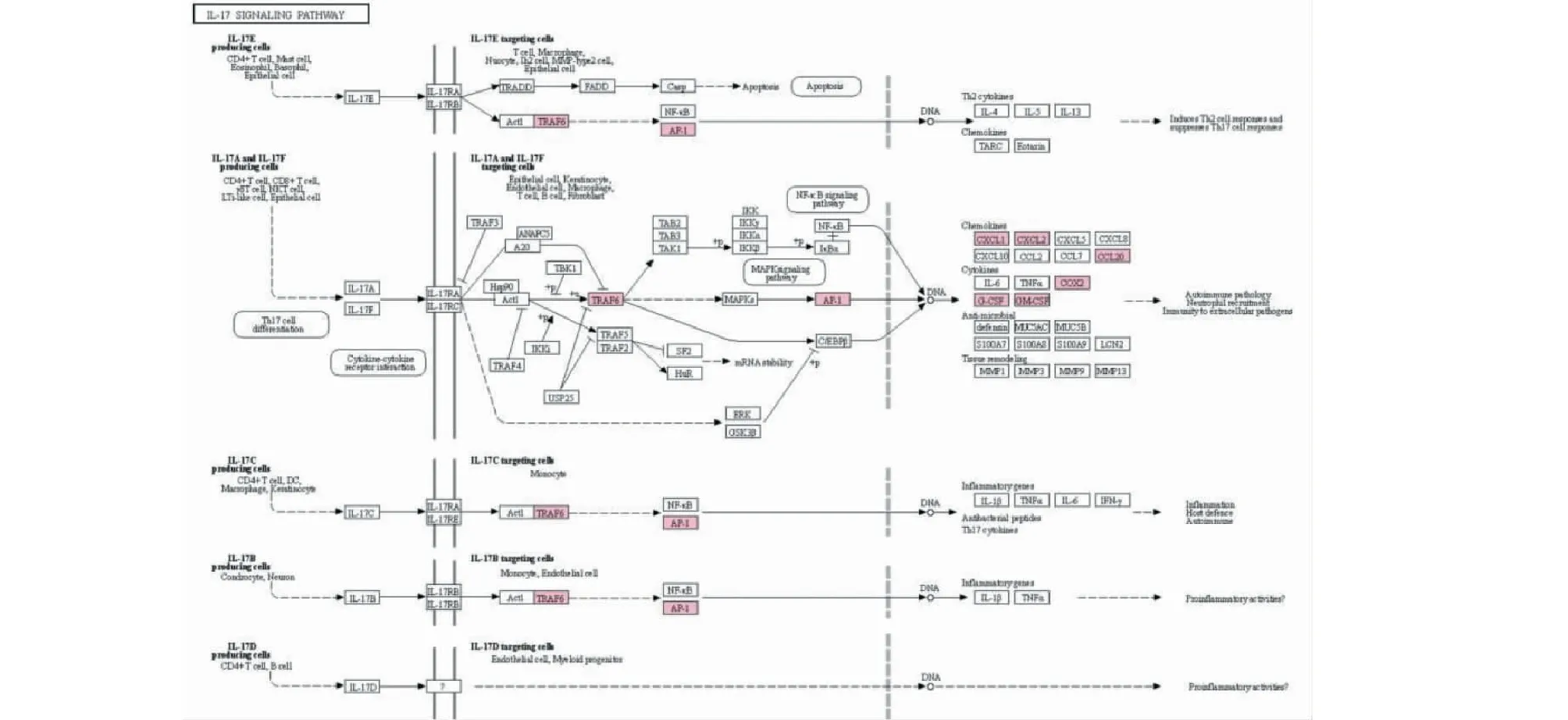
圖6 雷公藤甲素促進CHO細胞IL-17信號通路Fig.6 Facilitation of IL-17 signaling pathway in CHO cells promoted by triptolide注:圖中標記基因均上調。Note:The genes marked in the pathway were up-regulated.

表3 部分與雷公藤甲素卵巢毒性相關的差異基因Table 3 Partial DEGs related to the ovarian toxicity induced by triptolide
腫瘤壞死因子(TNF)是一種多效性的細胞因子,包括TNF-α與TNF-β,二者受體相同,能夠誘導一系列的胞內信號通路,在抗腫瘤應答、控制炎癥以及免疫系統穩態平衡等方面均發揮重要作用。研究發現,TNF受體存在于幾乎所有類型的細胞中,TNF與其受體結合后,通過招募TRADD、TRAF2等連接蛋白,進一步誘導下游基因活化,產生應答。其中TRADD下游效應主要為細胞凋亡及抗炎作用,而TRAF2下游效應則主要為抗細胞凋亡及炎癥信號。作為重要的促炎性細胞因子,腫瘤壞死因子異常表達能夠導致系統性紅斑狼瘡、潰瘍性結腸炎、克羅恩病等多種疾病[11]。現有研究結果證實,卵巢子宮內膜異位、多囊卵巢綜合征以及卵巢早衰患者血清TNF-α水平明顯升高,表明其在卵巢損傷過程中扮演重要角色[12,13]。通過轉錄組測序及富集分析結果可以發現,雷公藤甲素能夠提高traf1、traf5、fos、cxcl1、csf2、vcam1等基因表達水平,促進TNF信號通路及下游基因表達(見表3、圖7),這可能是雷公藤甲素引起卵巢細胞病變的重要誘因。
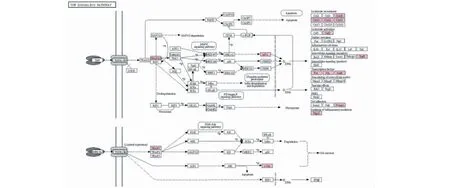
圖7 雷公藤甲素促進CHO細胞TNF信號通路Fig.7 Facilitation of TNF signaling pathway in CHO cells promoted by triptolide 注:圖中標記基因均上調。Note:The genes marked in the pathway were up-regulated.
磷脂酰肌醇3-激酶-Akt信號通路(PI3K-Akt signaling pathway)能夠被多種細胞刺激或毒性損傷所激活,在轉錄、翻譯、細胞增殖、生長等過程中發揮作用。該通路在哺乳動物卵泡的激活、生長及排卵過程中具有重要作用。轉錄組分析結果顯示,雷公藤甲素能夠抑制PI3K-Akt信號通路從而影響卵巢細胞形態發生(GO:0009653),這與已報道的研究結果相一致[14],也間接證明了本研究結果的準確性。
此外,富集分析結果顯示,雷公藤甲素能夠促進卵巢細胞膽固醇的生物合成(cge00100、cge00900、GO:0008299、GO:0006720)。研究證實雌二醇匱乏會影響脂代謝、引起膽固醇增高,因此機體膽固醇含量與雌二醇含量呈負相關[15],而雌二醇缺乏是卵巢早衰的重要病理指標。同時有研究表明,雷公藤甲素能夠誘發大鼠血脂異常,造成脂肪肝毒性[16],本研究結果則說明,雷公藤甲素對于卵巢細胞脂代謝的影響對其卵巢毒性可能具有促進作用。
除上述通路外,其他富集顯著性較高的作用則主要與雷公藤甲素的藥理作用機制相關,如MAPK信號通路[17]、p53信號通路[18]、ECM受體相互作用[19]等信號轉導通路以及類風濕性關節炎[20]、癌癥[21]等疾病相關通路,且與已有研究結果相符。
綜上可知,雷公藤甲素能夠通過影響IL-17信號通路、TNF信號通路、PI3K-Akt信號通路、膽固醇代謝等多種途徑擾亂卵巢細胞信號轉導與代謝過程,從而造成卵巢細胞損傷,產生卵巢毒性。研究結果為進一步明確雷公藤甲素的毒性作用機制提供了有益的參考。

