卵巢次優反應人群行拮抗劑方案取消移植的影響因素探討
王錦華 劉 蕓 黃吳鍵 毛麗華 王彩霞 何凌云
體外受精/卵胞質內單精子顯微注射(in vitro fertilization/intracytoplasmic sperm injection,IVF/ICSI)的目標是盡快獲得活產。波塞冬標準將卵巢次優反應人群定義為年齡<35歲,抗苗勒管激素(anti-Müllerian hormone,AMH)>1.2ng/ml,雙側卵巢竇卵泡數(antral follicle count,AFC)≥5個,標準劑量控制性卵巢刺激(controlled ovarian hyperstimulation,COH),獲卵數4~9個[1]。該人群占IVF/ICSI人群的43%,與獲卵>15個的卵巢高反應患者比較,該人群發生卵巢過度刺激綜合征(ovarian hyperstimulation syndrome,OHSS)的風險低[2]。與35歲以上、獲卵數≤3個的卵巢低反應者比較,該人群卵子整倍體率高,新鮮周期無可移植胚胎的風險較低[3];故優化這一群體的促排方案,盡量爭取新鮮周期移植,具有重要臨床意義。
GnRH拮抗劑(gonadotropin-releasing hormone antagonist,GnRH-A)方案與GnRH激動劑(gonadotropin-releasing hormone agonist, GnRH-a)方案比較,在控制早發黃體生成激素(luteal hormone,LH)峰出現的同時,能縮短治療周期[4]。筆者醫院生殖中心自2014年開始采用拮抗劑方案,從雌激素(estradiol,E2)預處理、黃體支持等方面對該方案不斷完善,但新鮮周期胚胎移植率在卵巢次優反應人群中始終較低,本研究旨在分析其影響因素,并探討對策[5,6]。
材料與方法
1.研究對象:2016年7月1日~2018年6月30日筆者醫院生殖中心采用GnRH拮抗劑靈活方案(以下簡稱拮抗劑方案)和GnRH激動劑黃體期長方案(以下簡稱長方案)COH并取卵的卵巢次優反應患者的臨床資料,分為拮抗劑組和長方案組,拮抗劑組根據是否新鮮周期胚胎移植及取消移植原因分為鮮胚移植亞組、高孕酮取消移植亞組。
2.納入標準:年齡<35歲,AMH≥1.2ng/ml,基礎促卵泡素(base-follicle-stimulating hormone,bFSH) ≤12IU/L,雙側卵巢基礎竇卵泡數(AFC 5~15個,獲卵數4~9個,體重指數(body mass index,BMI) 17~25kg/m2。
3.排除標準:①有高泌乳素血癥或合并甲狀腺、腎上腺等其他內分泌系統疾病;②擬行胚胎植入前遺傳學檢測;③助孕周期數>2個;④合并子宮腺肌癥、子宮腔粘連、宮腔占位者;⑤隨訪至2020年6月30日尚未活產且還有冷凍胚胎者,或雖已獲臨床妊娠但尚未活產者;⑥失訪者。
4.新鮮周期取消移植標準:①OHSS風險:扳機日E2>5000pg/ml或穿刺卵泡數>20個、或獲卵數>15個;②子宮內膜因素:宮腔粘連、擬移植日存在宮腔積液或內膜厚度<6mm等;③早發孕酮升高:扳機日孕酮≥1.5ng/ml;④胚胎因素:包括未獲卵、未正常受精、胚胎退化等;⑤其他因素:包括擬移植日女方身體不適、男方未到場、證件不符等情況。
5.優質卵裂胚標準延用1999年Peter卵裂胚評分標準: ①卵裂球均一、無多核、空泡等現象;②碎片率≤20%; ③第3天7~9個卵裂球。優質囊胚標準:根據GARDNER標準對囊胚評分,第5/6天4BC或4CB以上囊胚為優質囊胚[7]。
6.控制性卵巢刺激方案:(1)拮抗劑方案:患者自COH前次月經黃體中期開始口服雌激素預處理藥物17β-雌二醇(芬嗎通紅色片,荷蘭雅培制藥有限公司)2mg,每天2次,月經來潮第2天停預處理藥同時開始每日使用外源性促性腺激素(gonadotropin,Gn)基因重組人促卵泡素(果納芬,瑞士默克雪蘭諾制藥有限公司),150~225IU;當最大卵泡直徑≥10mm或血清E2>500pg/ml,且血清LH較Gn啟動日有上升趨勢時,注射GnRH拮抗劑(西曲瑞克,瑞士默克雪蘭諾制藥有限公司)0.125~0.250mg/d;根據卵泡生長及激素水平調整Gn及拮抗劑使用劑量,當至少3個優勢卵泡直徑達17mm時,當日20:30時左右注射人絨毛膜促性腺激素(安徽豐原藥業股份有限公司)6000~10000IU扳機。36~38h后陰道超聲引導下經陰道穿刺取卵。(2)長方案:患者自COH前次月經黃體中期開始使用長效制劑(醋酸曲普瑞林,法國博福益普生制藥公司)1.13~1.31mg肌內注射1次,或短效GnRH-a (醋酸曲普瑞林,法國博福益普生制藥公司) 0.05mg每日皮下注射,14天后測性激素和卵泡直徑,達垂體降調節標準(LH<5IU/L,E2<50pg/ml,卵泡直徑<7mm,內膜<5mm,無功能性囊腫),啟動Gn誘導卵泡發育,適時扳機,扳機標準及藥物同拮抗劑方案。(3)體外受精和胚胎培養及移植:取卵當日取精,根據男方精液情況行常規IVF或ICSI,移植第3天卵裂期胚胎1~2枚,其余繼續行囊胚培養和冷凍,本研究中無新鮮囊胚移植病例。移植后按各方案常規行黃體支持。移植后14天查血β-hCG>50IU確定為生化妊娠,移植后28天經陰道超聲見宮內孕囊及胎心為臨床妊娠,活產按國內定義為妊娠28周后分娩的活產嬰兒。(4)凍融胚胎移植:新鮮胚胎移植未妊娠者或全胚冷凍者,如有冷凍胚胎,自取卵次月開始行凍融胚胎移植,采用自然周期或激素替代周期準備內膜,移植1~2枚囊胚或卵裂胚,黃體支持按常規進行。妊娠及活產觀察同新鮮周期移植。
7.觀察指標:包括納入人群的一般資料、臨床和實驗室情況。其中臨床妊娠率(%)=臨床妊娠周期數/總移植周期數×100%、流產率(%)=流產周期數/臨床妊娠周期數×100%、每取卵周期累積活產率(%)=活產周期數/取卵周期數×100%、移植取消率(%)=取消移植周期數/周期總數×100%[8]。
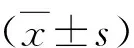
結 果
1.基本情況:拮抗劑方案(n=169)與長方案(n=148)兩組間、拮抗劑方案鮮胚移植(n=119)與高孕酮取消移植(n=32)兩亞組間,患者的年齡、BMI、AFC、bFSH、bLH、AMH等比較,差異均無統計學意義(P>0.05),詳見表1、表2。


2.拮抗劑方案與長方案治療結局比較:組間每取卵周期累積活產率比較,差異無統計學意義(P>0.05);兩組新鮮周期移植的臨床妊娠率、流產率、宮外孕率比較,差異均無統計學意義(P>0.05)。拮抗劑方案新鮮周期移植取消率為29.58%(50/169),明顯高于長方案的10.81%(16/148),差異有統計學意義(P<0.05),詳見表3。

3.拮抗劑方案與長方案取消移植原因比較:拮抗劑方案新鮮周期因扳機日孕酮升高取消移植32例,占該組總數的18.93%,與長方案的3.37%比較,差異有統計學意義(P<0.05),是該方案取消鮮胚移植的最主要原因,詳見表4。

表4 兩方案新鮮周期取消移植原因比較[n/N(%)]
4.拮抗劑方案鮮胚移植與因高孕酮取消移植亞組間Gn使用情況比較:高孕酮亞組較鮮胚移植亞組Gn啟動日促卵泡素、血清雌二醇更低,血清促黃體生成素較高,差異均有統計學意義(P<0.05);兩組Gn啟動日孕酮、Gn總量、Gn總天數比較,差異無統計學意義(P>0.05),詳見表5。

5.拮抗劑方案鮮胚移植與因高孕酮取消移植亞組間拮抗劑使用情況比較:高孕酮亞組更早添加拮抗劑,加拮抗劑日雌二醇較低、孕酮較高,拮抗劑總劑量、總天數較多,差異均有統計學意義(P<0.05),詳見表6。

6.拮抗劑方案鮮胚移植與因高孕酮取消移植亞組間扳機日情況及胚胎結局:高孕酮亞組扳機日血清孕酮較高(0.85±0.27ng/ml vs 1.84±0.63ng/ml),差異有統計學意義(P<0.05)。兩組扳機日雌二醇、促黃體生成素、獲卵數、優胚數、優質囊胚數比較,差異均無統計學意義(P>0.05),詳見表7。

討 論
1.卵巢次優反應人群界定的意義:2016年發布的波塞冬標準將卵巢低反應人群分為4類,第1類指年齡<35歲、AFC≥5枚、AMH≥1.2ng/ml的卵巢正常儲備人群常規COH出現非預期的低反應,此組進一步分為1a組(獲卵數<4枚)、1b組(獲卵數4~9 枚)[1]。本研究針對的人群嚴格按波塞冬1b組納入,且限定FSH≤12IU/L、基礎竇卵泡數5~15個、BMI為17~25kg/m2等標準,目的是減少“預估卵巢高儲備”、體重等因素對COH方案和劑量選擇的干擾,避免研究結果偏倚[9]。
2.不同COH方案對卵巢次優反應人群新鮮周期取消移植的影響:黃體期長方案和短效長方案避免了超長方案對垂體的過度抑制,適度的降調節使卵泡同步性和內膜容受性優于拮抗劑方案[10]。拮抗劑方案則可以使垂體快速脫敏而無“點火”效應,且較長方案治療周期短,因此,在卵巢次優人群中,黃體期長方案和拮抗劑方案的抉擇一直是爭議的焦點[11]。本研究中拮抗劑方案與激動劑黃體期長方案比較,新鮮周期臨床妊娠率、每取卵周期累積活產率比較差異均無統計學意義,這點與Toftager等[12]的研究結論相似。但本研究顯示,拮抗劑方案新鮮周期移植取消率高達29.58%,顯著高于長方案的10.81%,其中因早發孕酮升高取消移植占該方案人群的18.9%,也顯著高于與長方案的3.37%,全胚冷凍增加了患者到達活產的時間和經濟成本,近年來有研究顯示,凍胚移植較鮮胚移植子代出生體重增加及孕婦子癇前期風險增加[13]。因此,對于卵巢次優反應人群,無論是拮抗劑方案還是黃體期長方案,都應爭取新鮮周期移植。
3.卵巢次優反應人群早發孕酮升高取消鮮胚移植的界定:晚卵泡期的孕酮升高不僅影響子宮內膜容受性,一項大樣本回顧性分析還發現,無論激動劑方案還是拮抗劑方案,優胚率的減少與扳機日孕酮升高有關,優胚率顯著降低時的孕酮界值在卵巢高反應人群為 1.8ng/ml,在卵巢正常儲備人群為 1.5ng/ml[14]。卵巢次優反應人群有正常的卵巢儲備,因此,本研究將取消新鮮周期移植的扳機日孕酮界值定在1.5ng/ml。本研究中孕酮升高并未影響優胚率和優質囊胚形成率,可能是因為本研究樣本量較小,且針對的是卵巢正常儲備的<35歲年輕人群。
4.拮抗劑靈活方案早發孕酮升高的原因分析及對策探討
(1)與雌激素預處理反應不良有關:卵泡的募集始于前個月經周期黃體晚期雌、孕激素水平下降后對垂體負反饋狀態的解除。筆者醫院生殖中心自2014年開始嘗試對拮抗劑靈活方案使用雌激素預處理,王彩霞等[4,7]研究發現,正常反應和低反應人群雌激素預處理可以改善卵泡同步性,增加累積妊娠率。本研究中,高孕酮取消移植亞組較鮮胚移植亞組經雌激素預處理后的血清E2水平明顯偏低,血清LH水平明顯偏高,可能與雌激素對垂體負反饋作用不足有關;雖然兩組AFC比較差異無統計學意義,但高孕酮亞組添加拮抗劑日生長卵泡較多、血清孕酮較高,即使早加拮抗劑也無法阻止扳機日孕酮的升高,差異有統計學意義;同時,雌激素負反饋作用不足致前一周期黃體晚期卵泡提前募集,導致COH過程卵泡同步性差,拮抗劑日較多的生長卵泡(8.51±1.16個vs 7.83±1.39個)并未增加最終的合格卵數和優胚數。筆者醫院生殖中心添加雌激素的時機選擇在黃體中期至月經來潮第2天擬啟動Gn日,根據藥代動力學研究,每天口服雌二醇,約5天后血清雌二醇達穩態,消除半衰期在10~16h。有研究認為,延長雌激素預處理時間可以改善卵泡同步性,包括從前次月經周期排卵后3天開始用藥、Gn啟動后繼續使用雌激素至扳機日,目的在預防停用雌激素后內源性FSH的反應性升高和FSH受體的下調、增強對顆粒細胞FSH受體的刺激作用,提高胚胎質量[15,16]。因此對于月經第2天E2水平偏低患者重復周期時可以考慮延長雌激素預處理時間。
(2)可能與外源性Gn和拮抗劑使用劑量、時間有關:大樣本Meta分析提示,外源性Gn每日劑量過高、天數延長與扳機日孕酮升高及妊娠率下降有關,原因在于持續外源大劑量促卵泡素刺激使顆粒細胞來源的孕酮合成增多[17]。當LH足夠時,孕酮在膜細胞轉化為雄激素,如LH不足則代謝受阻、孕酮累積,且雌激素合成分泌障礙,進而影響卵泡的發育及成熟。同樣,若拮抗劑過早添加、總劑量過大,或患者對藥物特別敏感均有可能出現垂體抑制過度,血清促黃體生成素水平過低,卵巢反應性降低、Gn 時間延長及用量增加。本研究中高孕酮亞組拮抗劑使用天數更長、總量更多,差異有統計學意義;Gn總量較鮮胚移植亞組有升高趨勢,差異雖無統計學意義,但提示個體化地選擇合適的Gn啟動劑量和GnRH-A添加時機、促排過程適時調整二者劑量、及時扳機可能有助于預防早發孕酮升高。
(3)可能與腎上腺來源或上周期黃體來源孕酮及有關:早卵泡期的孕酮主要來源于腎上腺,本研究中,高孕酮亞組Gn啟動日孕酮與鮮胚移植亞組比較(1.07±0.90ng/ml vs 0.87±0.77ng/ml),差異無統計學意義,但呈升高趨勢[18]。一項關于地塞米松對早卵泡期孕酮升高女性IVF治療結局影響的前瞻性研究證明小劑量地塞米松可降低COH過程的孕酮水平,隨訪至嬰兒生后1年未發現不良妊娠結局,因此對于早發孕酮升高患者可以考慮添加小劑量地塞米松,但地塞米松對于超促排卵的影響目前業界尚無定論[19]。另外,在非降調節COH方案,如上1個月經周期的黃體萎縮不全,也可導致下1個周期中黃體來源的早卵泡期孕酮水平異常偏高,有研究者提出,在COH前連續3天使用GnRH拮抗劑可使孕酮水平正常化[20]。
綜上所述,卵巢次優反應人群具有年輕、卵巢儲備功能正常的特點,與激動劑黃體期長方案比較,行拮抗劑方案同樣可以取得良好的妊娠結局,但新鮮周期因早發孕酮升高取消移植率高。識別偏高的孕酮來源,剖析其危險因素,通過調整預處理策略、個體化地選擇Gn劑量、GnRH-A添加時機,或重復周期時改行激動劑方案有助于降低早發孕酮升高風險,提高這部分人群鮮胚移植率。進一步可以針對各個危險因素設計前瞻性隊列研究以更好地指導臨床實踐。
本研究通過近年來筆者醫院生殖中心卵巢次優反應患者拮抗劑方案與激動劑黃體期長方案患者的臨床、實驗室相關指標的回顧性隊列研究發現,盡管卵巢次優反應人群拮抗劑方案新鮮周期移植取消率高于激動劑黃體期長方案,但兩方案每取卵周期累積活產率相似。早發孕酮升高是拮抗劑靈活方案新鮮周期移植取消率高的最主要原因。危險因素包括雌激素預處理反應不良、外源性促卵泡素和拮抗劑使用劑量過大或時間過長、早卵泡期腎上腺來源的孕酮水平偏高等。

