CT-707對缺氧微環境下肝癌細胞能量代謝和細胞周期的影響及作用機制
姚紅兵 吳嘉興 郭 威 文雪霖 蔣建暉 劉翔峰
肝細胞癌(肝癌)是常見的惡性腫瘤,缺氧是惡性腫瘤微環境的主要特征之一,肝癌細胞在缺氧環境下可通過增強糖酵解代謝方式,維持細胞增殖的能量需求,從而促進肝癌進程[1,2]。糖原合成激酶(glycogen synthase kinase-3β, GSK-3β)介導的信號通路對細胞的增殖、分化及能量代謝具有重要作用,其活性受到Akt的調控。黏著斑激酶(focal adhesion kinase, FAK)是一種胞質非受體蛋白酪氨酸激酶,與腫瘤的多種生物學行為密切相關,磷酸化的FAK可通過結合PI3K/Akt促進癌細胞的增殖[3]。研究發現,FAK在肝癌組織中異常表達及活化,并與肝癌進展有顯著相關性,可作為肝癌藥物開發的新靶標[4]。多激酶抑制劑CT-707是一種新型FAK抑制劑,可通過抑制FAK的磷酸化發揮良好的抗腫瘤活性[5]。筆者前期研究已證實CT-707在肝癌動物模型中可抑制肝癌細胞的增殖以及腫瘤形成,促進癌細胞的凋亡[6]。故本研究結合肝癌細胞在缺氧微環境中的代謝特點,基于PI3K/Akt/GSK-3β信號通路,旨在進一步探討新型FAK抑制劑CT-707的抗肝癌作用及機制。
材料與方法
1.試驗材料:人肝癌HepG2細胞株購自中國科學院上海細胞庫,使用含10%胎牛血清及1%雙抗的改良Eagle培養基(DMEM)培養基,于5%CO2、37℃培養箱中常規培養。6周齡BALB/c裸鼠購自廣西醫科大學實驗動物中心,在SPF級條件下飼養。CT-707購自美國MCE公司;DMEM、胎牛血清購自美國Gibco公司;cyclin D1、cyclin E、p-FAK、FAK、PI3K、Akt、p-GSK-3β、GSK-3β、PCNA、β-actin抗體購自英國Abcam公司;p-PI3K、p-Akt抗體購自美國CST公司;羊抗鼠二抗、羊抗兔二抗購自美國Sigma公司;HE染色試劑盒、己糖激酶(HK)試劑盒、BCA蛋白定量試劑盒購自北京Solarbio公司;乳酸脫氫酶(LDH)試劑盒購自南京建成生物;CCK-8試劑盒購自上海碧云天生物公司。
2.HepG2缺氧培養及分組:將HepG2細胞接種于6孔板中,每孔細胞數2×105,參照文獻[5,7]按CT-707劑量范圍(0~6μmol/L)分為control(對照)組以及處理組[CT-707高(6μmol/L)、中(3μmol/L)、低(1.5μmol/L)劑量組]。根據實驗分組,處理組分別加入相應劑量的含藥DMEM,對照組則加入無藥DMEM,各組均于37℃缺氧培養箱(2%O2、5%CO2、93%N2)中培養48h。
3.CCK8:將對數生長期的HepG2接種于96孔板中,根據分組進行相應處理,并設置空白對照(空白組),培養48h后,每孔加入10μl CCK8工作液,37℃培養2h,酶標儀檢測450nm波長處的吸光度(A)值,計算細胞存活率:細胞活性(%)=(A處理組-A空白組) /(A對照組-A空白組)×100%。
4.HK酶活性檢測:收集各組細胞,培養基稀釋為5×106/ml,加入1ml提取液,冰浴超聲提取,重復操作多次使細胞充分破碎,8000×g4℃離心10min,取上清待測。取50μl待測液于EP管中,加入950μl工作液,混勻后快速移至微量石英比色皿中,紫外分光光度儀測定340nm波長下吸光度A1。將反應液置于37℃中水浴2min,立即測定吸光度A2。計算HK酶活[U/(gpro)]=(A2-A1)/毫摩爾消光系數/反應時間/比色光徑×(反應液總體積/取樣量)×1000。
5.LDH含量檢測:胰酶消化收集各組HepG2,進行計數,離心棄上清,按5×106個細胞加入1ml提取液的比例加入提取液,冰浴超聲波提取2min,8000×g4℃離心10min,根據LDH試劑盒試劑盒說明書配置標準品和樣品,按步驟加入樣本和基質緩沖液、輔酶Ⅰ,37℃反應15min,加入2,4-二硝基苯肼,漩渦混勻,37℃孵育15min,加入NaOH溶液室溫放置3min,440nm波長,1cm光徑比色,按標準曲線計算LDH含量。
6.Western blot法檢測:各組HepG2用預冷的PBS洗滌2次,RIPA裂解液冰上裂解30min,低溫離心取上清,行BCA蛋白定量。每孔蛋白上樣量為20μg,SDS-PAGE電泳,濕法轉膜。5%脫脂牛奶室溫封閉1h,一抗4 ℃孵育過夜,TBST洗膜3次。二抗室溫孵育1h,洗膜3次,用ECL檢測液發光顯影定影后,Image J分析灰度值。
7.裸鼠皮下成瘤及藥物治療:將對數生長期的HepG2胰酶消化收集,1000×g離心5min,取細胞沉淀重懸,制成細胞濃度為2.5×107/ml懸液。于無菌環境下,采用1ml注射器抽取0.2ml細胞懸液,在常規消毒的裸鼠腋部皮膚進行細胞懸液接種。根據實驗動物3R原則,將接種HepG2細胞懸液的裸鼠隨機分為4組,分為模型組和CT-707高(100mg/kg)、中(50mg/kg)、低(25mg/kg)劑量組,每組8只,CT-707按照劑量腹腔注射給藥,每天兩次,模型組則注射等量0.9%氯化鈉溶液[7]。給藥14天后處死動物,取腫瘤組織進行稱重及體積測量。
8.HE染色:腫瘤組織于4%多聚甲醛中固定,行石蠟切片,根據HE試劑盒說明進行染色,封片,鏡檢,觀察組織病理結構。
9.免疫組化:取各組腫瘤組織切片進行免疫組化染色。采用微波抗原修復后,滴加3% H2O2以去除內源性過氧化物酶活性,蒸餾水洗凈。滴加封閉液室溫孵育,一抗4℃過夜孵育。棄去一抗,PBS沖洗,滴加二抗,室溫孵育20min,棄去二抗。滴加辣根酶標記鏈霉卵白素工作液,室溫孵育20min,PBS洗凈后滴加DAB顯色。著色后浸入水中終止反應,自來水反復沖洗后,蘇木精復染;梯度乙醇脫水,二甲苯透明,中性樹膠封片,光鏡下觀察并拍照。Image J軟件分析PCNA的陽性表達。
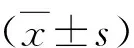
結 果
1.缺氧環境下CT-707對肝癌細胞活性、能量代謝及細胞周期的影響:與對照組比較,CT-707高、中、低劑量組HepG2細胞活性下降,HK活性及LDH含量顯著下調,細胞周期蛋白cyclin D1、cyclin E顯著下調(P<0.05),中、高劑量組的效應明顯優于低劑量組(P<0.05),中、高劑量組間結果比較,差異無統計學意義(P<0.05,圖1、圖2)。
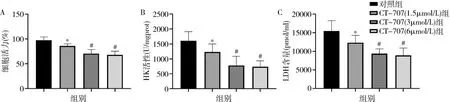
圖1 各組細胞活性、HK活性及LDH含量檢測結果A.細胞活性;B.HK活性;C.LDH含量。與對照組比較,*P<0.05;與CT-707(1.5μmol/L) 組比較,#P<0.05
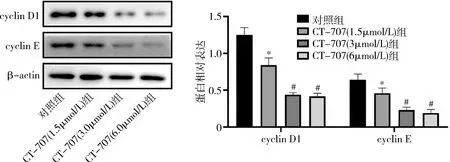
圖2 各組細胞中cyclin D1和cyclin E的蛋白表達與對照組比較,*P<0.05;與CT-707(1.5μmol/L) 組比較,#P<0.05
2.缺氧環境下CT-707對FAK/PI3K信號通路的影響:與對照組比較,CT-707高、中、低劑量組HepG2中FAK、PI3K、GSK-3β、p-FAK/FAK、p-PI3K/PI3K、p-Akt/Akt、p-GSK-3β/GSK-3β水平均明顯下調,中、高劑量組的效應明顯優于低劑量組(P<0.05),中、高劑量組間結果比較,差異無統計學意義(P>0.05),各組Akt蛋白表達比較,差異無統計學意義(P>0.05,圖3)。
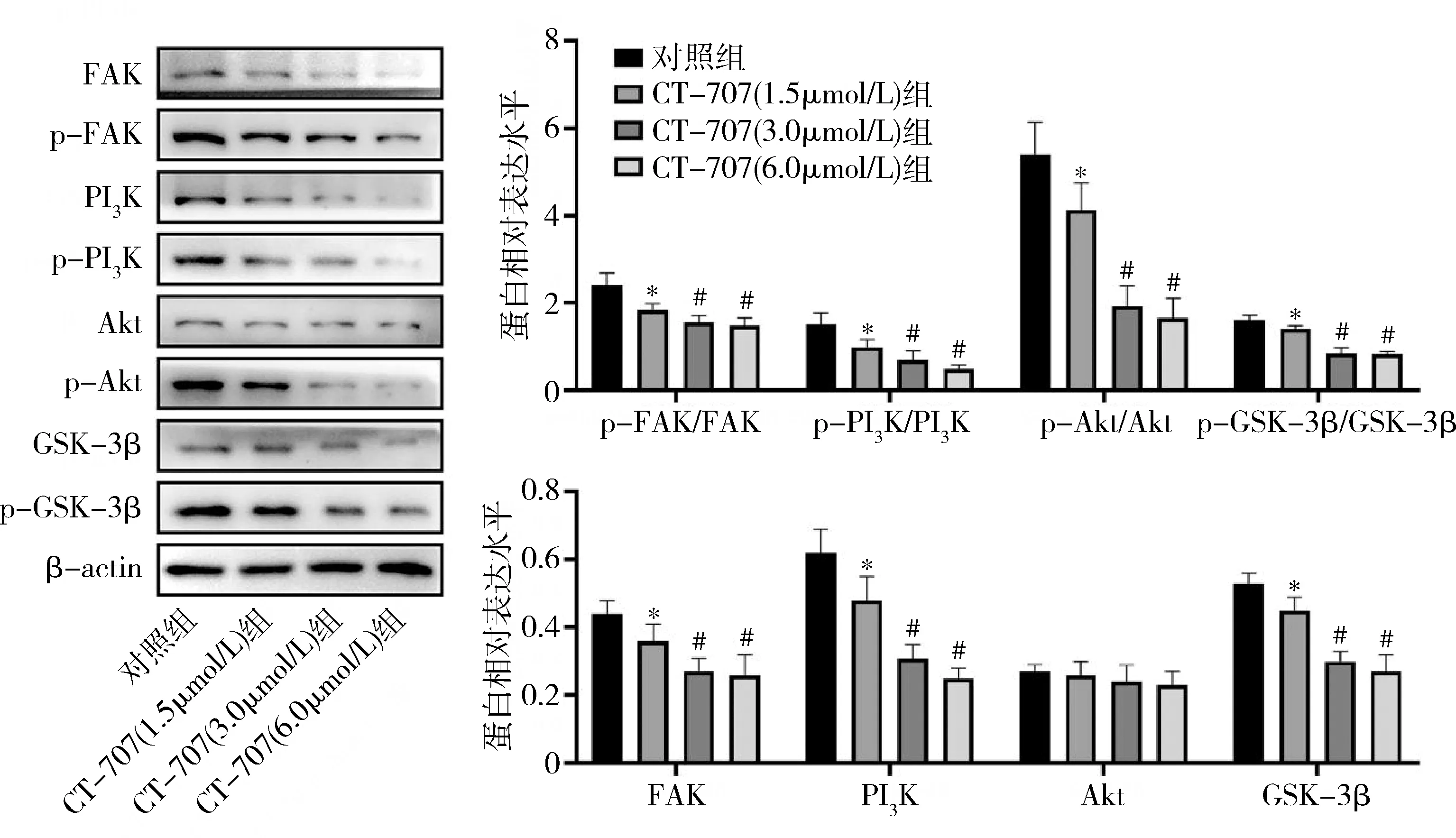
圖3 FAK/PI3K信號通路關鍵因子的Western blot法檢測結果
3.CT-707對HepG2裸鼠移植瘤的抑制作用:與模型組比較,CT-707高(100mg/kg)、中(50mg/kg)、低(25mg/kg)劑量組瘤質量、瘤體積明顯下降(P<0.05),其中中、高劑量組的效應明顯優于低劑量組(P<0.05),中、高劑量組間結果比較,差異無統計學意義(P>0.05,圖4)。
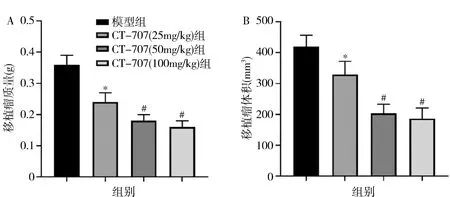
圖4 裸鼠移植瘤質量和體積A.移植瘤質量;B.移植瘤體積;與模型組比較, *P<0.05; 與CT-707(25 mg/kg) 組比較, #P<0.05
4.CT-707對HepG2裸鼠移植瘤細胞增殖及壞死的影響:采用HE染色檢測HepG2裸鼠移植瘤細胞壞死情況。鏡下觀察模型組細胞核清晰可見,細胞排列整齊致密;CT-707高(100mg/kg)、中(50mg/kg)、低(25mg/kg)劑量組細胞排列松散,部分細胞核消失,出現壞死區域,且隨著CT-707劑量增加,壞死區域增加,細胞核消失增加。采用免疫組化檢測HepG2裸鼠移植瘤中PCNA的表達情況,結果表明,與模型組比較,CT-707高(100mg/kg)、中(50mg/kg)、低(25mg/kg)劑量組PCNA陽性細胞表達率均顯著降低(P<0.05),中、高劑量組的效應明顯優于低劑量組(P<0.05),中、高劑量組間結果比較,差異無統計學意義(P>0.05,圖5、圖6)。
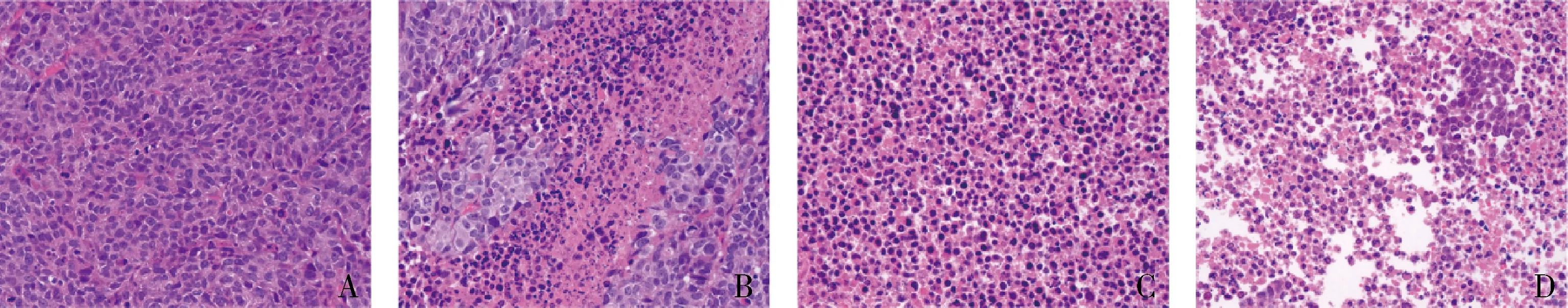
圖5 各組移植瘤的HE染色比較(×400)A.模型組;B.CT707(25mg/kg)組;C.CT707(50mg/kg)組;D.CT707(100mg/kg)組
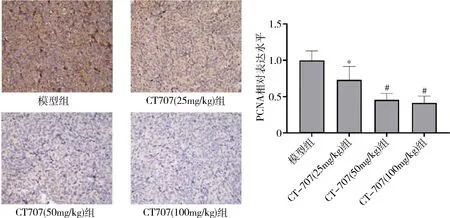
圖6 各組移植瘤中PCNA的陽性表達比較(×400)與模型組比較, *P<0.05; 與CT-707(25mg/kg) 組比較, #P<0.05
討 論
肝癌發病隱匿且病情進展迅速,患者確診時大多已在進展期或晚期。肝癌細胞的快速增殖,是導致肝癌病情進展迅速的重要原因[8]。惡性腫瘤增殖過程伴隨高速代謝,在快速生長的同時,氧耗劇增,且腫瘤內新生血管滯后引起血氧供應不足,從而造成腫瘤組織局部缺氧,此時癌細胞可通過增強糖酵解,并轉而依賴糖酵解途徑作為主要能量供給來源,適應缺氧微環境。腫瘤在缺氧微環境中的持續增殖,是多種蛋白作用的結果,其中缺氧可誘導FAK激活,FAK可通過PI3K/Akt等多條信號通路參與增殖和腫瘤的形成[9]。CT-707是一種新型多激酶抑制劑,可抑制FAK、ALK和Ply2蛋白的活性,研究表明,CT-707在缺氧環境下對HepG2具有更強的增殖抑制效果,但其作用機制尚未完全闡明[7]。因此,本研究通過建立HepG2缺氧模型及皮下成瘤動物模型,進一步觀察CT-707對HepG2糖酵解途徑及細胞周期的影響,探討其抗肝癌細胞增殖的作用機制。
糖酵解代謝模式為癌細胞的增殖提供了物質基礎,使得癌細胞在缺氧等環境中存活和增殖[10]。HK是糖酵解途徑的關鍵酶,可將葡萄糖轉化為6-磷酸葡萄糖,在缺氧條件下為癌細胞提供碳源,HK在包括肝癌在內的癌組織中大量表達,可促進癌細胞的增殖及糖酵解[11]。LDH是催化糖酵解的限速酶之一,可將丙酮酸轉化為乳酸排至胞外。LDH在多種腫瘤組織中表達升高,其表達與腫瘤組織的大小顯著相關,可作為腫瘤診斷的標志物[12]。此外,癌細胞通過調控細胞周期的時相分布從而實現快速增殖。細胞周期蛋白的表達和調控,是控制細胞周期轉換,影響增殖的關鍵因素。
細胞周期蛋白cyclin D1、cyclin E可引起DNA復制,推動細胞周期由G1期進入S期,從而促進癌細胞的增殖[13]。本研究發現,CT-707在缺氧培養條件下抑制HepG2細胞增殖的同時,可降低HK和LDH的含量,抑制cyclin D1、cyclin E的表達,表明CT-707可阻斷缺氧環境下肝癌細胞糖酵解代謝途徑,并誘導細胞周期阻滯,具有顯著的抗肝癌細胞增殖的效應。
cyclin D1、cyclin E及HK、LDH的表達受GSK-3β的調控[14, 15]。GSK-3β通過介導細胞內多種信號轉導通路,磷酸化使底物蛋白失活發揮負性調節作用,是細胞內糖代謝、細胞增殖、分化及凋亡調控的關鍵因子[16]。研究發現,GSK-3β在肝癌組織中的表達水平低于正常肝組織及癌旁組織,其表達與組織病理學評分、腫瘤分級相關[17]。PI3K/Akt是GSK-3β上游信號通路,Akt可磷酸化GSK-3β Ser9位點,抑制GSK-3β的活性,促進糖酵解及細胞周期蛋白的表達,進而促進癌細胞的增殖[18]。抑制PI3K/Akt/GSK-3β信號通路是多種藥物的抗腫瘤作用機制,而FAK可參與調控PI3K/Akt信號通路,因此推測FAK抑制劑CT-707可通過抑制PI3K/Akt/GSK-3β發揮抗肝癌作用。本研究發現CT-707可顯著下調缺氧培養下HepG2中p-PI3K/PI3K、p-Akt/Akt和p-GSK-3β/ GSK-3β表達水平,且CT-707中、高濃度時作用更明顯,表明CT-707抑制PI3K/Akt/GSK-3β信號通路可能是其抑制肝癌細胞增殖的關鍵機制。
為進一步研究CT-707對肝癌細胞增殖的影響及機制,本研究對皮下種植HepG2的裸鼠給予CT-707治療,發現CT-707可顯著減小移植瘤的體積和質量,破壞癌組織結構,表明CT-707具有顯著的抗肝癌作用。PCNA是DNA復制的必須物質,與細胞中DNA合成及細胞周期密切相關。PCNA的表達從G1期開始升高,S期表達達到高峰,到G2期逐漸下降,是反映細胞增殖的主要生物學指標[19]。本研究發現,CT-707可顯著下調PCNA陽性細胞比例,進一步從體內研究證實CT-707可引起肝癌細胞周期阻滯,抑制細胞增殖活性,從而發揮抗肝癌作用。
綜上所述,本研究發現FAK抑制劑CT-707在缺氧環境下可通過抑制PI3K/Akt/GSK-3β信號通路,阻斷肝癌細胞糖酵解代謝途徑,并誘導細胞周期阻滯,抑制肝癌細胞增殖及腫瘤生長,表明CT-707作為一種FAK靶向抑制劑具有良好的抑癌作用,可能是潛在的腫瘤靶向藥物,值得深入研究。

