非小細胞肺癌患者免疫檢查點抑制劑治療后胸壁結核1例報告并文獻復習
林心情 鄧海怡 楊伊霖 周承志
患者女性,80 歲,因咯血就診于廣州醫科大學附屬第一醫院。既往無肝炎、結核病史。胸部CT 顯示右中上肺中央型病灶并阻塞性炎癥、肺不張,右肺門、縱隔淋巴結轉移(圖1A),進一步行PET-CT 檢查提示右中上葉分葉腫塊,代謝增高,考慮中央型肺癌,病灶阻塞右上葉前段支氣管伴遠端阻塞性肺炎;左上肺尖后段結節,考慮轉移;右肺門、雙側縱隔淋巴結增大,代謝增高。患者行痰標本結核分枝桿菌DNA、Xpert-Mtb/RIF 試驗和干擾素-γ 釋放試驗均為陰性,不考慮肺結核的診斷。患者經支氣管鏡活檢標本病理學檢查確診為鱗狀細胞癌,并通過22C-3 免疫組織化學檢測程序性細胞死亡蛋白-配體1(programmed cell death ligand-1,PD-L1)表達陰性。行基因檢測未見驅動基因突變。臨床診斷為原發性支氣管肺癌,鱗狀細胞癌,cT4N3M1a,ⅣA 期,驅動基因陰性。患者及家屬考慮患者高齡,不同意化療,經商量后,選用信迪利單抗單藥治療。患者于2019年9月開始接受信迪利單抗200 mg 作為一線治療。
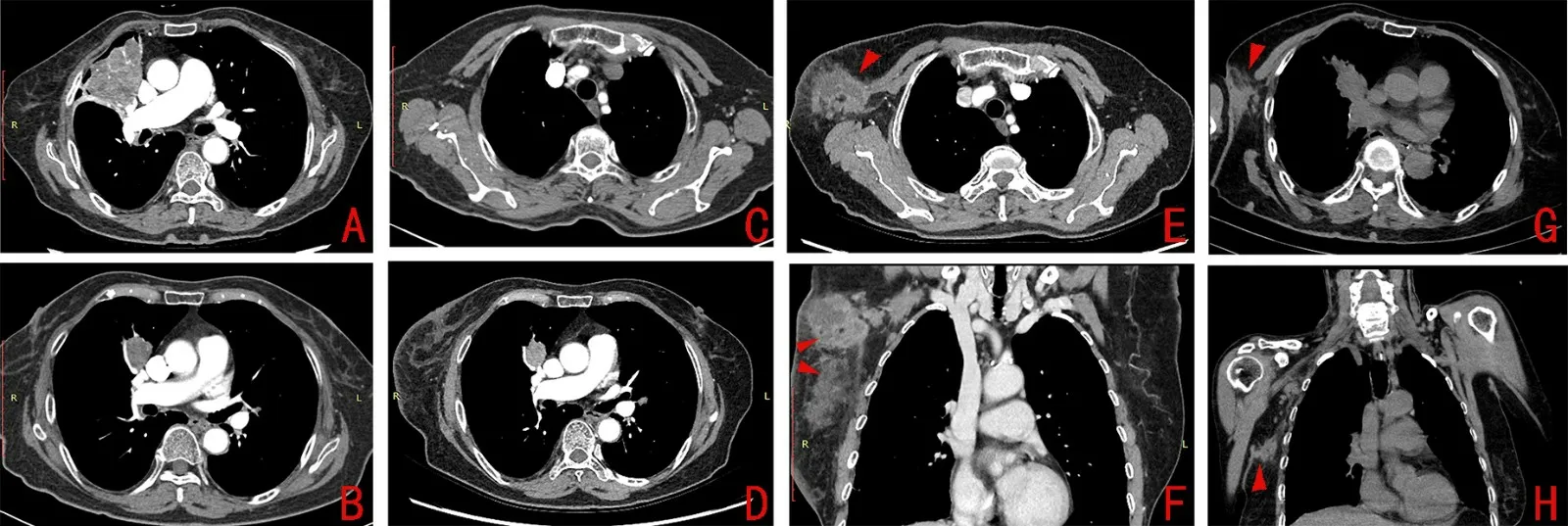
圖1 肺癌病灶及胸壁結核病灶變化的影像
患者于2019年10月(2 個周期免疫治療后)行胸部CT 顯示肺部原發腫瘤病灶縮小(圖1B),達到部分緩解(partial response,PR),無胸壁腫塊(圖1C)。經過6 個周期免疫治療后,于2020年1月患者發現其右胸壁出現腫塊。2月行胸部CT 提示肺癌病灶縮小,縱隔和肺門淋巴結維持穩定(圖1D),右側胸壁出現腫塊(圖1E 和1F)。患者在超聲引導下穿刺胸壁腫塊,經病原微生物宏基因組測序和穿刺液培養都發現結核分枝桿菌,T-SPOT 檢測陽性,支持胸壁結核的診斷。而患者無發燒、咳嗽、體質量減輕和盜汗等典型的結核病癥狀。3月患者開始使用異煙肼、利福平、乙胺丁醇和吡嗪酰胺治療結核病,并予胸壁腫塊穿刺引流。之后病灶穿刺液結核菌培養復查陰性。在抗結核治療期間,患者繼續予信迪利單抗治療。再行胸部CT 檢查發現,結核病灶明顯縮小(圖1G 和1H)。患者在免疫治療和抗結核藥物同時使用期間,未出現肝功能損害等不良反應。患者結核病發展歷程見圖2。
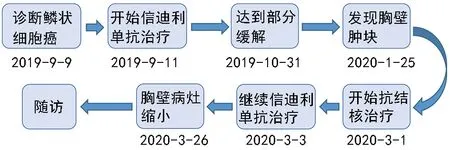
圖2 接受信迪利單抗治療非小細胞肺癌患者的結核病發展歷程
小結免疫檢查點抑制劑(immune checkpoint inhibitors,ICIs)對多種實體腫瘤以及慢性感染性疾病(包括艾滋病、結核病和瘧疾)均有療效[1]。ICIs 治療期間出現活動性結核病已有報道,但信迪利單抗治療后出現胸壁結核鮮有報道。該患者在6 個周期免疫治療后發生結核病,而且抗結核治療期間并未暫停免疫治療。
目前,全球可查到僅有25 例免疫治療相關結核病的報告(表1)[2-18]。25 例患者中,非小細胞肺癌16 例,黑色素瘤5 例,淋巴瘤、Merkel 細胞瘤、頭頸部鱗癌、鼻咽癌各1 例,平均年齡為67(49~87)歲。發生活動性肺結核的中位時間為免疫治療開始的3.5(1~24)個月,中位的免疫治療周期為8(2~41)個周期。在25 例中,7 例死亡(28.0%),只有4 例患者在免疫治療前有明確的結核病病史,4 例患者進行了結核病篩查。值得注意的是,并不是有結核病史的患者在免疫治療后都會出現活動性結核[16]。除6 例未提及既往抗腫瘤治療史的患者,19 例患者中17 例(89.5%)在ICIs 治療前接受過手術、化療、放療或其他抗腫瘤治療。因此,ICIs 前的抗腫瘤治療可能會增加活動性結核病的風險。13 例患者ICIs 治療前曾使用過化療,有報道顯示使用化療會導致活動性結核[19]。糖皮質激素和腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)抑制劑也有導致活動性結核的風險[20-21]。在結核發生前,有4 例患者使用糖皮質激素,其中2 例因免疫相關不良反應使用;3 例曾予TNF-α 抑制劑治療。然而,本研究病例在免疫治療前未接受任何抗腫瘤及糖皮質激素等治療,并且無糖尿病、慢性阻塞性肺疾病和終末期腎病等結核感染的易感因素[22]。
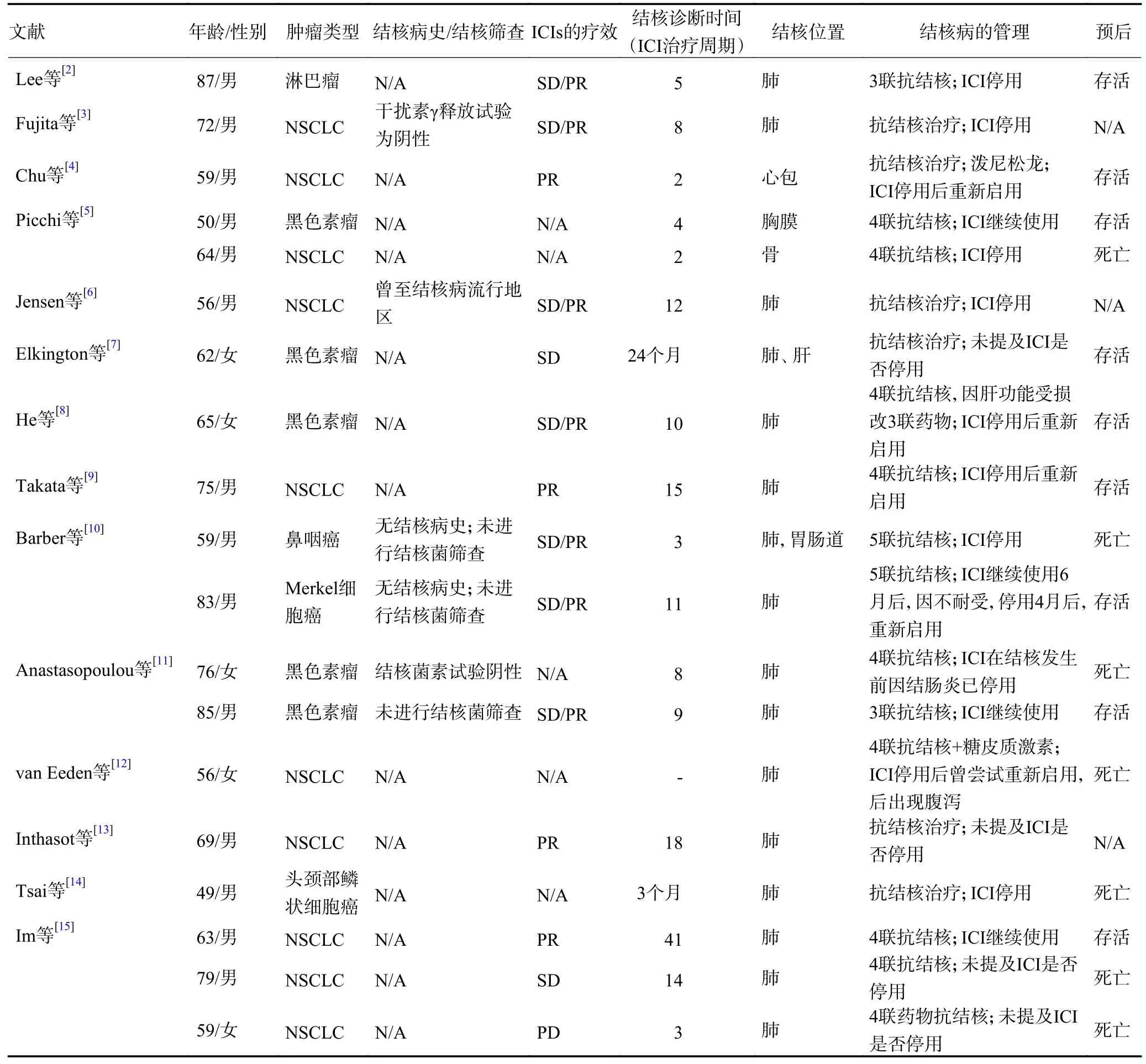
表1 ICIs 相關結核病的病例資料
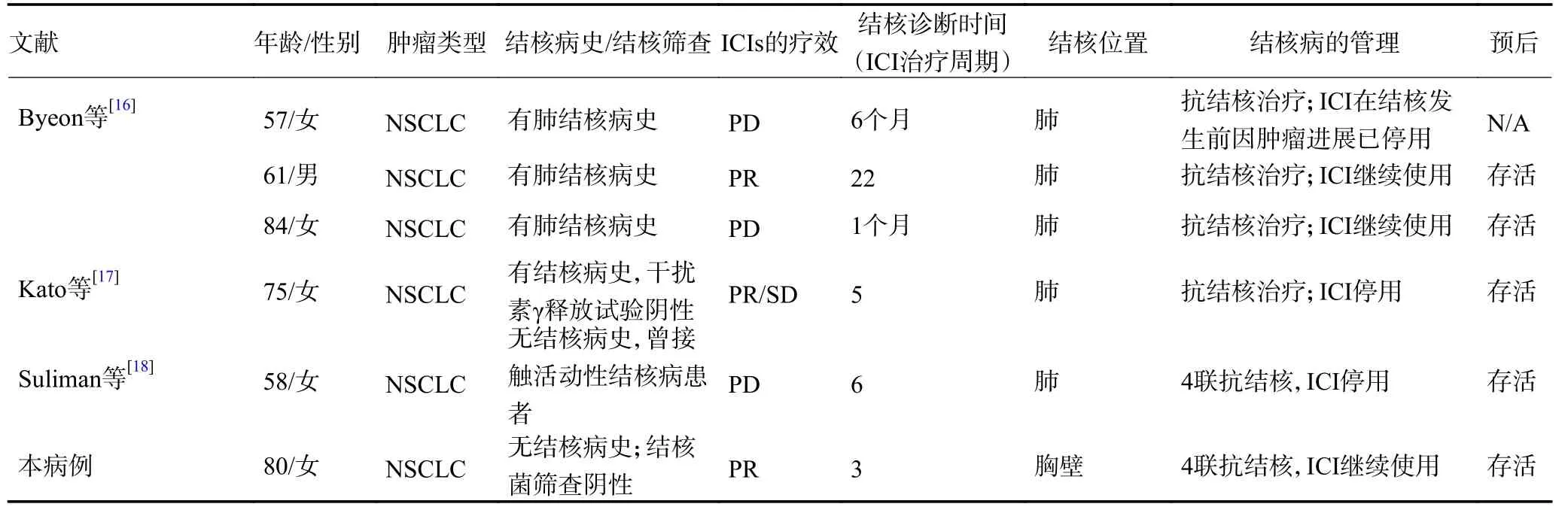
表1 ICIs 相關結核病的病例資料 (續表1)
ICIs 治療后發生活動性肺結核的機制尚不清楚,目前報道有兩種假設[23]。第一種是結核桿菌導致ICIs 治療的患者出現T 細胞的免疫再激活,類似于抗逆轉錄病毒治療艾滋病患者中觀察到的免疫重建炎癥綜合征。一項動物實驗顯示,相比野生型小鼠,PD-1基因敲除的小鼠感染結核菌后存活率顯著降低,肺部出現嚴重的壞死;對PD-1 基因敲除的小鼠組織和血標本進行分析發現,促炎細胞因子包括TNF-α、IL-1、IL-6 等顯著增加[24]。另一項研究發現ICIs 治療后,循環中產生γ-干擾素的Th1 細胞升高,而CD8+T 細胞、Th17 細胞、調節性T 細胞等無顯著變化[10]。ICIs 可能增強CD4+細胞介導的免疫,導致結核感染部位出現過度的炎癥反應。第二種假設是ICIs 誘導的淋巴細胞減少導致機會性感染。本研究結果更支持第一種假設。該患者未表現出任何免疫力抑制的跡象,如淋巴細胞減少,且其IL-6 增加了3 倍,并出現大量壞死,這都表明患者對結核菌出現了過度的免疫反應。此外,患者在免疫治療前進行的結核病相關檢測均為陰性。因此,本研究病例可能在使用ICIs 后出現了CD4+T細胞的免疫再激活,對結核菌產生應答,導致嚴重的炎癥反應。
在有評估ICIs 療效的20 例患者中,16 例達到PR 或疾病穩定(stable disease,SD),疾病控制率(disease control rate,DCR)達到80.0%(95%CI:60.8%~99.2%),高于ICIs 單藥治療的Ⅲ期臨床試驗[25-26]。該患者的PD-L1 表達陰性,且接受了信迪利單抗單藥治療,在2 個周期治療后達到PR。因此,推測有活動性或潛伏性結核感染的患者對免疫治療的反應可能比無結核感染的患者更好。但是既往研究表明結核感染能促進腫瘤的生長和轉移[27]。有報道指出結核病患者比健康受試者在CD4+T 細胞的程序性細胞死亡蛋白-1(programmed cell death 1,PD-1)和PD-L1 表達更高[28]。另一項研究也顯示免疫治療后出現結核病的患者,腫瘤細胞的PD-L1 表達升高[4]。結核病可能通過增加PD-L1 的表達提高對免疫治療的反應。
對于活動性結核病患者是否繼續或暫停或永久停止免疫治療尚無共識。7 例患者同時接受了抗結核和ICIs 治療,其中1 例在治療期間因無法耐受不良反應暫停免疫治療4 個月,其余患者都表現出良好的療效。還有3 例患者經過抗結核治療好轉后重新啟用免疫治療,結核病并未加重,而且腫瘤得到控制,其中1 例患者達到完全緩解(complete response,CR)。但是,有1 例患者重新開始免疫治療后出現2 級腹瀉,并在此后不久因腫瘤進展死亡。因此,在決定是否停用ICIs 時,應綜合考慮結核病感染的嚴重程度、腫瘤的控制情況、免疫治療的療效和患者的身體狀況。抗結核藥物治療是治療結核病的主要策略,一般不需要糖皮質激素和英夫利昔單抗治療。在25 例患者中只有2 例(8.0%)聯合糖皮質激素治療[2-18]。
綜上所述,ICIs 可使免疫細胞對潛伏性結核病產生過度反應,導致結核病的再激活。因此,在開始免疫治療之前,建議進行結核病篩查。活動性結核病可能與ICIs 療效增強有關。此外,在確診活動性結核感染的患者中,抗結核藥物可與ICIs 聯合使用,但應考慮患者的具體情況。

