小樣本訓練模型在宮頸癌放療中自動勾畫可行性研究
陳飛,胡靜,戴春華,游濤,耿長冉,湯曉斌
1. 南京航空航天大學 核科學與技術系,江蘇 南京 210000;2. 江蘇大學附屬醫院 放療科,江蘇 鎮江 212000
引言
宮頸癌是全球女性常見的惡性腫瘤,放射治療是宮頸癌的主要治療方式之一[1-2]。在目前精準放療時代,腫瘤靶區及危及器官(Organs at Risk,OARs)勾畫的準確性顯得尤為重要[3-4]。臨床上認為手動勾畫靶區及OARs是金標準,但這是一個費時費力的過程。有研究表明宮頸癌患者的OARs勾畫時間約2 h,而且不同臨床醫師勾畫結果可能因為經驗及理解不同而存在較大差異,這大大影響了患者放療的準確性[4-6]。近年來,基于深度學習自動勾畫的研究備受關注,并在前列腺癌、肺癌等部位取得很大進展,降低了放療醫師工作負荷以及勾畫差異性[7-9]。深度學習算法模型已逐漸應用于臨床,在實際使用過程中,常會發現通用的深度學習算法模型自動勾畫效果不符合醫院的具體勾畫習慣而影響臨床的應用[10]。
AccuLearning是由Manteia公司研發的一款深度學習自主訓練平臺,對各醫院提供自動勾畫算法模型定制,從而加大深度學習模型的實用性,推薦訓練最小病例數量30例。目前關于小樣本算法定制可行性的相關報道較少,本研究基于此,使用我院30例的宮頸癌患者數據在AccuLearning平臺中進行算法模型訓練,并對生成的算法模型進行測試分析,討論其對于宮頸癌臨床靶區(Clinical Target Volume,CTV)及OARs算法定制的可行性,以期得到AccuLearning軟件算法定制應用于臨床實踐的依據。
1 材料與方法
1.1 AccuLearning和AccuContour軟件
AccuLearning是基于深度學習進行醫學影像分割的訓練平臺,能夠完成小樣本勾畫算法模型訓練。在深度學習訓練的過程中,通過數據驅動來更新模型的參數,從而實現自動提取特征,能夠比傳統圖像處理算法達到更優的效果。AccuLearning提供了從數據輸入到模型部署的完整流程,方便用戶可以在訓練完成后直接在工作流程中使用,整體過程如下:數據集創建,模型訓練,模型評估以及模型應用。訓練好的自動勾畫算法模型能夠以加密過的二進制文件導入到AccuContour軟件平臺上,AccuContour能夠結合新算法模型來執行自動勾畫功能,并輸出相應的勾畫結構。
AccuLearning采取的網絡模型為自適應的網絡結構構建策略,根據訓練集中每個病例的體素間距和各個ROI的體積,自動選取合適的采樣窗口大小,生成類似于2D-UNet結構的自動分割網絡。該網絡默認包含5個最大池化層和5個上采樣層,基礎的卷積核通道數為32,尺寸為3×3,在每個卷積層后面都有批標準化層和線性整流函數,在編碼器和解碼器之間以級聯的方式進行躍層連接,將高分辨率的細節信息和深層次的圖像語義信息進行結合,提升勾畫模型的效果。
1.2 臨床資料
選取2020年1月至10月江蘇大學附屬醫院收治的45例宮頸癌患者為研究對象,年齡37~79歲(中位值55歲),根治性放療患者18例,術后輔助性放療患者27例。患者定位均采用仰臥位真空墊固定,使用飛利浦大孔徑CT(Brilliance CT big bore)進行掃描,掃描層厚3 mm,層間距3 mm。
1.3 實驗方法
將掃描獲取的45例CT圖像通過DICOM傳輸至Eclipse 13.6治療計劃系統,由一名有經驗的放療醫師手動勾畫CTV和OARs,其中OARs包括:骨髓、右側股骨頭、左側股骨頭、腸袋、直腸、膀胱,并定義為參考輪廓勾畫(Vreference,Vr)。各結構勾畫原則如下:CTV勾畫參照RTOG宮頸癌臨床靶區勾畫標準;骨髓勾畫包括髂骨、骶骨、恥骨、坐骨;兩側股骨頭包括股骨頭及股骨頸;腸袋勾畫包括從乙狀結腸往上至CTV上1.5 cm的腸管;直腸由肛管口勾畫至直腸乙狀結腸交界處;膀胱勾畫需包括膀胱外壁。所有勾畫輪廓均由兩位有著20年以上工作經驗的主任醫師審核并修改確認。
隨機抽取30例患者作為訓練集,將CT圖像及結構文件導出,應用AcceLearning軟件深度學習形成勾畫算法模型。訓練好的算法模型手動導入至AccuContour軟件平臺,并將余下15例患者CT作為測試集傳至AccuContour平臺,應用訓練好的算法模型對其相應結構進行自動勾畫,定義為自動輪廓勾畫(Vautomatic,Va),勾畫完成后將結構文件傳回Eclipse計劃系統,獲取相關參數分析。
1.4 評價參數
以醫師手動勾畫的靶區及OARs輪廓作為金標準,通過以下指標評估自動勾畫與手動勾畫的吻合度,其中Va和Vr分別表示自動勾畫和手工勾畫的結構體積,Va∩Vr是自動勾畫與手動勾畫結構重疊的體積。
1.4.1 相似性系數和敏感性指數
相似性系數(Dice Similarity Coefficient,DSC)和敏感性指數(Sensitive Index,SI)是形態學吻合度評價指標,可利用其評價自動勾畫結構與手動勾畫的重合一致性,DSC和SI值介于0~1之間,當DSC和SI趨近于1時,代表兩者具有較好的重合性。DSC和SI的計算公式如式(1)~ (2)。
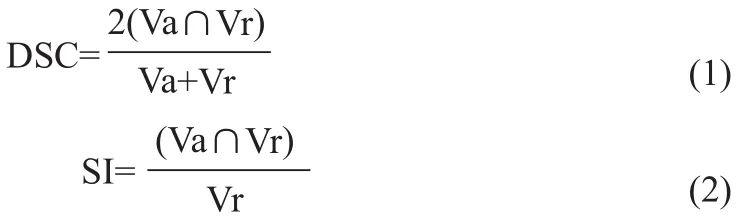
1.4.2 位置偏差
質心偏差(Deviation of Centroid,DC)可通過記錄手動勾畫與自動勾畫的各結構幾何中心在三維坐標軸上的差異(△x,△y,△z)計算得到,其能較直觀地反映手動勾畫與自動勾畫結構的位置關系。DC的計算公式如式(3)所示。
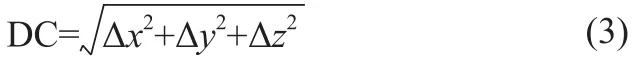
1.4.3 體積差異系數
體積差異系數(Deviation of Volume,DV)表示手動勾畫與自動勾畫的體積差異占手動勾畫的比例,用于評價自動勾畫的容積穩定性,結果以其絕對值的百分比表示。DV的計算公式如式(4)所示。

2 結果
采用箱式圖顯示了15例測試集各個勾畫輪廓三維方向的偏差(圖1)。CTV位置偏差有一例z方向異常較大的患者,高達1.03 cm(DSC=0.83),其余患者在x、y、z三個方向的誤差都分別小于1.3、3.6、3.8 mm;對于骨髓、右側股骨頭以及左側股骨頭,自動勾畫和手動勾畫的位置偏差均小于3 mm,偏移距離小于3 mm的掃描層厚;圖1中腸袋位置偏差在x、y方向偏差小于3 mm,z方向偏差較大,最大偏差達到8.7 mm;直腸位置偏差在x、y方向偏差小于2 mm,z方向偏差小于3.3 mm;膀胱位置偏差發現大多數患者位置偏差都小于5 mm,有一例患者在y、z方向偏差異常較大,△y=-0.9 cm、△z=-0.53 cm,而且此例患者膀胱DSC值僅為0.58。
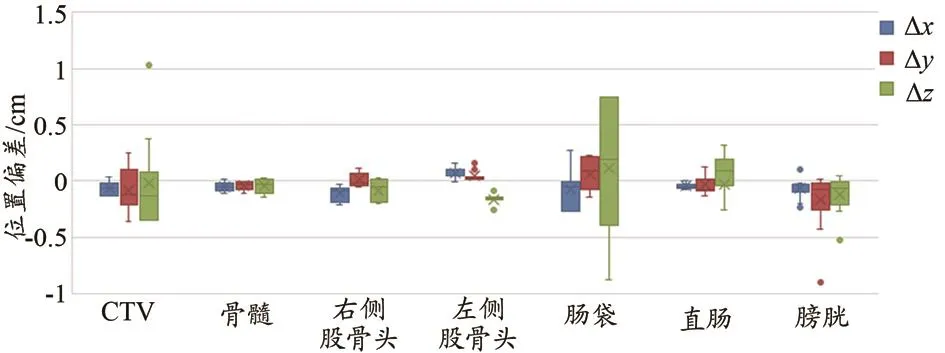
圖1 自動和手動兩種勾畫方式在x、y、z方向的位置偏差
研究中發現,測試集中有一例CTV以及一例膀胱自動勾畫位置偏差數據較為異常,通過患者CT圖像(圖2)推斷:CTV數據異常者為45例患者中唯一1例宮頸癌陰道及外陰侵犯患者,其CTV結構異于訓練集中CTV;膀胱勾畫異常者是因為此患者行過左側輸尿管吻合術加左側輸尿管支架置入術,CT可見膀胱內高密度顯影,干擾了膀胱的自動勾畫,所以在其他評價指標分析中,均排除了該異常數據。
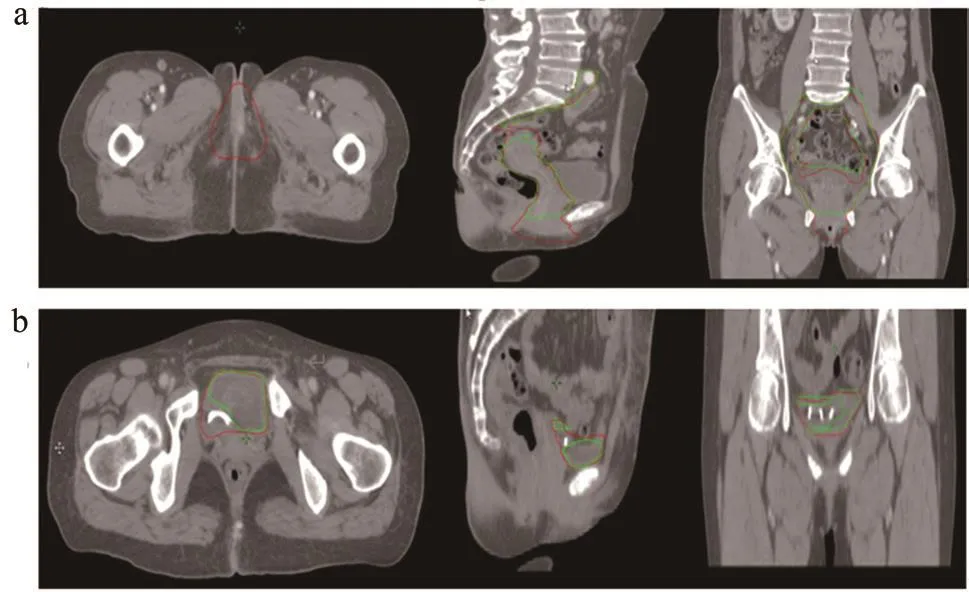
圖2 CTV及膀胱數據異常患者CT圖
表1展示了各結構自動勾畫輪廓的評價參數。結果顯示:CTV的DSC達到了0.86,OARs中骨髓、雙側股骨頭的DSC均≥0.93,腸袋和直腸約0.90左右;CTV的SI值為0.87,其余結構的SI值均≥0.90;CTV和腸袋DC均值在3~6 mm,其余的均小于3 mm;關于DV均值,最小的是骨髓3.86%,最大的是腸袋12.32%。
表1 各結構自動勾畫輪廓的評價參數[(±s),(最小值~最大值)]
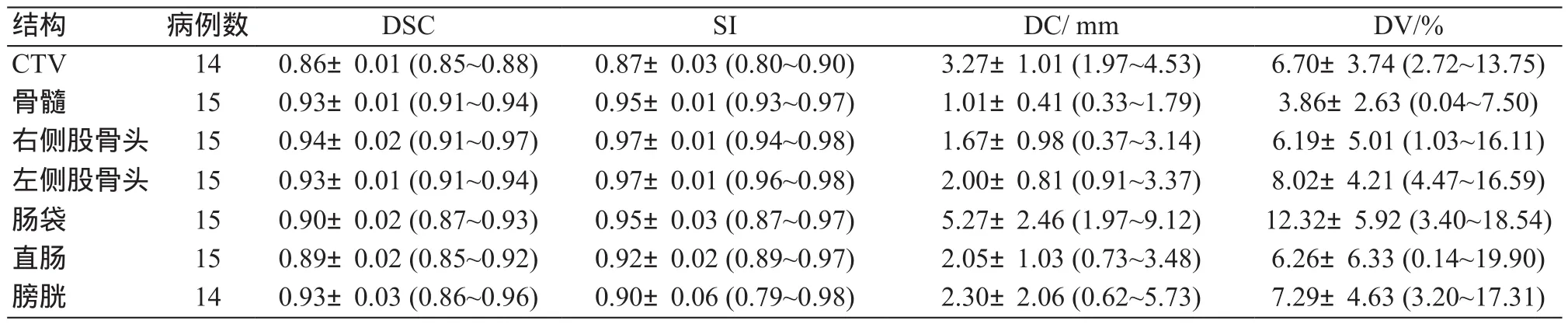
表1 各結構自動勾畫輪廓的評價參數[(±s),(最小值~最大值)]
結構 病例數 DSC SI DC/ mm DV/%CTV 14 0.86±0.01 (0.85~0.88) 0.87±0.03 (0.80~0.90) 3.27±1.01 (1.97~4.53) 6.70±3.74 (2.72~13.75)骨髓 15 0.93±0.01 (0.91~0.94) 0.95±0.01 (0.93~0.97) 1.01±0.41 (0.33~1.79) 3.86±2.63 (0.04~7.50)右側股骨頭 15 0.94±0.02 (0.91~0.97) 0.97±0.01 (0.94~0.98) 1.67±0.98 (0.37~3.14) 6.19±5.01 (1.03~16.11)左側股骨頭 15 0.93±0.01 (0.91~0.94) 0.97±0.01 (0.96~0.98) 2.00±0.81 (0.91~3.37) 8.02±4.21 (4.47~16.59)腸袋 15 0.90±0.02 (0.87~0.93) 0.95±0.03 (0.87~0.97) 5.27±2.46 (1.97~9.12) 12.32±5.92 (3.40~18.54)直腸 15 0.89±0.02 (0.85~0.92) 0.92±0.02 (0.89~0.97) 2.05±1.03 (0.73~3.48) 6.26±6.33 (0.14~19.90)膀胱 14 0.93±0.03 (0.86~0.96) 0.90±0.06 (0.79~0.98) 2.30±2.06 (0.62~5.73) 7.29±4.63 (3.20~17.31)
圖3展示了本實驗中CTV和OARs勾畫斷層效果圖,由圖3可看出自動勾畫的結構輪廓與臨床醫師勾畫的相似重合度高。表2總結了近幾年具有代表性的盆腔腫瘤深度學習自動勾畫的數據,并將其DSC值與本研究進行了比較與分析[4,11-14],發現本實驗DSC均值與其他文獻十分接近甚至優于個別文獻中的結果。
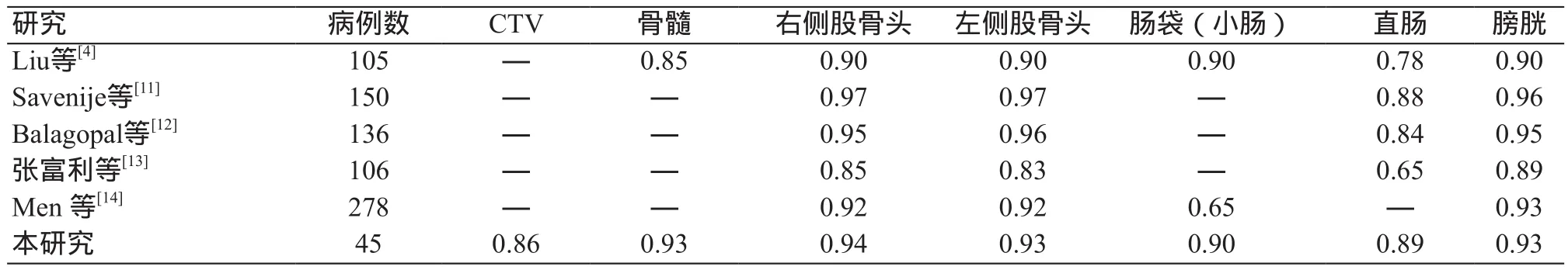
表2 該研究DSC結果與其他文獻結果對比(均值)
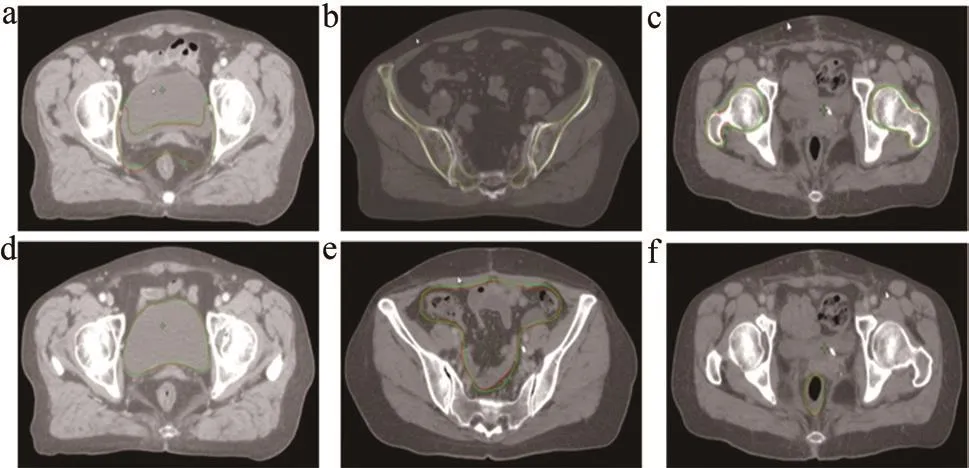
圖3 各勾畫結構CT斷層示例
3 討論
已有研究表明,基于深度學習的自動勾畫優于基于圖譜庫的自動勾畫[15-16]。隨著人工智能深度學習技術的發展,基于不同方式的深度學習自動勾畫成為了放療領域的研究熱點[17-20]。盡管基于深度學習的自動勾畫模型在放療領域取得了很大的成果,但由于高質量醫療數據的稀缺性、私密性,以及不同數據源之間的標準不同的原因,導致通用模型無法持續應對放療領域日益發展的自動勾畫需求。Manteia公司提出深度學習和傳統算法結合的方法,應用AccuLearning軟件進行小樣本數據深度學習模型訓練,生成的模型可導入AccuContour軟件進行自動勾畫,其中為了進一步提高模型的輸出精度,AccuContour軟件在模型應用部署時會結合傳統算法對部分勾畫輪廓使用后處理技術,以及在部分傳統算法能達到高精度的器官上,直接采用傳統算法進行勾畫,以達到最佳的勾畫精度。
研究結果顯示,宮頸癌臨床靶區及OARs的自動勾畫與手動勾畫有著較高的相似度。DSC是評價自動勾畫精度的重要指標,而且Zou等[21]認為DCS大于0.7表示自動勾畫與手動勾畫相似性較高。本研究各勾畫輪廓DSC均值都大于0.85,表現出較高的相似性。其中骨髓,兩側股骨頭以及膀胱的DCS值高達0.93左右,這可能是因為這些OARs邊界清晰且其與周圍組織對比度高,此外SI值為0.87~0.97,也表明較高的重合性。DC是通過質心的偏差來衡量自動勾畫輪廓偏移程度一項參數,骨髓,兩側股骨頭,直腸以及膀胱的DC平均值均小于3 mm,不足CT掃描一層的厚度,體現了很好的輪廓重合性,與DSC以及SI結果相同。CTV以及腸袋的DV均值稍微大點,CTV質心偏移主要集中在y和z方向。回顧性分析CT圖像可知y方向的偏移可能是因為患者膀胱充盈程度不同以及腸道位置的變化,導致了CTV前界的變化;z方向的偏移主要是因為每例患者結構性的差異,研究自動勾畫輪廓發現靶區上界定位較差,這可能跟不同的患者主動脈分叉位置不同有關;而且此次實驗定義腸袋上界為CTV上1.5 cm,因為CTV上界的個體差異,從而導致腸袋上界的不確定,這也可能增加了腸袋z方向的質心偏移。所有勾畫結構中DV最大均值為12%左右,說明自動勾畫體積與手動勾畫差別小。這幾項評價參數都說明了小樣本自主訓練算法模型的自動勾畫具有很高的穩定性,經臨床醫師審核修改后可應用于臨床。
為了更直觀地表現本研究自動勾畫的效果,表2將本實驗結果與其他文獻結果做了對比,由于各個文獻所選的OARs不是完全相同,因此只概括了與本研究具有相同輪廓的數據。可能因數據量、CT圖像質量、輪廓勾畫原則等因素的影響,這樣比較不能說明該實驗結果優劣于其他實驗,但是可以發現小樣本數據訓練算法模型的自動勾畫效果是理想的,宮頸癌患者小樣本數據訓練模型能被應用于臨床,從而提高放療質量以及效率。
此外在該實驗中,測試集中出現了特異性較大的勾畫結構,這可能是因為小樣本訓練模型數據量較小,從而導致模型過擬合,泛化能力減弱,因此在數據收集過程中,應盡量增加訓練數據的多樣性,來提升深度學習模型的精度以及泛化性能。而且放療醫師在自動勾畫完成后,仍需認真檢查每個自動勾畫輪廓,排除特例的存在,因人而異的去做必要的修改。
4 結論
綜上所述,AccuLearning平臺的小樣本自主訓練模型對于絕大部分宮頸癌臨床靶區以及OARs勾畫取得了滿意的效果,能較好地解決醫院勾畫習慣不同的問題,證明了宮頸癌小樣本訓練模型定制的可行性,對于臨床應用有著較大的價值。但是對于CTV,自動勾畫輪廓仍有部分層面效果較差,因此在今后研究中,可考慮適當增加樣本數量以及多樣性,通過對比模型中自動勾畫與手動勾畫的差異性,對深度學習網絡模型中引入一些標簽,比如是否手術,臨床分期等,進一步提高AccuLearning平臺的小樣本訓練模型精度。

