肝癌人源腫瘤異種移植模型的應用研究進展
蔣林含,譚曉霞,李俊,蘇松,李亞玲
1西南醫科大學附屬醫院藥學部,四川瀘州 646000;2西南醫科大學藥學院,四川瀘州 646000;3西南醫科大學附屬醫院中醫科,四川瀘州 646000;4西南醫科大學附屬醫院肝膽外科,四川瀘州 646000
肝癌發病率日益增長,在全球其死亡率居惡性腫瘤第3位[1-2]。在我國,肝癌是最常見的惡性腫瘤之一,其發病率在腫瘤譜中居第4位,死亡率居第3位[3]。2016年,美國啟動“Cancer Moonshot”計劃,旨在促進對肝癌等腫瘤的預防、早期診斷、治療及治愈的理解,并基于大量腫瘤分析與數據共享發展,促進精準醫學的應用[4]。過去50年,大量的肝癌模型采用細胞系或基于細胞系的異種移植,這些模型極大促進了對肝癌發生機制的理解及藥物治療的發展,但細胞系模型腫瘤與臨床患者腫瘤組織的腫瘤異質性及微環境有所不同,因此,亟待開發新的腫瘤研究技術與工具來解決該困境。人源腫瘤異種移植(patient-derived xenograft,PDX)模型是將手術中獲得的患者腫瘤組織移植到免疫缺陷小鼠上,依靠小鼠提供環境生長的異種移植模型。PDX模型保留了原發腫瘤結構及細胞與基質的相對比例,增加了動物模型與患者的一致性,并保留了不同患者的腫瘤特性,有效反映了患者腫瘤間與腫瘤內的異質性[5]。因此,PDX模型可高度再現人肝癌的生物學特性,為治療提供策略,并可對藥物進行臨床前篩選與評估,是解決上述困境及實現精準醫學的重要途徑[6]。本文總結了構建肝癌PDX模型的常用小鼠品系、標本制備及移植方式,介紹了4種新型肝癌PDX模型:誘導多能干細胞來源的PDX模型、組合模型、肝臟疾病介導的PDX模型及人源化小鼠PDX模型,回顧了肝癌PDX模型在基礎研究與臨床前研究方面的最新進展,并對PDX模型的前景進行了展望,以期為肝癌PDX模型的進一步優化及應用提供參考。
1 肝癌PDX模型的構建
1.1 常用小鼠品系 為避免小鼠對人體腫瘤的排斥反應,肝癌PDX模型的構建一般選用免疫缺陷小鼠,包括多種品系。目前主要有C57BL/6-nu(裸鼠)、CB17-scid[嚴重聯合免疫缺陷(SCID)]小鼠、NOD-scid[非肥胖糖尿病/重癥聯合免疫缺陷(NODSCID)]小鼠、NOD/LtSz-scid Il2rg–/–(NSG)及NOD/Shi-scid Il2rg–/–(NOG)小鼠等,詳見表1。

表1 肝癌PDX模型常用小鼠品系Tab.1 Mouse strains commonly used for PDX models of liver cancer
1.2 肝癌標本制備 肝癌組織標本可從手術或穿刺活檢中獲取[7]。剔除肝癌組織內的纖維組織及壞死部分,用剪刀剪碎腫瘤組織至1~3 mm3,以套管針接種移植或以18號針頭吸取0.2 ml腫瘤組織碎片接種移植[8]。腫瘤移植成功與否主要取決于肝癌的侵襲性及全程操作的無菌性。可將腫塊浸潤基質膠或將組織碎片與基質膠以1:1混合后再種植,可提高腫瘤的種植及生長效率[9]。
1.3 肝癌移植方式 通過原位或異位移植將肝癌組織種植到免疫缺陷小鼠體內以建立PDX模型(表2)。

表2 不同肝癌移植方式的特征Tab.2 Methodology to establish PDX models of liver cancer
2 新型肝癌PDX模型
傳統肝癌PDX模型無法研究腫瘤微環境與免疫系統的相互作用,耗時長且成本高,阻礙了肝癌的基礎研究及個性化治療,開發更準確、完善的PDX模型有利于更好地了解肝癌的生物學特性并推進治療的發展,主要的新型肝癌PDX模型見表3。
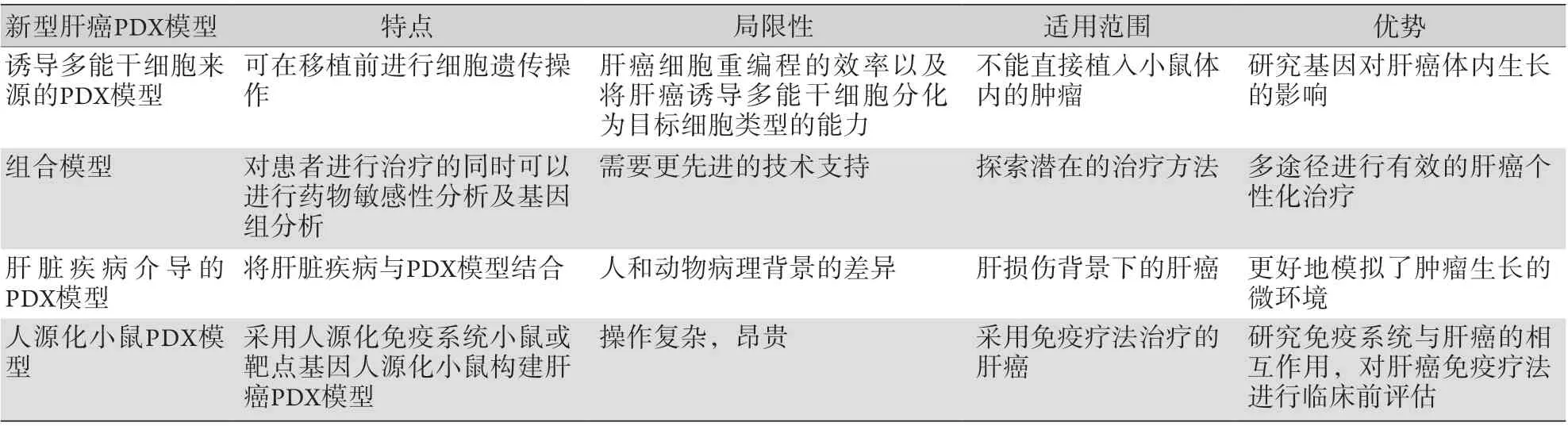
表3 新型肝癌PDX模型的特征Tab.3 Characteristics of the novel PDX models of liver cancer
2.1 誘導多能干細胞來源的PDX模型 將原發腫瘤細胞重新編程為誘導多能干細胞,移植到小鼠體內,建立誘導多能干細胞來源的PDX模型。誘導多能干細胞可以在移植前進行腫瘤細胞基因操作,如表達熒光素酶或熒光蛋白用以追蹤或引入特定的遺傳修飾,從而研究其對腫瘤體內生長的影響[14]。腫瘤的誘導多能干細胞也具有腫瘤早期階段的特點,為研究肝癌早期生長特點及生物標志物提供了線索[15]。
2.2 組合模型 原代細胞系、類器官(patientderived organoids,PDO)模型與PDX模型的組合可從多個途徑探索肝癌的個性化治療。在對新鮮腫瘤組織進行基因測序的同時,建立患者的PDO與PDX模型,并對腫瘤進行多點采樣,可更好地進行個性化治療,還原腫瘤的分子表型、異質性并進行耐藥性評估[16]。肝癌原代細胞系、PDO與PDX組合模型有望在時間、經濟成本及藥物篩選能力等方面取得平衡。
2.3 肝臟疾病介導的PDX模型 多數肝癌是在肝損傷背景下發展而來的。肝細胞癌(hepatocellular carcinoma,HCC)是最常見的肝癌類型,約占肝癌患者總數的90%,其中超過90%的HCC發生在慢性肝病的背景下。乙型肝炎病毒(hepatitis B virus,HBV)感染是HCC發生的最主要危險因素,約占50%,其他疾病包括丙型肝炎病毒(hepatitis C virus,HCV)、丁型肝炎病毒(hepatitis D virus,HDV)、酒精性肝病(alcoholic liver disease,ALD)及非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)[1]。為了更好地模擬人類腫瘤模型,可以將誘導的病毒性肝炎(HBV、HCV)、肝硬化、脂肪性肝病、ALD、NASH、膽汁淤積等模型與肝癌PDX模型結合。目前已有研究者將HCV相關性肝癌患者的肝癌組織植入NSG小鼠,建立HCV相關的HCCPDX模型,雖然移植瘤傳代后無法檢測HCV的RNA,但能顯示出與原發腫瘤非常相似的表型與分子構成,分析其腫瘤特異性基因表達的改變有助于進一步改善治療策略[17]。慢性肝臟疾病介導的PDX模型更好地模擬了腫瘤生長的微環境,是未來PDX模型發展的潛在方向。
2.4 人源化小鼠PDX模型 動物模型在臨床前抗腫瘤藥物評價中發揮著重要作用,但經典的PDX模型采用免疫缺陷小鼠,無法模擬完整的免疫反應,在免疫療法的轉化研究中存在著嚴重的局限性;且由于種屬差異,人與小鼠之間的抗腫瘤藥物作用靶點分子可能不同,小鼠細胞上不存在相應靶點或不能被藥物識別,故需應用人源化小鼠PDX模型以促進腫瘤研究及免疫療法的臨床前評估。人源化小鼠包括人源化免疫系統小鼠及靶點基因人源化小鼠。前者通過將人類造血干細胞(hematopoietic stem cell,HSC)及從胎兒臍帶血或其他組織分離出的前體細胞轉移到受亞致死劑量照射的新生小鼠的骨髓中,使其發育為功能性免疫系統;后者采用基因工程手段對小鼠的免疫檢查點基因進行人源化改造,從而表達人類的靶點分子基因[5]。已有研究者使用人源化小鼠建立了HCC的PDX模型,以研究該環境下腫瘤變化、免疫反應及免疫治療的作用,為肝癌免疫療法的臨床前研究提供了平臺[18]。人源化小鼠在動物模型、免疫腫瘤學及個性化治療等方面均是一個重要的突破,將在未來的腫瘤研究中被廣泛應用[19]。
3 肝癌PDX模型的應用研究
3.1 基礎研究
3.1.1 腫瘤生物學研究 PDX模型是研究肝癌的重要動物模型,但其是否能用于人類肝癌研究一直是關注的重點。肝癌PDX模型在連續傳代后,組織學分析顯示移植腫瘤仍保留原發腫瘤組分,且在連續移植模型中也能檢測到腫瘤罕見間充質成分,說明肝癌PDX模型保留了原發腫瘤的正常結構及功能,可用于原發腫瘤的組織學、遺傳學、生物學特征及轉移行為方面的研究[20]。有研究對乳腺癌、結直腸癌、胃癌、胰腺癌、慢性淋巴細胞白血病等移植腫瘤進行各項生物學檢測,也同樣證實移植腫瘤保持了原代的生物學特性[21-22]。PDX模型為腫瘤研究提供了穩定而準確的動物模型。
3.1.2 腫瘤發生研究 PDX模型可用于研究參與腫瘤發生發展的細胞成分。腫瘤干細胞(cancer stem cell,CSC)假說表明,腫瘤細胞具有內在可變性,早期的腫瘤克隆產生了具有遺傳異質性的亞克隆后代,由于應對環境選擇的能力不同,其中一部分快速生長而其他部分萎縮,腫瘤克隆僅由部分具有干細胞特性的細胞維持[23]。同樣,當腫瘤移植到小鼠體內,腫瘤中一部分特定的亞群比其他亞群更易形成腫瘤[24]。這種腫瘤內及腫瘤間的可變性會影響治療效果,而肝癌PDX模型保留了肝癌患者腫瘤最原始的基因克隆結構,在轉錄組學、表觀基因組學、組織學水平及共享信號通路方面與患者相似[25],可作為研究腫瘤異質性及其發生發展的臨床前模型。
3.1.3 腫瘤轉移研究 晚期腫瘤患者大多會出現多發轉移,且可能具有不同程度的抗藥性。有研究者用黑色素瘤[26]及肺癌[27]建立了轉移性腫瘤的PDX模型進行耐藥性研究并進一步證明了其臨床預測作用。PDX模型也可用于轉移相關的細胞亞群及分子,如乳腺癌PDX模型可分離出足量的轉移起始細胞(metastasis-initiating cells,MICs)及循環腫瘤細胞(circulating tumor cell,CTC),用于研究其對腫瘤轉移的影響[28]。肝癌術后復發轉移率高,遠期療效并不理想,肝癌轉移PDX模型對研究其機制及改善預后具有重要意義。
3.2 臨床前研究 PDX模型在臨床前研究中的作用主要是確定治療靶點并指導臨床治療。此外,EurOPDX、美國國家癌癥研究所(National Cancer Institute,NCI)患者模型存儲庫、異種移植公共存儲庫(the public repository of Xenografts,PRoXe)等大規模PDX模型平臺的創立,將進一步促進PDX在藥物研發及生物標志物篩選中的應用[5];美國杰克遜實驗室(the Jackson Laboratory)已在其網站上公布了450多種PDX的遺傳信息及組織病理學信息,并將PDX小鼠用于商業化使用。我國亦有計劃建立自己的PDX模型中心并已建立了肝癌PDX模型數據庫[29-30]。
3.2.1 腫瘤標志物研究 肝癌PDX模型有助于識別特定的腫瘤標志物,用于診斷、評估預后及靶向治療。PDX保留了HCC中優先表達的分子標志物,可用于監測治療反應;亦保留了與原發腫瘤基因表達及單核苷酸多態性(single nucleotide polymorphism,SNP)圖譜的一致性,可用于預測藥物的療效;通過轉錄組與基因組分析,可驗證腫瘤臨床前研究中的分子標志物,并能用于研究肝癌患者的耐藥機制、藥物篩選及個性化用藥[25]。利用PDX模型也可評估肝癌干細胞標志物在HCC預后中的價值[31]。
3.2.2 藥物評估研究 藥物治療是延長肝癌患者生存期及治愈肝癌的重要方式,但新藥在成功完成臨床試驗后用于臨床的比例只有5%,且在完成前期試驗后無法進入后期開發的情況也十分普遍,即許多在臨床前研究中作用顯著的藥物未能證實對患者具有足夠的功效。PDX模型可保持患者的腫瘤異質性并預測治療效果,用于評估治療藥物的效果,從而正確指導臨床治療[32]。
在肝癌PDX模型中,靶向重組人成纖維細胞生長因子受體-1(FGFR1)多激酶抑制劑樂伐替尼(lenvatinib)在高表達FGFR1的小鼠中顯示出比索拉非尼(sorafenib)更好的治療效果[33],而樂伐替尼被批準為晚期肝癌患者的一線治療方案,證實了PDX模型的臨床價值[34]。將PDX模型用于體外高通量篩選抗腫瘤藥物,證實了氧化磷酸化抑制劑可用于治療具有高水平人類婆羅雙樹樣基因4(SALL4)的肝腫瘤[35]。免疫療法方面,glypican 3(GPC3)-CAR T細胞抑制了PDX模型中HCC的生長,在細胞系基礎上進一步證實了CAR T細胞療法的有效性[36]。通過建立肝癌PDX模型觀察貝伐珠單抗(bevacizumab)、雷帕霉素(rapamycin)的療效,發現貝伐珠單抗與雷帕霉素聯合用藥比單一用藥的效果更佳[37]。我國學者利用肝癌患者術后腫瘤組織建立肝癌PDX模型,同時對行肝右葉部分切除術、膽囊切除術后接受索拉非尼單藥治療的患者進行臨床觀察,發現患者于術后6個月出現肝癌復發,且伴腹腔淋巴結轉移,這與建立的肝癌PDX模型藥效學評價結果相似,很好地反映了藥物在個體化患者中的作用,有望為肝癌患者個體化治療帶來新的突破[38]。
4 總結與展望
肝癌PDX模型保留了患者原發腫瘤的基本特征,以體內實驗驗證并支持體外實驗的發現,架起了肝癌基礎研究與臨床研究之間的橋梁,在臨床前評估、指導治療及預后預測等方面均具有重要意義。但是,肝癌PDX模型也具有一定局限性,包括腫瘤患者來源的間質被小鼠間質細胞替代、成瘤時間長、成本投入大、缺乏免疫系統等。肝臟疾病介導的PDX模型進一步縮小了腫瘤微環境的差異,人源化PDX模型更準確地描述了人肝癌的生理學特性,但這些新型肝癌PDX模型不僅需要克服現有技術局限,而且成本高昂,制作耗時,并不利于肝癌個性化治療的發展。為減少建立模型所需的時間及經濟成本,有必要進一步改進并優化當前的建模技術,以更好地模擬體內腫瘤微環境與腫瘤的相互作用,建立更優化的藥物篩選途徑,實現個體化治療與精準醫學的目標。

