肝癌患者手術前后清蛋白水平對術后腹腔感染的影響*
姜 霞,谷申森,蘆雪萍,宋婷婷,吐爾洪江·吐遜,周成明
新疆醫科大學第一附屬醫院肝臟腹腔鏡外科,新疆烏魯木齊 830054
肝癌切除術是目前臨床治療肝癌的主要手段,由于肝癌所致的并發癥較多,患者一般情況較差,故術后發生感染的風險較高[1-2]。腹腔感染(IAI)是肝癌切除術后常見的并發癥之一,既往研究結果顯示,IAI是導致肝癌患者術后死亡的重要因素,因此,臨床針對肝癌患者術后IAI的有效預測方法進行研究,并采取相應措施以有效預防術后IAI的發生,對進一步改善患者預后具有重要意義[3]。清蛋白(ALB)是反映患者營養狀態的重要指標,對于肝癌患者術前及術后營養治療具有較好的指導意義[4],《中國腹腔感染診治指南(2019版)》指出,低蛋白血癥是IAI患者死亡的相關危險因素[5]。同時OKAMURA等[6]研究發現,由于肝臟是蛋白代謝的重要器官,故肝臟切除術后患者ALB水平可能會發生改變,這可能對患者術后IAI的發生產生一定的影響。本研究通過分析肝癌患者手術前后ALB水平與IAI之間的關系,為肝癌患者手術前后營養治療方案的完善提供參考依據,現報道如下。
1 資料與方法
1.1一般資料 選擇2018年6月至2019年12月于本院行肝癌切除術的原發性肝癌患者139例作為研究對象,男82例,女57例,平均年齡(52.47±8.59)歲;平均體質量指數(BMI)為(22.14±1.47)kg/m2。根據患者術后IAI發生情況將所有患者分為IAI組(37例)和非IAI組(102例)。納入標準:(1)符合《原發性肝癌診療規范(2017年)》中原發性肝癌的診斷標準及手術切除指征[7];(2)年齡18~65歲;(3)美國麻醉醫師協會(ASA)分級Ⅰ~Ⅱ級;(4)肝功能Child-Pugh分級為A、B級。排除標準:(1)嚴重的器官功能障礙;(2)長期的免疫抑制劑使用史;(3)接受除本研究制訂的治療方案外的其他治療方式;(4)近期發生局部或全身感染性疾病。本研究經醫院倫理委員會批準,所有患者均簽署知情同意書。
1.2方法
1.2.1圍術期處理 (1)術前明確患者病情,完善相關檢查,保持高蛋白飲食以維持患者營養狀態;(2)術后及時予以胃腸減壓并觀察患者生命體征,嚴格監控出入量,必要時可采取相應的治療措施;(3)常規預防性使用抗菌藥物,注意藥物選擇,盡量避免肝腎損傷較大的抗菌藥物。
1.2.2手術方式 所有患者均由同一手術組實施手術,根據患者病情制訂開腹解剖性切除方案,明確切除范圍;術中盡可能避免多余損傷。
1.3觀察指標及診斷標準
1.3.1IAI診斷標準 根據世界急診外科學會(WSES)2017年制定的IAI相關標準,需結合患者主訴及現病史、體格檢查、實驗室檢查、影像學檢查及腹腔穿刺等綜合判斷,包括:(1)存在IAI相關的臨床表現(如發熱、轉移性右下腹痛、麥氏點壓痛、墨菲征陽性、停止排氣排便、腹部壓痛、反跳痛及肌緊張等);(2)實驗室檢查中白細胞計數>10×109/L、中性粒細胞百分比>70%、C反應蛋白>10 mg/L及降鈣素原>0.5 μg/L等;(3)影像學檢查存在IAI征象;(4)腹腔穿刺明確存在IAI[8]。
1.3.2臨床資料收集 包括年齡、BMI、性別構成、ASA分級、Child-Pugh分級、病理分型、切除范圍、手術相關資料(手術時長、術中出血量、術中膽管處理情況等)。
1.3.3實驗室檢查資料收集 術前及術后1 d ALB、血紅蛋白(Hb)、丙氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)水平。

2 結 果
2.1患者術后IAI發生情況及影響IAI發生的單因素分析 根據IAI診斷標準,139例患者中有37例發生術后IAI,IAI發生率為26.62%。IAI組術中膽管處理率、手術時長均高于非IAI組(P<0.05),而術前及術后ALB水平低于非IAI組(P<0.05),兩組患者術后ALB水平均較術前下降(P<0.05),見表1。
表1 影響IAI發生的單因素分析
續表1 影響IAI發生的單因素分析
2.2影響患者IAI發生的多因素Logistic回歸分析 以術后IAI發生情況為因變量(1=是,0=否),以單因素分析差異有統計學意義的因素作為自變量(具體賦值見表2)進行二元Logistic回歸分析,結果顯示,術中膽管處理(OR=6.857,95%CI:2.362~19.902)及手術時長增加(OR=1.994,95%CI:1.369~2.903)為IAI發生的獨立危險因素,而術前高水平ALB(OR=0.812,95%CI:0.719~0.916)是IAI發生的保護因素(P<0.05),見表2。
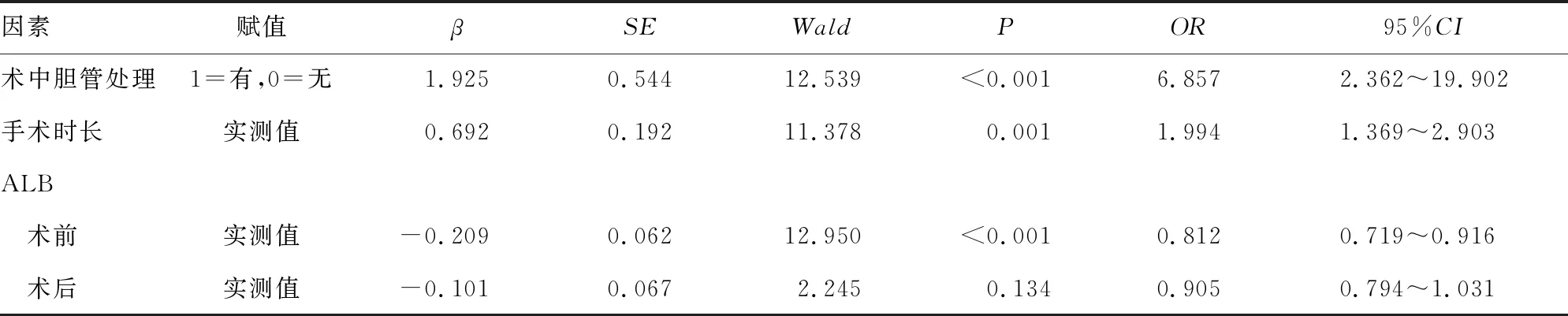
表2 影響IAI發生的多因素Logistic回歸分析
2.3術前、術后ALB預測術后IAI的效能 通過分組建立術前及術后ALB對IAI預測的ROC曲線,結果顯示,術前ALB對術后IAI的預測效能優于術后ALB(P<0.05),術前ALB預測術后IAI的曲線下面積(AUC)為0.819(95%CI:0.755~0.887),最佳臨界值為33.39 g/L,靈敏度為72.97%,特異度為81.37%,術后ALB預測術后IAI的AUC為0.632(95%CI:0.546~0.712),最佳臨界值為32.41 g/L,靈敏度為54.05%,特異度為67.65%,見圖1。
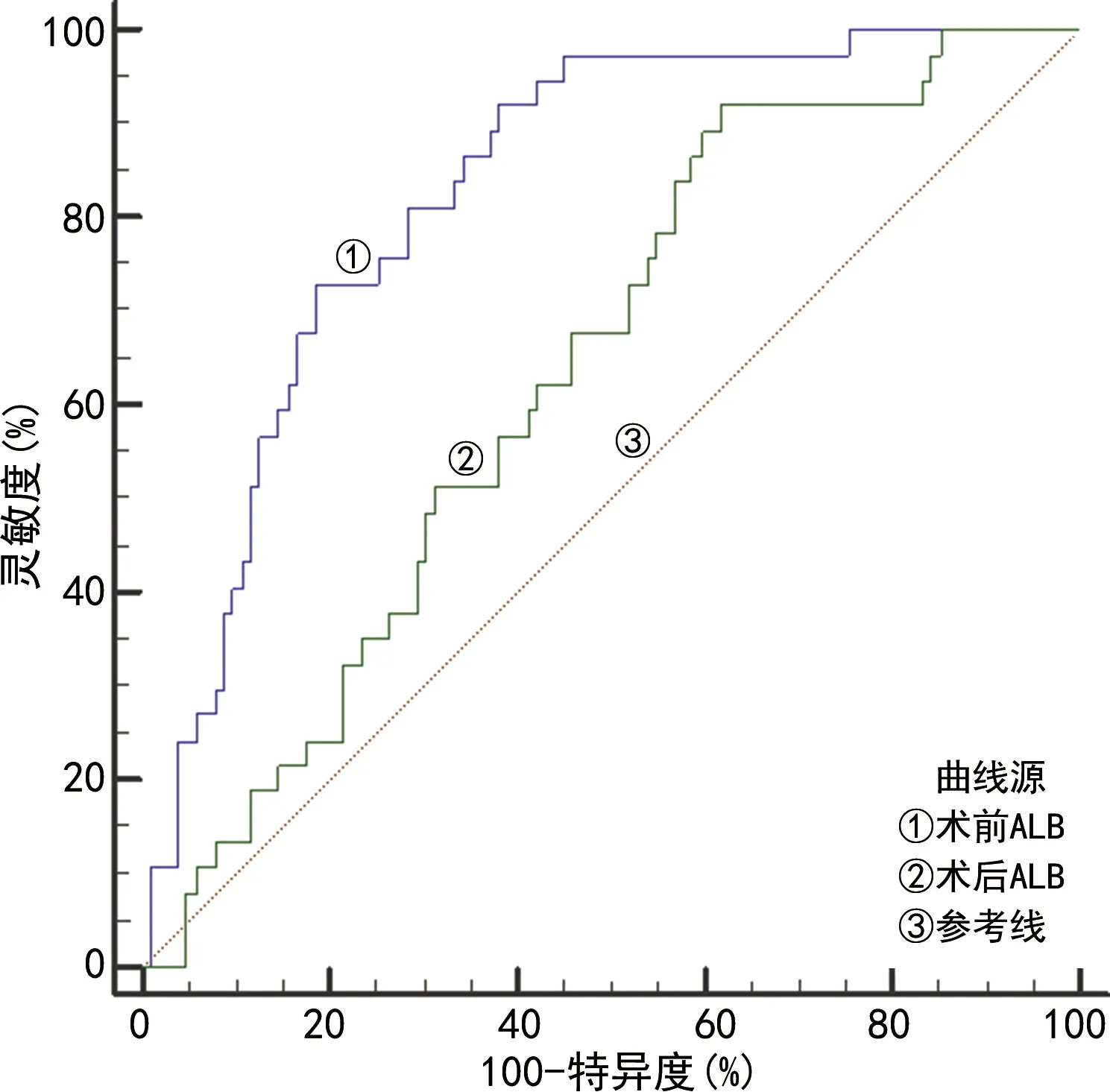
圖1 術前及術后ALB預測術后IAI的ROC曲線
3 討 論
原發性肝癌患者病灶周圍結構復雜,同時由于不同程度的肝臟代謝障礙導致免疫功能下降,進而極易誘發術后IAI,最終導致患者病情惡化,影響預后及生存率[9]。ALB是血漿中主要的蛋白成分之一,具有維持機體營養狀態及血液滲透壓的作用,既往對于外科手術后感染性疾病的研究結果顯示,人體營養狀態與手術后感染性疾病顯著相關,故將ALB作為反映機體營養狀態的指標,可能其與術后感染也存在一定的相關性[10]。
本研究結果顯示,術后發生IAI的患者術中膽管處理率高、手術時間相對較長。由于肝癌病灶接近膽道,壓迫膽管可能會導致原有的膽道疾病加重,造成局部炎癥或梗阻,術中需要切開引流,同時還有部分患者經術中膽道探查發現存在病灶轉移的情況,需要切除后行膽管-空腸吻合。既往研究結果顯示,膽道中含有大量有害菌群,尤其是對于膽管-空腸吻合患者,腸道切開后內部細菌可能會遷徙至腹腔內,同時,腸道連續性破壞也會導致腸道蠕動異常,從而造成菌群失調的情況,進一步增加IAI發生的風險[11-13]。手術時間與手術創口感染及IAI的相關性在既往相關研究中已經被證實[14]。主要是由于開腹手術時間長,可能導致外界致病菌進入手術區的可能性顯著增加,同時手術時間還與術后應激反應顯著相關,故手術時間長的患者術后IAI發生率上升。對于兩組患者術前及術后ALB水平的研究結果提示,肝癌切除術可影響患者ALB水平,導致患者術后ALB水平下降,主要是由于肝臟是ALB合成、代謝的主要器官,肝臟部分切除后會顯著影響患者ALB生成。XUE等[15]的研究顯示,由于手術導致的消化功能障礙、應激反應及傷口修復等因素,患者營養攝入障礙且ALB大量消耗,從而導致ALB水平顯著下降。而組間比較結果顯示,ALB水平較低的患者IAI發生率顯著增加,主要是由于ALB由肝細胞合成并釋放到循環系統中,其對血漿膠體壓力、宿主代謝、炎癥狀態以及各種合成代謝物質的變化均有顯著影響[16]。有研究結果顯示,術中肝門血管阻斷會誘發缺血再灌注損傷,從而導致局部炎癥因子水平升高,血管壁通透性增加,而ALB水平下降會引起血漿滲透壓降低,二者結合會導致部分液體滲入腹腔,可能激活NOD樣受體蛋白3炎性體途徑,導致白細胞介素(IL)-1及IL-18等強促炎性因子大量釋放,從而導致腹腔內炎性反應增強,最終引起IAI的發生[17-18]。
多因素分析結果顯示,術后ALB水平未影響術后IAI的發生,可能原因如下:(1)通過術后有效的營養治療能改善患者營養狀態,提高患者ALB水平,且術后ALB水平受術前ALB水平影響較大,進一步弱化了術后ALB對IAI的影響;(2)術后ALB水平受手術方式、代謝功能等因素的影響,而上述因素均會在手術過程中發生不同程度的改變,從而降低了術后ALB水平對IAI的影響;(3)本研究為單中心、小樣本量的研究,結果可能存在一定偏倚。
RUNGSAKULKIJ等[19]研究顯示,將接受肝切除術的患者按是否發生低蛋白血癥(ALB<35 g/L)進行分組比較,結果提示低蛋白血癥患者IAI發生率顯著上升。本研究通過分組建立術前及術后ALB預測IAI的ROC曲線,結果顯示,術前ALB對于術后IAI具有一定的預測效能,術前ALB預測的最佳臨界值為33.39 g/L,與RUNGSAKULKIJ等[19]研究結果一致。但術后ALB對IAI的預測效能不理想,提示在今后的臨床工作中可以將ALB與其他指標聯合對肝癌切除術后IAI的發生進行預測。
綜上所述,術前高水平ALB是IAI發生的保護因素,監測ALB水平對IAI的發生具有一定的預測價值,提示在今后的臨床工作中要進一步加強肝癌切除術患者圍術期的營養管理。

