可溶性程序性死亡受體-1、可溶性程序性死亡配體-1和γ-干擾素在晚期腫瘤患者血清中的表達特征和臨床意義*
孔評石,陳美云,滕鳳猛
江蘇省第二中醫院:1.檢驗科;2.腫瘤科,江蘇南京 210017;3.南京中醫藥大學附屬醫院/江蘇省中醫院檢驗科,江蘇南京 210004
隨著近年來免疫檢查點抑制劑(ICB)療法在腫瘤治療中取得的巨大進步,程序性死亡受體-1(PD-1)和程序性死亡配體-1(PD-L1)等免疫檢查點分子的表達特征在臨床治療中的預測價值備受關注,病理組織中PD-1和PD-L1的表達水平聯合其他指標的預測模式正在逐步建立。可溶性程序性死亡受體-1(sPD-1)和可溶性程序性死亡配體-1(sPD-L1)是PD-1和PD-L1的可溶性形式,與細胞膜型分子聯系密切,在免疫平衡中發揮重要作用,對判斷機體免疫狀態、預測免疫治療療效和腫瘤轉歸具有潛在的重要價值,并且因PD-1/PD-L1通路在免疫檢查點相關的免疫抑制中的關鍵性和廣泛性作用而越發受到關注;然而sPD-1和sPD-L1在外周循環中的表達特征和表達水平仍缺乏更廣泛的數據支持,國內的研究也相對較少。γ-干擾素(IFN-γ)在調控PD-L1中具有重要作用,有研究發現,IFN-γ聯合PD-L1能夠對腫瘤微環境的不同免疫特征進行有效劃分,并具有一定的治療預測價值[1],然而二者在外周血中同步觀察的數據較少。本研究擬以健康人和良性疾病患者為對照,對晚期惡性實體腫瘤(包括肺癌和消化道腫瘤)患者血清sPD-1和sPD-L1的水平進行檢測,同時分析其與IFN-γ及傳統腫瘤標志物表達水平的相關性,旨在對腫瘤免疫中外周血可溶性免疫檢查點分子的表達特征和臨床意義進行初步探討。
1 資料與方法
1.1一般資料 本研究納入2020年5—7月江蘇省第二中醫院(簡稱本院)腫瘤科收治的非小細胞肺癌(NSCLC)患者21例(肺癌組),男13例,女8例,年齡55~80歲,平均(67.1±6.7)歲;消化道腫瘤患者13例(消化道腫瘤組),男8例,女5例,年齡58~82歲,平均(67.8±7.0)歲,包括胃癌3例,胰腺癌2例,食管癌2例,結腸癌6例。納入病例均經過病理檢查或細胞學檢查確診,既往進行過化療且未進行過免疫治療,TNM分期為Ⅲb~Ⅳ期,分別符合《原發性肺癌診療規范(2018版)》《食管癌診療規范(2018版)》《胃癌診療規范(2018版)》《胰腺癌診療規范(2018版)》《中國結直腸癌診療規范(2017版)》的診斷標準。另選取同期本院呼吸科住院的肺部良性疾病患者16例(肺炎組)及體檢健康者12例(體檢組)作為對照,肺炎組男9例,女7例,年齡51~77歲,平均(64.8±8.3)歲;體檢組男6例,女6例,年齡40~74歲,平均(54.7±12.3)歲。各組人群性別及年齡比較,差異均無統計學意義(P>0.05),具有可比性。排除自身免疫性疾病和結核、梅毒、病毒性肝炎等傳染性疾病及器官功能嚴重受損者。
1.2方法 受試者常規空腹抽取靜脈血,離心分離血清。甲胎蛋白(AFP)、癌胚抗原(CEA)、糖類抗原125(CA125)、糖類抗原153(CA153)、糖類抗原199(CA199)、糖類抗原724(CA724)、細胞角蛋白19片段(Cyfra211)、神經元特異性烯醇化酶(NSE)采用全自動化學發光檢測;sPD-1、sPD-L1和IFN-γ檢測分別按酶聯免疫吸附試驗(ELISA)試劑盒說明書操作,檢測信號波長:450 nm,矯正波長:570 nm;采用雙抗體夾心法,標準曲線采用四參數擬合。上述腫瘤標志物采用Roche公司Cobas e602電化學發光分析儀和配套Elecsys試劑檢測;免疫標志物sPD-1、sPD-L1和IFN-γ采Thermo公司Multiskan FC酶標儀檢測,試劑盒為上海愛必信公司產品。

2 結 果
2.1各組腫瘤標志物水平比較 消化道腫瘤組CEA為18.35 (6.12,112.05)ng/mL,肺癌組CEA 為9.46(2.89,194.65)ng/mL,均高于肺炎組的1.73(1.48,3.56)ng/mL和體檢組的1.46(1.27,1.92)ng/mL(P<0.01);消化道腫瘤組CA125為95.15(14.17,424.15)U/mL,高于肺炎組的14.11(5.96,34.56)U/mL(P<0.05);肺癌組CA153為13.17(8.27,25.58)U/mL,高于肺炎組的5.18(3.74,10.24)U/mL(P<0.05);消化道腫瘤組CA199為244.30(26.99,1 000.00) U/mL,高于體檢組的8.05(6.35,12.82)U/mL(P<0.01);消化道腫瘤組CA724為7.03 (2.38,15.56)U/mL,高于肺炎組的1.54(0.77,3.11)U/mL(P<0.05);肺癌組Cyfra211為5.54(3.94,30.40)ng/mL,消化道腫瘤組Cyfra211為10.40 (5.27,108.65)ng/mL,均高于體檢組的2.09(1.17,2.72)ng/mL和肺炎組的1.47(1.20,3.62)ng/mL(P<0.01);肺癌組NSE為17.10(12.01,34.87)ng/mL,高于體檢組的11.14(9.41,12.99)ng/mL(P<0.05)。見圖1。
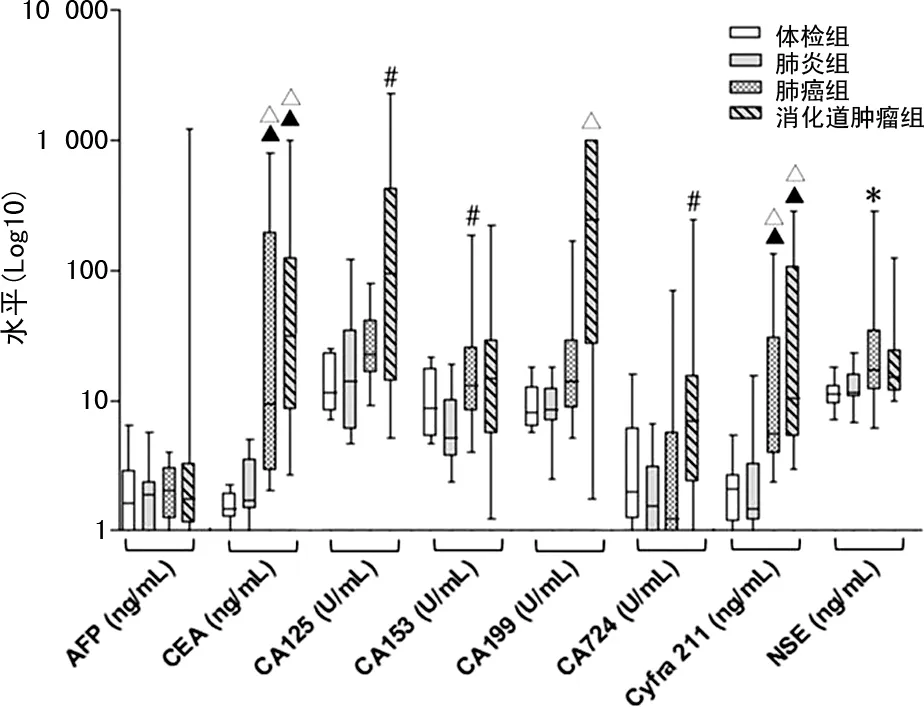
注:與體檢組比較,△P<0.01;與肺炎組比較,▲P<0.01;與體檢組比較,*P<0.05;與肺炎組比較,#P<0.05。
2.2各組免疫指標水平比較 腫瘤患者的sPD-1和sPD-L1水平有升高的趨勢,其中消化道腫瘤組sPD-1為480.51 (235.34,4 745.00)pg/mL,顯著高于體檢組的182.13(104.79,320.37)pg/mL(P<0.05),sPD-L1/IFN-γ為27.32(5.15,194.01),高于肺炎組的5.39(2.99,7.48)(P<0.01);各組IFN-γ水平比較,差異無統計學意義(P>0.05)。見圖2。
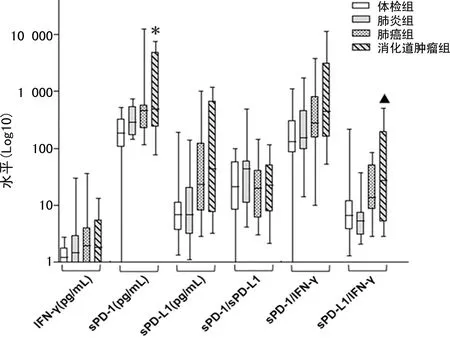
注:與體檢組比較,*P<0.05;與肺炎組比較,▲P<0.01。
2.3不同水平腫瘤標志物和IFN-γ對sPD-1、sPD-L1的影響 34例腫瘤患者并非進行所有腫瘤標志物和免疫標志物的檢測,其中CA125/CA153/CA724/Cyfra211各有2例患者未做檢測因而未納入統計。以腫瘤患者各項腫瘤標志物和IFN-γ水平中位數作為界值將其分為高水平和低水平,分析同水平腫瘤標志物和IFN-γ對sPD-1和sPD-L1表達高低的影響,結果顯示僅IFN-γ水平對sPD-1和sPD-L1水平有影響(P<0.01)。見表1。
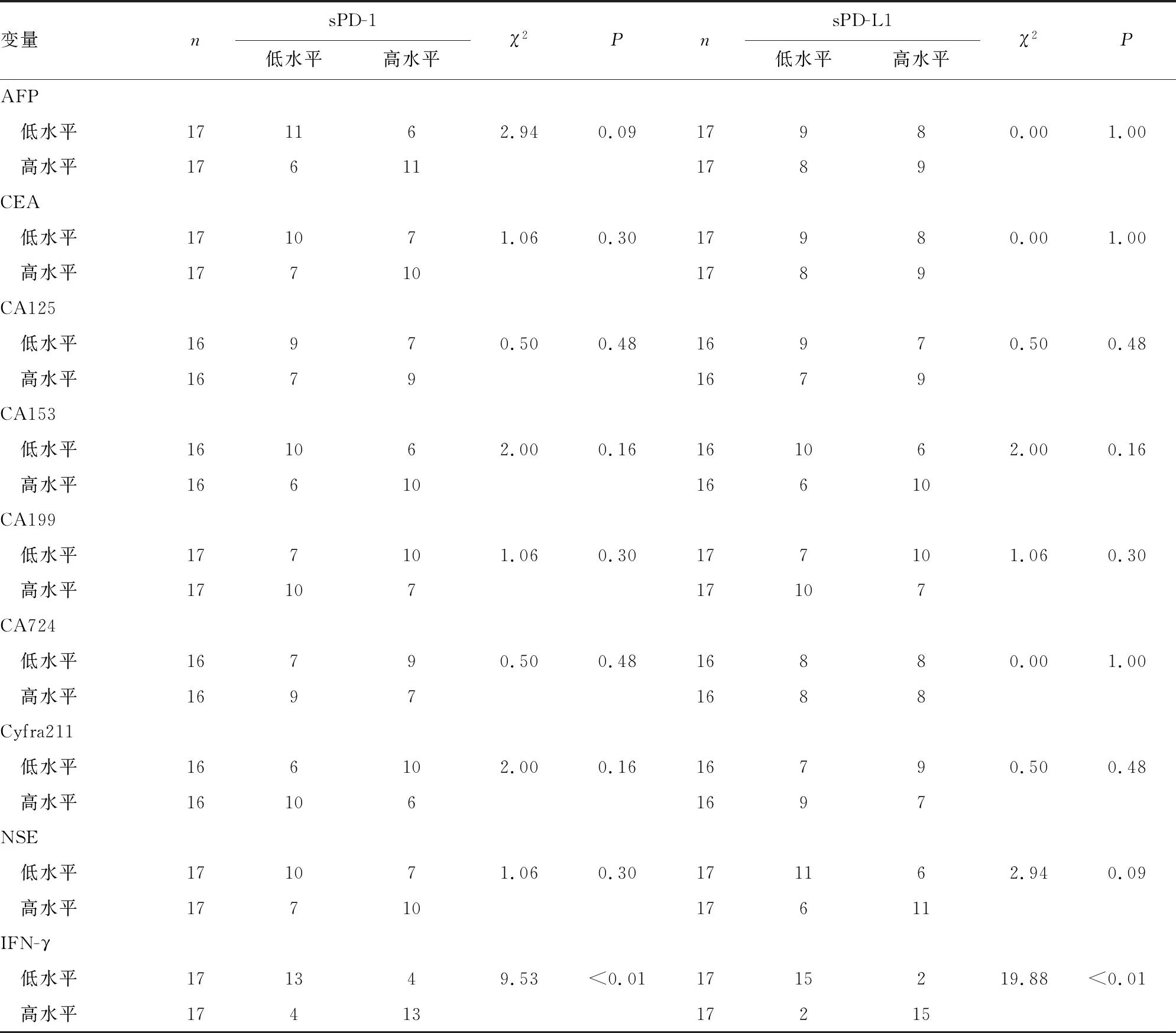
表1 不同水平腫瘤標志物和IFN-γ對sPD-1、sPD-L1的影響(n)
2.4各項免疫指標的相關性分析 在肺癌組、消化道腫瘤組及所有腫瘤患者中,sPD-1和sPD-L1呈正相關;在肺炎組中,IFN-γ與sPD-L1呈正相關。見圖3。

注:A為肺癌組;B為消化道腫瘤組;C為肺癌組+消化道腫瘤組;D為肺炎組。
3 討 論
近年來隨著腫瘤免疫調控機制的逐漸清晰,PD-1/PD-L1作為新興的生物標志物,其作用和價值在抗腫瘤療效預測、病情監測和預后評估中得到迅速拓展[2]。PD-1作為共抑制分子廣泛表達于T細胞等多種免疫細胞表面,在免疫平衡中發揮重要作用。腫瘤浸潤淋巴細胞(TIL)持續高表達的PD-1被認為是T細胞耗竭的重要標志之一,在多種腫瘤的治療中顯示出一定的預測價值,同時也是目前ICB療法最集中的抑制靶點[3]。PD-L1是PD-1的配體,組成性表達于多種免疫細胞,在激發后其表達上調。多種腫瘤細胞和腫瘤微環境中抗原呈遞細胞亦高表達PD-L1,其與TIL上的PD-1結合,激活PD-1/PD-L1通路引起T細胞內一系列事件,最終導致T細胞耗竭、凋亡和腫瘤免疫耐受[4]。PD-L1在腫瘤組織中的表達水平是基于PD-1/PD-L1通路的多種ICB療法的重要療效預測標志物,近年來在腫瘤免疫治療中得到了充分的發掘,PD-L1及其聯合TIL浸潤程度、IFN-γ共表達以及T細胞免疫球蛋白粘蛋白-3(TIM-3)等其他免疫檢查點分子的共表達等特征成為評價TIL狀態、劃分腫瘤微環境免疫類型、選擇合適療法、預判獲益人群以及預后評估的重要工具[4]。
sPD-1是PD-1的可溶性形式,近年來發現其具有重要的免疫調節作用。sPD-1是全長PD-1(flPD-1)mRNA剪接體的翻譯產物之一,能與PD-L1結合從而阻斷其與膜型PD-1(mPD-1)結合,具有抵抗T細胞抑制的功能;sPD-1能夠促進樹突狀細胞(DC)的成熟從而提高T細胞的抗腫瘤效應。腫瘤特異性T細胞是sPD-1的主要來源,多種腫瘤患者sPD-1水平升高,提示其具有腫瘤生物標志物的潛能。有研究表明,sPD-1在肝癌、胰腺癌、晚期食管癌等多種腫瘤治療前的高表達與疾病嚴重程度、臨床病理特征及預后有關[5-7]。在乙型肝炎病毒(HBV)相關的肝細胞癌(HCC)中,通過評估sPD-1水平對HBV載量和HCC風險的影響發現,sPD-1水平升高的縱向效應有助于維持長期較高的病毒載量,并且與肝癌風險呈正相關[8]。也有研究發現,sPD-1水平的穩定或升高與肝癌手術、鼻咽癌放療和肺癌的表皮生長因子受體酪氨酸激酶抑制劑(EGFR-TKIs)治療的預后改善有關[9-11]。經EGFR-TKIs治療的NSCLC患者sPD-1水平升高,與無進展生存期(PFS)和總生存期(OS)的提高有關;使用PD-1單抗治療后,sPD-1水平穩定或升高的NSCLC患者PFS和OS也得到改善[12],可能提示sPD-1對免疫抑制的抵抗能引起腫瘤特異性細胞毒性T細胞再激活。
sPD-L1是PD-L1的可溶性形式,主要由膜型PD-L1(mPD-L1)經基質金屬蛋白酶(MMPs)剪切產生,通過與PD-1特異性結合發揮免疫抑制作用。sPD-L1可從PD-L1陽性的腫瘤細胞中釋放,還來源于腫瘤微環境中的巨噬細胞、活化的DC等髓系細胞并受周圍細胞因子、炎癥環境等多因素調節。因此,sPD-L1水平是由患者的腫瘤負荷和腫瘤外炎性背景共同決定的。sPD-L1在多種腫瘤組織中表達,并已逐漸應用于腫瘤患者的病理特征、治療反應和生存結局的預測[13-15]。高水平sPD-L1與肺癌、肝癌預后不良相關[14-15];sPD-L1還與肺癌的分期、淋巴結的轉移、腹部的臟器轉移等因素密切相關[16]。病情緩解的患者sPD-L1水平呈下降趨勢,而病情進展的患者sPD-L1水平呈上升趨勢,提示sPD-L1對PD-1陽性T細胞的抑制加強,有助于腫瘤細胞產生免疫逃逸。患者sPD-L1水平越高,機體免疫抑制越嚴重,預后越差。然而,亦有研究發現,在晚期胃癌患者的預后評估中,高水平的sPD-L1與腫瘤淋巴結轉移無關,晚期胃腺癌患者sPD-L1水平越高,預后越好[17]。
sPD-1和sPD-L1可能在腫瘤的發病機制、免疫反應和療效預測中發揮重要作用,但sPD-1/sPD-L1與腫瘤及mPD-1/mPD-L1之間的作用仍然十分復雜,現有的數據尚不能提供一致的預測模式。
本研究發現,在晚期肺癌和消化道腫瘤患者中,sPD-1和sPD-L1整體呈高表達,消化道腫瘤組sPD-1水平顯著高于體檢組,sPD-L1水平也具有一定的升高趨勢;此外,肺癌組sPD-1、PD-L1和消化道腫瘤組sPD-1、sPD-L1水平范圍較廣,離散程度較大,推測一方面與患者病種和病理分型、分期的差異有關,另一方面也反映了腫瘤異質性和不同個體免疫反應強度的巨大差異。
本研究發現在肺癌組、消化道腫瘤組及全部腫瘤患者中,sPD-1與sPD-L1均呈正相關。sPD-1/sPD-L1的同步升高提示它們在免疫平衡中密切聯系以對抗彼此消長的影響,即腫瘤特異性T細胞產生的sPD-1與癌細胞等分泌的sPD-L1維持一種有利于腫瘤細胞的免疫內穩態[18],sPD-1提升對sPD-L1/mPD-1的抵抗作用以避免T細胞過度抑制;相反,sPD-L1的增加進一步作用于mPD-1以加強T細胞抑制,增強腫瘤免疫逃避并導致不良預后。目前利用sPD-1緩解T細胞抑制的抗癌策略受到越來越多的關注,并在研究中顯示出巨大的潛力[19]。
IFN-γ是由活化T細胞、自然殺傷細胞及巨噬細胞等釋放的重要的抗腫瘤細胞因子,能夠通過激活酪氨酸蛋白激酶2(JAK2)/信號傳導與轉錄激活因子3(STAT1)通路抑制腫瘤細胞增殖,并通過上調腫瘤細胞表面組織相容性復合體抗原分子的表達促進殺傷性T細胞對腫瘤細胞的識別殺傷。同時IFN-γ也是PD-L1的最強誘導因素,在多種腫瘤中介導PD-L1上調進而激活PD-L1/PD-1通路并抑制T細胞的抗腫瘤免疫應答[20]。研究發現,IFN-γ與PD-L1雙陽性患者的腫瘤細胞對治療敏感,無病生存期較其他患者顯著延長。IFN-γ與PD-L1雙陽性的患者中,促進腫瘤生長的細胞周期相關基因的表達水平顯著降低,因此IFN-γ和PD-L1雙陽性表達可作為PD-1/PD-L1阻斷治療有效的預測指標[1,20]。高密度TIL是多種腫瘤患者的有利預后因素,肺腺癌組織中IFN-γ的表達量與癌巢中TIL數目和PD-1的表達量均呈正相關,表明IFN-γ的表達水平可反映腫瘤微環境中免疫應答的強弱。
本研究未發現IFN-γ在腫瘤和肺炎患者呈明顯的高表達,然而在肺炎患者中IFN-γ與sPD-L1呈正相關,反映了炎癥環境中sPD-L1對IFN-γ促炎性的平衡作用。本研究中肺癌組和消化道腫瘤組sPD-L1/IFN-γ相對于肺炎組及體檢組有升高趨勢,并且消化道腫瘤組顯著高于肺炎組,可能提示IFN-γ對晚期腫瘤中sPD-L1的上調作用更為顯著,體現了腫瘤內穩狀態下外周循環中PD-L1的免疫抑制對IFN-γ的免疫促進優勢。同時筆者發現在腫瘤患者中,不同IFN-γ水平的患者其sPD-1和sPD-L1分布有顯著差異,反映了不同個體的免疫反應強度差異以及外周循環中IFN-γ/PD-L1/PD-1在參與腫瘤免疫調控中扮演著重要角色。本研究結果顯示,反映腫瘤負荷的傳統腫瘤標志物在腫瘤患者中多有不同程度的升高,但是與sPD-1/sPD-L1缺乏明顯的相關性。以往的證據表明,sPD-1/sPD-L1的高表達與腫瘤的淋巴結轉移關系密切[16],同時考慮到癌巢中TIL等免疫細胞密度以及mPD-1/mPD-L1表達的不同,晚期腫瘤患者外周循環sPD-1/sPD-L1水平整體呈高表達且又存在巨大個體差異的特征可能更具有劃分患瘤機體整體的細胞免疫狀態的潛在價值,進而可能為ICB療法等免疫治療及其他抗腫瘤治療策略的選擇提供方向性的指導作用,有待今后的深入研究。
目前臨床常應用免疫組化法檢測局部腫瘤組織中PD-1/PD-L1的表達,需要通過侵入性手段獲取腫瘤組織,對于晚期非手術適應患者尤其是轉移性腫瘤患者存在取材障礙的問題,并且組織樣本檢測技術平臺標準難以統一,操作步驟復雜以及結果判定上存在主觀差異,結果的可重復性不夠理想,因此PD-1/PD-L1組織病理檢測難以成為廣泛適用的手段。而血清可溶性分子的檢測具有無創性取材、能夠動態連續觀察指標變化的明顯優勢,并且在一定程度上可均質化腫瘤的異質性和多發轉移性,能同時檢測多個相關指標,更客觀地反映機體整體的腫瘤免疫狀態。sPD-1/sPD-L1的潛在應用價值已越來越受到關注,本研究僅為針對臨床晚期腫瘤患者小樣本量的探索,不同實體瘤病種及分期、分型中sPD-1/sPD-L1表達變化以及更精準的預后和治療預測價值有待研究的進一步深入和拓展。

