超聲引導ESPB與TPVB聯合靜脈自控鎮痛用于三孔胸腔鏡肺葉切除術中的隨機對照研究*
朱肖萌,范 颯
(河北省保定市第二醫院麻醉科 071000)
相關臨床資料顯示,三孔胸腔鏡肺葉切除手術雖屬微創術式,創傷較小,但患者仍易因手術切口、胸壁神經、肋間肌損傷等出現炎性應激反應及術后疼痛,積極采取科學、有效鎮痛處理是保證手術整體效果、促進機體康復的重要措施[1-2]。受損組織炎性反應、神經損傷等是引起術后疼痛的最主要原因[3],除靜脈自控鎮痛外,安全、有效的神經阻滯技術也可針對上述途徑對術后疼痛實施干預[4]。豎脊肌平面阻滯(erector spinae plane block,ESPB)、胸椎旁神經阻滯(thoracic paravertebral block,TPVB)是胸外科手術常用的2種神經阻滯技術,均有良好的安全性及可行性[5],但二者在術后鎮痛中的應用效果尚存在爭議。本研究采用多模式鎮痛方案,觀察了超聲定位下ESPB與TPVB分別聯合靜脈自控鎮痛在三孔胸腔鏡肺葉切除手術術后鎮痛中的應用效果,旨在為臨床選擇提供參考。
1 資料與方法
1.1 一般資料

1.2 納入標準
(1)經胸部X線片、CT等影像學及組織病理學檢查確診為原發性肺癌;(2)具備三孔胸腔鏡肺葉切除手術適應證,且行單側手術;(3)凝血功能、血常規、傳染5項等術前常規檢查結果正常;(4)無麻醉藥物過敏史;(5)入院近2周內未服用過鎮痛藥物,且既往無長期鎮痛藥物使用史;(6)對本研究知情并簽署同意書。
1.3 排除標準
(1)重要器官(心、肝、腎等)功能障礙;(2)合并其他惡性腫瘤;(3)妊娠、哺乳期女性;(4)對本研究所用麻醉方案存在使用禁忌證或不耐受;(5)患有精神類、自身免疫、血液系統疾病;(6)術前合并慢性疼痛;(7)穿刺部位皮膚感染。
1.4 方法
1.4.1手術方法
術前常規禁食8 h,禁飲4 h,入室后開放外周靜脈通道,穿刺橈動脈置管,連接心電監護設備,檢測腦電雙頻譜指數(bispectral index,BIS)。兩組患者均于氣管插管全身麻醉下實施三孔胸腔鏡肺葉切除手術,術后予以靜脈自控鎮痛;TPVB組在麻醉誘導前實施超聲定位下TPVB,ESPB組在麻醉誘導前實施超聲定位下ESPB。
1.4.2超聲定位下TPVB
患者取健側臥位,常規消毒、鋪巾,以Edge型超聲(美國Sonosite)高頻線陣探頭掃描T5棘突,以橫突為標志,在超聲視窗中找到肋橫突韌帶、胸膜形成的三角形胸椎旁間隙,體表定位;平面內橫向入路進針至胸椎旁間隙,進針深度35~60 mm,針尖至胸膜上方;回抽無出血、無氣體后于胸椎旁間隙注入羅哌卡因(河北一品制藥股份有限公司,國藥準字H20173027)100 mg;注入局部麻醉(局麻)藥后可見胸膜下移,注射完成后5、10、15 min以針刺法檢查阻滯平面。

表1 兩組患者一般資料比較
1.4.3超聲定位下ESPB
患者取健側臥位,常規消毒、鋪巾,以Edge型超聲(美國Sonosite)高頻線陣探頭掃描T5棘突,探頭外移至顯現T5、T6橫突,可見斜方肌、大菱形肌、豎脊肌覆蓋橫突表面;平面內頭向尾端進針,針尖觸及橫突骨質后,進針深度35~60 mm;回抽無出血、無氣體后于豎脊肌、橫突間注入羅哌卡因100 mg;可見局麻藥在豎脊肌平面內擴散,注射完成后5、10、15 min以針刺法檢查阻滯平面。
1.4.4氣管插管全身麻醉
(1)麻醉誘導:依次靜脈注射舒芬太尼(宜昌人福藥業有限責任公司,國藥準字H20054172)0.5 μg/kg、咪達唑侖(江蘇恩華藥業股份有限公司,國藥準字H20143222)0.02~0.05 mg/kg、羅庫溴銨(浙江仙琚制藥股份有限公司,國藥準字H20093186)0.6 mg/kg、依托咪酯(江蘇恒瑞醫藥股份有限公司,國藥準字H32022379)0.3~0.4 mg/kg;面罩通氣,待BIS低于50、肌肉松弛后置入雙腔管,連接呼吸機進行機械通氣。(2)麻醉維持:以全憑靜脈麻醉維持,持續泵注瑞芬太尼(江蘇恩華藥業股份有限公司,國藥準字H20143315)12~20 μg·kg-1·h-1、丙泊酚(四川國瑞藥業有限責任公司,國藥準字H20030114)4~6 mg·kg-1·h-1、右美托咪定(江蘇恒瑞醫藥股份有限公司,國藥準字H20130093)0.2~0.7 μg·kg-1·h-1,術中按需追加羅庫溴銨0.1~0.2 mg/kg;手術結束后進入麻醉恢復室(postanesthesia care unit,PACU)進行監測及麻醉復蘇。
1.4.5靜脈自控鎮痛
術后連接電子鎮痛泵(愛朋,ZZB-Ⅳ型)持續進行靜脈自控鎮痛,負荷量為5 mL,鎮痛藥物配方:150~200 μg舒芬太尼聯合8~12 mg昂丹司瓊(吉林菲諾制藥有限公司,國藥準字H20058614),混合后以注射用生理鹽水稀釋至100 mL;設置背景劑量為1 mL/h,自控追加劑量為1 mL,鎖定時間為10 min;術后48 h撤掉鎮痛泵。
1.5 觀察指標
1.5.1臨床監測指標
(1)記錄心電監護設備上阻滯前(T0)、手術切皮時(T1)、手術開始后30 min(T2)、術畢拔管時(T3)心率、平均動脈壓(mean arterial blood pressure,MAP)以評估兩組患者血流動力學變化情況。(2)分別于T0、T3、術后24 h(T4)、術后48 h(T5)采集兩組患者外周靜脈血約5 mL,3 500 r/min低溫離心5 min后取上層血清,采用全自動生化分析儀(貝克曼庫爾特,IMMAGE)以酶聯免疫吸附法測定腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素-8(IL-8)、白細胞介素-6(IL-6)水平以評估兩組患者炎性反應水平;采用免疫比濁法測定免疫球蛋白A(immunoglobulin A,IgA)、免疫球蛋白M(immunoglobulin M,IgM)、免疫球蛋白G(immunoglobulin G,IgG)水平以評估兩組患者體液免疫水平。
1.5.2臨床指標
(1)分別于術后1、6 h,T4、T5采用疼痛數字評分法(NRS)評估兩組患者靜息、咳嗽狀態下疼痛程度,總分為0~10分,評分越高表示疼痛越嚴重;(2)統計比較兩組患者PACU補救鎮痛比例(靜息狀態下NRS評分大于4分時靜脈推注曲馬多1 mg/kg)、鎮痛泵應用情況(靜脈自控鎮痛輸注總量、靜脈自控鎮痛按壓次數)和不良反應發生情況(包括惡心、嘔吐、頭暈、后背痛等)。
1.6 統計學處理
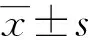
2 結 果
2.1 神經阻滯平面
TPVB組患者在采取阻滯15 min后平均阻滯平面為(6.72±0.94)節段;ESPB組在采取阻滯15 min后平均阻滯平面為(6.46±1.02)節段,兩組比較,差異無統計學意義(t=1.365,P=0.175)。
2.2 血流動力學變化
兩組患者心率、MAP水平組間、不同時間點及交互作用比較,差異均無統計學意義(P>0.05);兩組患者T0~T3時心率、MAP水平比較,差異均無統計學意義(P>0.05);兩組患者T1~T3時心率、MAP水平均較T0時明顯降低,差異均有統計學意義(P<0.05),見表2、圖1。

表2 兩組患者各時間點血流動力學變化比較

a:P<0.05,與同組T0時比較。
2.3 血清炎性反應水平
兩組患者血清TNF-α、IL-8、IL-6水平組間、不同時間點及交互作用比較,差異均有統計學意義(P<0.05);TPVB組患者血清TNF-α、IL-8、IL-6升高幅度更低。兩組患者T0時血清TNF-α、IL-8、IL-6水平比較,差異均無統計學意義(P>0.05);TPVB組患者T3~T5時均明顯低于ESPB組,差異均有統計學意義(P<0.05);兩組患者T3~T5時均較T0時提高,差異均有統計學意義(P<0.05),見表3、圖2。
2.4 血清體液免疫水平
兩組患者血清IgA、IgM、IgG水平組間、不同時間點及交互作用相比,差異均有統計學意義(P<0.05);TPVB組患者血清IgA、IgM、IgG降低幅度更小。兩組患者T0時血清IgA、IgM、IgG水平比較,差異均無統計學意義(P>0.05);TPVB組患者T3~T5時均明顯高于ESPB組,差異均有統計學意義(P<0.05);兩組患者T3~T5時均較T0時明顯降低,差異均有統計學意義(P<0.05),見表4、圖3。
2.5 NRS評分
TPVB組患者術后1、6 h,T4、T5靜息與咳嗽狀態下NRS評分均較ESPB組低,差異均有統計學意義(P<0.05),見表5。

表3 兩組患者各時間點血清炎性反應水平比較

續表3 兩組患者各時間點血清炎性反應水平比較

組別nIL-6T0T3T4T5TPVB組5360.49±7.0296.93±8.26145.14±10.39126.03±9.65ESPB組5358.51±8.24143.47±10.35185.16±13.42167.58±12.51組間比較F=7.812,P=0.008各時間點比較F=9.328,P=0.001交互作用比較F=8.640,P=0.001

a:P<0.05,與同組T0時比較;b:P<0.05,與ESPB組比較。

圖2 兩組患者各時間點血清炎性反應水平比較

組別nIgMT0T3T4T5TPVB組5318.61±2.4216.58±2.0515.39±1.7216.15±1.97ESPB組5319.09±2.6014.26±1.8712.95±1.4813.72±1.63組間比較F=8.018,P=0.009各時間點比較F=8.761,P=0.001交互作用比較F=8.429,P=0.001

組別nIgGT0T3T4T5TPVB組5314.73±2.8412.97±1.5711.75±1.8012.38±2.16ESPB組5315.06±2.3910.43±1.269.72±1.5010.16±1.75組間比較F=8.004,P=0.010各時間點比較F=8.976,P=0.001交互作用比較F=8.501,P=0.001

a:P<0.05,與同組T0時比較;b:P<0.05,與ESPB組比較。
2.6 PACU補救鎮痛比例、鎮痛泵應用情況及鎮痛藥物配方舒芬太尼劑量
兩組患者鎮痛藥物配方舒芬太尼劑量比較,差異無統計學意義(P>0.05);TPVB組患者PACU補救鎮痛比例、靜脈自控鎮痛輸注總量、按壓次數均較ESPB組低,差異均有統計學意義(P<0.05),見表6。
2.7 不良反應發生情況
兩組患者不良反應發生率比較,差異無統計學意義(P>0.05),見表7。

表5 兩組患者各時間點靜息與咳嗽狀態下NRS評分比較分)

表6 兩組患者PACU補救鎮痛比例、鎮痛泵應用情況、鎮痛藥物配方舒芬太尼劑量比較

表7 兩組患者不良反應發生情況比較[n(%)]
3 討 論
術后疼痛是三孔胸腔鏡肺葉切除手術最常見的一類并發癥[6],據數據統計,術后8 h內患者靜息狀態時也存在劇烈疼痛感,術后24~48 h靜息狀態下疼痛雖有所緩解,但在咳嗽或其他活動時疼痛感依然較為強烈[7],如何減輕術后疼痛已成為麻醉醫師關注的重點問題。
靜脈自控鎮痛是減輕術后疼痛最直接的方式,但舒芬太尼及其他阿片類鎮痛藥物的應用易引起惡心、呼吸抑制等不良反應,影響患者的康復[8]。隨麻醉技術及加速康復外科的發展,圍術期多模式鎮痛方案已逐漸受到臨床重視,多提倡聯合運用不同機制的鎮痛方法以提高鎮痛效果,減少麻醉藥物使用,保證麻醉安全性[9-10]。硬膜外阻滯是既往臨床用于胸外科手術術后鎮痛的“金標準”,但存在發生硬膜外血腫、低血壓等嚴重并發癥的風險,且對凝血功能要求嚴格,進而限制了其臨床應用[11]。隨超聲可視化技術在麻醉領域的不斷發展,超聲定位下ESPB、TPVB等區域神經阻滯技術已逐漸用于胸外科手術圍術期多模式鎮痛,且可在患者術后康復中發揮良好的促進作用,為麻醉醫師提供了更多的選擇[12-13]。基于此,本研究對三孔胸腔鏡肺葉切除手術患者實施了超聲定位下神經阻滯聯合靜脈自控鎮痛的多模式鎮痛方案,以彌補單一靜脈自控鎮痛的不足之處,并分組從術中血流動力學、術后疼痛、炎性反應、免疫狀態等多個影響機體康復的方面比較了ESPB、TPVB的應用效果。其中TPVB是近年來備受關注的區域神經阻滯技術,胸椎旁間隙包含肋間神經及其背側支、交通支、交感干,包含了感覺、運動神經纖維[14],因此,可對脊神經根、肋間神經產生確切阻滯效果,且僅阻滯單側脊神經,對循環、呼吸影響較小[15]。ESPB屬新型軀干神經阻滯技術,局麻藥物注射至豎脊肌下筋膜間隙后可通過作用于脊神經背側支、腹側支達到鎮痛作用[16];同時沿胸腰筋膜向頭端、尾端縱行擴散至胸椎旁間隙,阻滯范圍基本覆蓋胸外科手術創傷范圍,且在超聲引導下實施操作較為簡單,可避免肥胖、脊柱畸形、胸腔積液等的影響[17]。
本研究首先針對圍術期血流動力學指標進行了分析,結果顯示,與T0時比較,兩組患者術中心率、MAP水平均有所降低,差異均有統計學意義(P<0.05),可能與ESPB、TPVB對交感神經節的阻滯作用導致外周血管擴張有關;兩組患者術中各時間點心率、MAP水平比較,差異均無統計學意義(P>0.05),且波動較小,可見ESPB、TPVB聯合全憑靜脈麻醉均可有效維持術中血流動力學穩定。手術創傷性刺激可破壞機體促炎性細胞因子、抗炎性細胞因子平衡狀態,引起炎性反應,加重機體損傷[18]。TNF-α、IL-8、IL-6均屬促炎性細胞因子,其血清水平可因手術創傷異常升高,可有效反映機體炎性反應程度,且與術后疼痛嚴重程度有一定相關性[19]。此外,手術疼痛除刺激應激性炎性反應外,還可損傷機體免疫功能,抑制免疫應答,使IgA、IgM、IgG等重要體液免疫因子表達降低[20]。此外,郭榮鑫等[21]研究表明,與ESPB比較,胸椎旁阻滯可明顯減少術后補救鎮痛例數,術后鎮痛效果更佳。本研究鎮痛效果評估及血標本檢查結果顯示,與ESPB組比較,TPVB組患者在減輕術后疼痛方面效果更為顯著,可避免補救鎮痛,減少靜脈自控鎮痛輸注總量及按壓次數,與上述研究結論一致,而且還發現TPVB組患者炎性反應較輕,對體液免疫影響較小。實施超聲定位下ESPB時局麻藥物可沿豎脊肌、肋間肌擴散,作用于同側脊神經背側支,產生廣泛的前胸、側胸壁皮區感覺阻滯[22];而實施超聲定位下TPVB時局麻藥物可走行于椎旁間隙的椎旁神經、交感神經,并擴散至硬脊膜外腔、椎前間隙、對側椎旁間隙,且胸椎旁間隙存在連續性解剖結構,單點注射后藥物可向上、下擴散,阻滯多個皮膚節段[23]。而神經阻滯效果與藥物擴散密切相關,與肌肉筋膜間隙比較,相同容量局麻藥物在胸椎旁間隙更易擴散[24],因此,超聲定位下TPVB對胸壁、內臟的鎮痛效果更佳,進而減輕了手術刺激引起的炎性反應及免疫抑制。本研究兩組患者麻醉安全性均良好,未引起嚴重不良反應,可見多模式鎮痛方案可有效避免因麻醉藥物用量過多引起的機體不適。
綜上所述,超聲定位下TPVB聯合靜脈自控鎮痛是麻醉技術、藥理學相結合的多模式鎮痛方案,鎮痛效果理想,可穩定患者術中血流動力學狀態,減輕手術疼痛感,緩解炎性反應及免疫抑制,減少鎮痛泵的使用,且麻醉安全性良好,可充分發揮區域麻醉優勢。但超聲定位下TPVB對解剖學及超聲技術要求較高,麻醉醫師需加強學習,熟練掌握操作方法,以保證整體效果。

