依達拉奉對急性缺血性卒中患者外周血自噬及氧化應激水平的影響*
李雪莉,楊清武
(陸軍軍醫大學第二附屬醫院神經內科,重慶 400038)
急性缺血性卒中(acute ischemic stroke,AIS)是臨床常見的腦血管疾病之一,目前,該疾病呈現“四高”特征,主要表現為發病率、病死率、致殘率及復發率高,給社會和家庭帶來沉重的經濟負擔[1]。AIS患者腦梗死區及梗死周圍區神經元細胞過度凋亡及壞死是引起患者神經功能障礙的直接原因,同時繼發的機體氧化應激及炎癥通路的激活可進一步加重神經功能障礙[2]。盡管積極的溶栓和介入取栓在AIS的臨床治療中發揮了重要作用,但有效的藥物治療也不可替代。依達拉奉是一種腦保護劑,可明顯抑制脂質過氧化,防止神經細胞及血管內皮細胞的氧化損傷,已廣泛用于腦梗死引起的神經病變[3]。近年來,細胞自噬與AIS發生及發展的關系逐漸被人們所認識。有研究表明,在AIS動物模型中機體細胞自噬明顯激活,抑制過度激活的細胞自噬可明顯改善AIS動物模型神經功能,同時降低其病死率[4]。而依達拉奉是否可降低AIS患者自噬水平,目前尚未見相關文獻報道。本研究探討了依達拉奉對AIS患者外周血細胞自噬、氧化應激及炎癥水平的影響,旨在為其臨床運用提供理論依據。
1 資料與方法
1.1 一般資料
選取2017年1月至2020年12月本院收治的AIS患者150例作為研究對象,采用隨機數字表法分為觀察組和對照組,每組75例。兩組患者性別、年齡、病程、基礎疾病及基礎治療方案等一般資料比較,差異均無統計學意義(P>0.05),見表1。本研究獲得本院倫理委員會批準并征得了患者書面知情同意。

表1 兩組患者一般資料比較
1.2 納入標準
(1)滿足AIS的診斷標準[5];(2)行靜脈溶栓或動脈取栓治療。
1.3 排除標準
(1)合并腦出血;(2)嚴重意識障礙;(3)合并惡性腫瘤、自身免疫性疾病及嚴重感染;(4)入院24 h內死亡;(5)對藥物(依達拉奉)過敏。
1.4 治療方法
對照組入院后根據AIS診治指南[5]給予相應基礎治療,發病3~6 d內者予以溶栓或取栓規范化治療,同時給予抗血小板、調脂、降壓、腦保護等處理。觀察組在常規治療基礎上入院當天即給予依達拉奉(國藥集團國瑞藥業有限公司,批號20160822,規格20 mL:30 mg)30 mg配以 100 mL生理鹽水注射液靜脈滴注,每天2次。兩組患者均連續治療2周。兩組患者調脂藥物均采用阿托伐他汀(美國輝瑞公司)20 mg,每天1次。
1.5 觀察指標
1.5.1自噬相關基因mRNA水平
收集兩組患者治療前及治療2周后外周血標本各2 mL,提取外周血單個核細胞(peripheral blood mononuclear cell,PBMC),采用TRIzol提取總RNA,然后進行反轉錄,實時熒光定量-聚合酶鏈反應(polymerase chain reaction,PCR)引物序列見表2。建立20 μL反應體系,包括1 μL cDNA、2 μL×PCR緩沖液、2.0 mmol MgCl2、0.2 mmol dNTP、每種引物1.0 μL及0.5 μL Taq DNA聚合酶。擴增反應條件:94 ℃預變性5 min,94 ℃變性30 s,59 ℃退火45 s;溶解曲線:95 ℃、15 s,60 ℃、1 min,95 ℃、30 s,60 ℃、15 s。以GAPDH作為內參,使用2-ΔΔCt方法計算靶基因相對mRNA水平。
1.5.2外周血炎性和氧化應激指標
分別于治療前及治療2周后采集兩組患者外周血3 mL,采用酶聯免疫吸附試驗測定外周血炎性細胞因子[白細胞介素(interleukin,IL)-1β、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)]和氧化應激指標[丙二醛(Malondialdehyde,MDA)、超氧化物歧化酶(Superoxide dismutase,SOD)]。具體操作依據試劑盒(南京建成生物技術公司)說明書進行。
1.5.3神經功能
分別于治療前及治療2周后采用美國國立衛生研究院卒中量表(national institute of health stroke scale,NIHSS)評分和日常生活活動能力(activities of daily living,ADL)量表評估兩組患者神經功能。NIHSS評分越低表示神經功能越好,ADL評分越高表示神經功能越好。

表2 PCR引物序列
1.5.4腦血流動力學
分別于治療前及治療2周后采用經顱超聲多普勒測定兩組患者大腦動脈血流情況,包括基底動脈、左右側大腦中動脈血流等。
1.5.5不良反應
記錄兩組患者治療期間不良反應發生情況,包括出血、惡心、嘔吐、皮疹等。
1.6 統計學處理
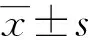
2 結 果
2.1 兩組患者治療前后自噬相關基因mRNA水平比較
兩組患者治療前PBMC中自噬相關基因Beclin-1、LC3-Ⅱ mRNA水平比較,差異均無統計學意義(P>0.05);兩組患者治療2周后上述指標均較治療前降低,且觀察組患者低于對照組,差異均有統計學意義(P<0.05),見表3。
2.2 兩組患者治療前后外周血炎性和氧化應激指標比較
兩組患者治療前外周血氧化應激(MDA、SOD)和炎性指標(IL-1β、TNF-α)比較,差異均無統計學意義(P>0.05);兩組患者治療2周后MDA、IL-1β、TNF-α均較治療前降低,且觀察組患者低于對照組(P<0.05);SOD均較治療前升高,且觀察組患者高于對照組,差異均有統計學意義(P<0.05),見表4。
2.3 兩組患者治療前后神經功能比較
兩組患者治療前神經功能(NIHSS、ADL評分)比較,差異無統計學意義(P>0.05);兩組患者治療2周后NIHSS評分均較治療前降低,ADL評分均較治療前升高,且觀察組NIHSS評分低于對照組,ADL評分高于對照組,差異均有統計學意義(P<0.05),見表5。

表3 兩組患者治療前后自噬相關基因mRNA水平比較

表4 兩組患者治療前后外周血炎性和氧化應激指標比較
2.4 兩組患者治療前后腦血流動力學比較
兩組患者治療前腦血流動力學指標基底動脈、左右側大腦中動脈血流比較,差異均無統計學意義(P>0.05);兩組患者治療2周上述指標均較治療前升高,且觀察組患者高于對照組,差異均有統計學意義(P<0.05),見表6。
2.5 兩組患者不良反應發生情況比較
觀察組患者中治療期間發生出血1例,惡心、嘔吐1例,皮疹1例,不良反應發生率為4.0%;對照組患者中治療期間發生出血1例,惡心、嘔吐1例,不良反應發生率為2.7%。兩組患者不良反應均較輕微,未經特殊處理癥狀均自行消失。兩組患者不良反應發生率比較,差異無統計學意義(P>0.05)。

表5 兩組患者治療前后神經功能比較分)

表6 兩組患者治療前后腦血流動力學指標比較
3 討 論
AIS是腦血管疾病中的危重癥,隨著我國進入人口老年化,該病發病率及病死率均呈逐年升高趨勢。近年來廣泛開展的卒中三級預防,對降低AIS發病率及病死率發揮了重要作用,在三級預防的基礎上如何進一步提高AIS患者的療效和改善其預后是目前臨床醫師關注的重點。AIS的發生機制主要與多種原因如動脈粥樣硬化、心源性血栓及小動脈閉塞等引起腦組織血液供應障礙,導致組織缺血、缺氧有關[6]。目前,針對AIS患者已成立卒中中心,采取多種方法進行救治,如第一時間溶栓或取栓恢復腦組織缺血再灌注;積極運用抗血小板、調脂、神經保護等藥物,挽救受損神經細胞等。
近年來,相關研究表明,細胞自噬在多種疾病如動脈粥樣硬化、急性心肌梗死、惡性腫瘤等的發生及進展中發揮了重要作用[7-9]。細胞自噬是機體通過吞噬及降解受損細胞質及細胞器,維持機體細胞代謝穩定的過程。但一旦機體遭受某些刺激如缺血、缺氧、酸中毒等,可顯著激活機體細胞自噬[10]。目前,有研究表明,細胞自噬在AIS發生后神經細胞凋亡中起著雙重作用,一方面AIS發生可促進機體細胞自噬的過度激活,進一步導致神經元凋亡和壞死,并增加腦梗死面積和加重神經功能的缺損;另一方面若在腦組織缺血缺氧前激活細胞自噬可顯著降低神經元死亡和腦損傷程度[11-12]。因此,自噬在AIS發生、發展中的作用可能取決于其激活的時間差異(AIS發生前或后)及程度。
依達拉奉作為神經保護劑,通過有效清除氧自由基,減輕神經細胞損傷,但對細胞自噬通路的影響目前尚未見相關文獻報道。本研究結果顯示,針對AIS患者在常規治療的基礎上加用依達拉奉可明顯降低機體過度激活的細胞自噬。有研究表明,過度的細胞自噬可促進細胞凋亡,進而激活氧化應激及炎性通路,加重組織器官損傷及細胞功能障礙[13]。對AIS患者,依達拉奉可明顯降低機體氧化應激和炎性相關指標水平,其可能與依達拉奉降低機體過度激活的細胞自噬有關。
NIHSS、ADL評分是評價AIS患者臨床療效及預后的關鍵指標,NIHSS評分越高表示神經功能越差,ADL評分越高表示神經功能越佳。本研究結果顯示,在常規治療基礎上依達拉奉可明顯降低NIHSS評分,升高ADL評分,更有效地恢復AIS患者受損的神經功能,與其他研究結果一致[14]。除NIHSS、ADL評分外,腦血流動力學也是一項評估AIS患者臨床療效的重要指標。本研究結果顯示,依達拉奉可明顯改善AIS患者腦血流,可能與降低細胞自噬、改善氧化應激及炎性反應,從而降低血液黏度、抑制血小板黏附與聚集、同時改善血管內皮功能有關。針對AIS患者在常規治療基礎上加用依達拉奉并未明顯增加不良反應發生率,說明在提高AIS患者療效及預后的同時安全性較好,值得臨床進一步推廣運用。
綜上所述,依達拉奉可明顯降低AIS患者機體過度激活的細胞自噬及下游氧化應激和炎性通路的激活,從而減輕腦組織缺血再灌注損傷,有助于恢復受損的神經功能。但目前依達拉奉如何降低細胞自噬的相關機制尚需進一步通過動物及細胞實驗予以研究。

