黃芪甲苷IV減輕尿毒癥模型大鼠腎血管內皮損傷
朱文勝,鄭忠毓,李曉霞,鄧建南,張吉春
(重慶市萬州區(qū)第五人民醫(yī)院 腎內科, 重慶 404100)
尿毒癥(uremia)是各種晚期的腎臟病共有的臨床綜合征。在中國,尿毒癥發(fā)病率和病死率隨著老齡化人口的增加而不斷上升[1]。目前研究發(fā)現(xiàn),血管內皮功能障礙,是尿毒癥的首要死亡原因,也是臨床研究的重點和難點問題[2]。核因子E2相關因子2(nuclear factor-E2-related factor2,Nrf2)/血紅素氧合酶-1(hemeoxygenase1,HO-1)在細胞抗氧化損傷和抗炎性損傷過程中發(fā)揮主要作用,并參與血管內皮損傷過程[3]。黃芪甲苷Ⅳ(astragaloside Ⅳ)是中藥黃芪的主要活性成分,具有抗炎、降血脂、改善糖尿病引起的血管病變和心肌病等作用[4],但其作用機制尚不清楚,本文通過腎臟切除法建立大鼠尿毒癥模型,對此進行探討。
1 材料與方法
1.1 材料
1.1.1 動物:SPF級SD雄性大鼠,體質量:220~240 g[廣東省醫(yī)學實驗動物中心,生產許可證號為SCXK(粵) 2016-0002],動物質量合格證號為省科委2000A027。
1.1.2 主要試劑 黃芪甲苷Ⅳ(上海阿拉丁生化科技有限公司);Nrf2抑制劑(MedchemExpress公司);白細胞介素-6(IL-6)酶聯(lián)免疫(ELISA)試劑盒和腫瘤壞死因子-α(TNF-α)ELISA試劑盒(武漢伊萊瑞特生物科技股份有限公司);肌酐(Scr)ELISA試劑盒(上海一研生物科技有限公司); 尿素氮(blood urea nitrogen,BUN) ELISA試劑盒(上海雅吉生物科技有限公司);血β2-微球蛋白(β2-microglobulin,β2-MG)ELISA試劑盒(上海研生實業(yè)有限公司);兔抗大鼠一抗Nrf2、HO-1(Proteinech Group公司);小鼠抗CD31、兔抗內皮型一氧化氮(endothelial nitric oxide synthase,eNOS)、血管生成素樣蛋白6(angiopoietin like protein 6,ANGPTL6)、單核細胞趨化蛋白-1(monocyte chemotactic protein-1,MCP-1)等抗體(Abcam公司)。
1.2 方法
1.2.1 大鼠的分組及處理:取70只大鼠,按文獻[5]方法切除占腎臟1/3的上極和下極左腎腎臟,術后1周進行完全摘除右腎手術,制備尿毒癥模型,4周后大鼠成活,隨機取2只大鼠剩余腎臟進行鏡檢,若出現(xiàn)腎血管內皮出現(xiàn)水腫、增大現(xiàn)象,視為造模成功,共造模成功60只(有3只于術后1周死亡,2只術后3周死亡,3只手術失敗死亡),將造模成功的大鼠隨機分為模型組、黃芪甲苷低(100 mg/kg)、高(200 mg/kg)劑量組、Nrf2抑制劑組(2 mg/kg)、黃芪甲苷+Nrf2抑制劑組(200 mg/kg+2 mg/kg),每組12只。另取12只大鼠,僅行麻醉和暴露雙腎,不做手術切除,作為假手術組。黃芪甲苷及Nrf2抑制劑參照文獻[6-7]設置劑量,用0.9%氯化鈉溶液稀釋成為10.0、20.0、0.2 mg/mL的混懸液,按10 mL/kg的劑量腹腔注射給藥,黃芪甲苷給藥3次/d,Nrf2抑制劑給藥1次/d;黃芪甲苷+Nrf2抑制劑組給予黃芪甲苷的同時腹腔注射給予Nrf2抑制劑;假手術組及模型組給予等量0.9%氯化鈉溶液,各組均連續(xù)給藥4周,給藥期間觀察大鼠行為及死亡狀況。
1.2.2 采集標本及透射電鏡觀察腎血管病變:末次給藥12 h后,麻醉大鼠,取腹主動脈血3 mL,3 000 r/min離心10 min后,取上清液于-20 ℃冰箱保存?zhèn)溆谩L幩来笫螅馄嗜∈S嗄I臟組織,經磷酸緩沖鹽沖洗后,切取腎組織0.5 g置于-80 ℃冰箱保存,剩余腎組織分成2部分,一部分送于電鏡室進行鏡檢并觀察拍照;另一部分制成冰凍切片備用。
1.2.3 ELISA檢測大鼠血清Scr、BUN、β2-MG、TNF-α、IL-6水平:以ELISA試劑盒說明書方法檢測Scr、BUN、β2-MG及血清TNF-α、IL-6水平。
1.2.4 免疫熒光檢測腎組織ROS蓄積水平:取部分新鮮冰凍切片,加入二氫乙啶(dihydroethidium,DHE)探針并于室溫下孵育20 min后,置于熒光顯微鏡下觀察組織染色情況。并隨機取5個視野,用Image Pro Plus 5.0圖像分析系統(tǒng)以單位面積內綠色熒光強度強弱代表細胞中ROS相對水平。
1.2.5 免疫熒光檢測CD31與Nrf2在腎組織中表達:取切片,加入特丁基對苯二酚及0. 25%曲拉通(Triton X-100)處理透化后,加入一抗(兔抗鼠Nrf2、小鼠抗大鼠CD31,(1∶200))4 ℃孵育過夜,加入二抗(TRITC標記的山羊抗兔IgG、FITC標記的山羊抗小鼠IgG,稀釋倍數(shù)為1∶200)孵育顯色后,用防猝滅液封片后于激光共聚焦顯微鏡下觀察,拍照。
1.2.6 免疫組化法檢測腎組織HO-1、eNOS陽性表達:抗原修復后,加入一抗抗體(HO-1、eNOS,1∶500)室溫孵育過夜后,加入羊抗兔二抗(1∶1 000)室溫孵育后,加DAB顯色、蘇木精復染封片后于光鏡下拍照,隨機取5個視野,觀察腎組織血管染色情況,并采用Image Pro Plus 5.0圖像分析系統(tǒng)分析被染成棕黃色的區(qū)域域面積,結果以5個視野陽性表達的平均吸光度值表示。
1.2.7 Western blot檢測大鼠腎組織ANGPTL6、MCP-1蛋白表達水平:將-80 ℃凍存的腎組織,4 ℃解凍后,于冰上用組織勻漿器勻漿,離心分離后,用蛋白提取試劑盒提取蛋白,BCA法檢測蛋白濃度后,取50μL進行電泳和轉膜反應,并加入一抗(ANGPTL6、MCP-1(1∶1 000),β-actin(內參,1∶2 000)抗體4 ℃孵育過夜,加入HRP標記的羊抗兔二抗溶液(1∶2 000)室溫孵育4 h,用化學發(fā)光法顯色,以化學發(fā)光儀觀察條帶并拍照。
1.3 統(tǒng)計學分析

2 結果
2.1 黃芪甲苷Ⅳ對大鼠一般行為的影響
假手術組大鼠無死亡。模型組、黃芪甲苷+Nrf2抑制劑組有3只死亡,大鼠形體消瘦、生長緩慢,飲食較少。黃芪甲苷低、高劑量組大鼠給藥期間無死亡,且體重減輕及飲食減少現(xiàn)象有所改善。Nrf2抑制劑組有5只死亡,且體質量減輕、飲食減少現(xiàn)象進一步加重。
2.2 黃芪甲苷Ⅳ對大鼠血清Scr、BUN、β2-MG水平的影響
與假手術組相比,模型大鼠血清Scr、BUN、β2-MG水平升高(P<0.05)。與模型組相比,黃芪甲苷低、高劑量組大鼠血清Scr、BUN、β2-MG水平回降(P<0.05),且高劑量組優(yōu)于低劑量組;Nrf2抑制劑組大鼠血清Scr、BUN、β2-MG水平升高(P<0.05)(表1)。

表1 各組大鼠血清Scr、BUN、β2-MG水平
2.3 黃芪甲苷Ⅳ對大鼠腎組織病理損傷的影響
假手術組大鼠腎小管毛細血管周結構正常;與假手術組相比,模型組大鼠腎小管周毛細血管管腔紅細胞聚集、內皮細胞腫脹及增大、管腔狹窄及受壓明顯;與模型組相比,Nrf2抑制劑組腎小管周毛細血管管腔紅細胞聚集、內皮細胞腫脹及增大進一步增加;黃芪甲苷低、高劑量組大鼠上述病理損傷減輕明顯,且隨黃芪甲苷劑量增加上述病理損傷改善越顯著;黃芪甲苷+Nrf2抑制劑組上述病理損傷與模型組相近(圖1)。
2.4 黃芪甲苷Ⅳ對大鼠腎組織ROS水平的影響
與假手術組相比,模型組大鼠腎組織ROS水平升高(P<0.05)。與模型組相比,黃芪甲苷低、高劑量組大鼠腎組織ROS水平回降(P<0.05),且隨劑量升高其回降越明顯;Nrf2抑制劑組大鼠腎組織ROS水平升高(P<0.05)(圖2,表2)。

A.sham operation group; B.model group; C.astragaloside Ⅳ low dose group; D.astragaloside Ⅳ high dose group;E.Nrf2 inhibitor group; F.astragaloside Ⅳ + Nrf2 inhibitor group

表2 各組大鼠腎組織ROS水平比較
2.5 黃芪甲苷Ⅳ對大鼠血清TNF-α、IL-6水平的影響
與假手術組相比,模型組大鼠血清TNF-α、IL-6水平升高(P<0.05)。與模型組相比,黃芪甲苷低、高劑量組大鼠血清TNF-α、IL-6水平回降(P<0.05),且隨劑量升高其回降越明顯;Nrf2抑制劑組大鼠血清TNF-α、IL-6升高(P<0.05)(表3)。

表3 黃芪甲苷Ⅳ對大鼠血清TNF-α、IL-6水平的影響
2.6 黃芪甲苷Ⅳ對大鼠腎組織Nrf2及CD31陽性共表達的影響
與假手術組相比,模型組大鼠腎組織Nrf2+CD31+水平升高(P<0.05)。與模型組相比,黃芪甲苷低、高劑量組大鼠腎組織Nrf2+CD31+水平進一步升高(P<0.05),且隨劑量升高其升高越明顯; Nrf2抑制劑組大鼠血清Nrf2+CD31+水平回降(P<0.05)(圖3,表4)。
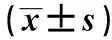
表4 大鼠腎組織Nrf2及CD31陽性表達的影響
2.7 黃芪甲苷Ⅳ對大鼠腎組織HO-1及VEGF陽性表達的影響
假手術組大鼠腎小管上皮細胞區(qū)域、腎小球內皮細胞區(qū)域及腎小球系膜細胞區(qū)域HO-1及eNOS染色較弱。與假手術組相比,模型組大鼠腎組織上述區(qū)域eNOS及HO-1陽性表達升高(P<0.05);與模型組相比,黃芪甲苷低、高劑量組大鼠腎組織eNOS陽性表達降低(P<0.05),HO-1陽性表達升高(P<0.05),且黃芪甲苷劑量越高上述指標變化越明顯;Nrf2抑制劑組eNOS陽性表達升高(P<0.05),HO-1陽性表達降低(P<0.05)(圖4,表5)。

表5 大鼠腎組織HO-1及eNOS陽性表達水平比較Table 5 Comparison of HO-1 and eNOS positive expression levels in rat

A.sham operation group; B.model group; C.astragaloside Ⅳ low dose group; D.astragaloside Ⅳ high dose group; E.Nrf2 inhibitor group; F.astragaloside Ⅳ+Nrf2 inhibitor group
2.8 黃芪甲苷Ⅳ對大鼠腎組織ANGPTL6、MCP-1蛋白表達的影響
與假手術組相比,模型組大鼠腎組織ANGPTL6、MCP-1表達升高(P<0.05)。與模型組相比,黃芪甲苷低、高劑量組大鼠腎組織ANGPTL6、MCP-1表達回降(P<0.05),且黃芪甲苷劑量越高上述指標變化越明顯;Nrf2抑制劑組大鼠腎組織ANGPTL6、MCP-1表達升高(P<0.05)(圖5,表6)。
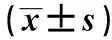
表6 各組大鼠腎組織ANGPTL6、MCP-1蛋白表達水平比較Table 6 Comparison of protein expression levels of ANGPTL6 and MCP-1 in renal tissues of rats in each group
3 討論
腎血管微循環(huán)結構或功能損壞可引起腎小球、腎小管及腎間質損害[8]。低氧條件及炎性刺激下,腎小管周毛細血管更易受到損害[9]。尿毒癥患者血液中Scr、BUN、β2-MG等毒素大量積聚,是導致血管內皮功能失調的主要原因[10]。另外,尿毒癥患者體內炎性因子IL-6、TNF-α升高,可促進紅細胞在毛細血管管腔積聚、引起血管內皮功能損傷、導致腎毛細血管血流中斷,而加重腎損傷[11]。本研究發(fā)現(xiàn),模型組大鼠血清Scr、BUN、β2-MG等毒素及炎性因子IL-6、TNF-α升高的同時,腎小管周毛細血管管腔紅細胞聚集、內皮細胞腫脹及增大等腎血管病變加重,預示模型造模成功。

A.sham operation group; B.model group; C.astragaloside Ⅳ low dose group; D.astragaloside Ⅳ high dose group; E.Nrf2 inhibitor group; F.astragaloside Ⅳ + Nrf2 inhibitor group

A.sham operation group; B.model group; C.astragaloside Ⅳ low dose group; D.astragaloside Ⅳ high dose group; E.Nrf2 inhibitor group; F.astragaloside Ⅳ+Nrf2 inhi-bitor group圖5 Western blot檢測各組大鼠腎組織ANGPTL6、MCP-1蛋白的表達Fig 5 Western blot of ANGPTL6 and MCP-1 protein expression in renal tissue of rats in each group
炎性因子TNF-α、IL-6還可激活細胞外信號調節(jié)激酶(ERK) 通路激活來調控炎癥及氧化應激反應,并促進血管內皮及組織損傷。炎性因子及氧化應激均可促進腎組織及內皮細胞釋放ANGPTL6,并通過激活ERK-eNOS信號通路,來促進內皮細胞釋放NO,誘導腎小球及腎小管血管內皮細胞釋放MCP-1來誘導炎性細胞聚集,從而加重腎臟血管病變[12]。本研究發(fā)現(xiàn)模型組大鼠腎組織中ANGPTL6、MCP-1表達升高的同時,eNOS表達也明顯升高,提示ANGPTL6/eNOS/MCP-1可能與腎血管內皮損傷關系密切。
Nrf2//HO-1通路是抵御外界炎性反應及氧化應激的防御性傳導通路,且與腎損傷關系密切。研究證實,ERK磷酸化,可促進Nrf2釋放并激活抗氧化酶如HO-1表達,來抑制ROS水平升高,發(fā)揮抗氧化反應[13-14]。本研究發(fā)現(xiàn),模型組大鼠Nrf2/HO-1在血管內皮細胞中表達升高,而用Nrf2/HO-1通路抑制劑阻斷Nrf2/HO-1表達后,大鼠死亡、腎組織炎性損傷、腎血管病變進一步加重,提示抑制Nrf2/HO-1通路活化,可加重腎血管內皮損傷。黃芪甲苷Ⅳ對腎臟具有保護作用,能抑制體外培養(yǎng)的人血管內皮細胞凋亡[15]。本研究發(fā)現(xiàn)隨著黃芪甲苷Ⅳ劑量的升高,大鼠腎組織Nrf2/HO-1激活;大鼠腎組織炎性及氧化應激損傷、腎血管內皮損傷緩解越明顯,提示黃芪甲苷Ⅳ發(fā)揮抗尿毒癥腎損傷作用,可能與激活Nrf2/HO-1通路有關。Nrf2抑制劑可逆轉黃芪甲苷Ⅳ上述作用。
綜上所述,黃芪甲苷Ⅳ可能通過促進Nrf2/HO-1通路介導的抗炎、抗氧化途徑激活,減輕尿毒癥大鼠腎血管內皮損傷。為闡明黃芪甲苷保護尿毒癥腎損傷的機制提供了新的可能機制,但尿毒癥腎血管內皮損傷的機制復雜,還涉及自噬過程,黃芪甲苷Ⅳ保護尿毒癥腎血管損傷的其他可能機制還有待進一步深入研究。

