羧基末端乙酰化修飾調控抑癌蛋白p53轉錄特異性
閆曉俊,徐文彬,王冬來
(中國醫學科學院基礎醫學研究所 北京協和醫學院基礎學院 醫學遺傳學系,北京 100005)
p53 作為一種抑癌蛋白,參與細胞命運決定、DNA損傷應答和細胞代謝等生物學過程調控[1-2]。目前發現p53誘導的細胞周期阻滯、凋亡等功能的異常與腫瘤發生發展密切相關[3],研究p53生物學功能的調控機制可為腫瘤靶向治療和篩選抗癌藥物提供依據[4]。蛋白質翻譯后修飾(posttranslational modifications, PTMs)是 p53功能調控網絡的重要環節[5-6],其中乙酰化修飾不僅能夠調控p53的總體轉錄活性及蛋白質的穩定性,還可以在特定條件下調控p53對某些類型靶基因轉錄的選擇性[7]。研究發現羧基末端結構域(carboxyl-ter-minal domain, CTD)是乙酰化水平最高的區域[8]。通過構建模擬乙酰化p53(賴氨酸→谷氨酰胺;K→Q)的小鼠模型發現CTD乙酰化修飾參與p53總體轉錄活性的調控[9-10]。然而,在腫瘤細胞中,是否存在CTD乙酰化修飾特異性調控的p53下游靶基因,目前尚不清楚。本研究旨在通過構建模擬乙酰化p53的分子模型(圖1)和穩轉細胞株并結合全轉錄組測序(RNA-sequencing, RNA-seq),研究腫瘤細胞中p53 CTD乙酰化修飾對基因轉錄特異性的調控。
1 材料與方法
1.1 材料
1.1.1 細胞系:人非小細胞肺癌細胞系H1299(中國醫學科學院基礎醫學研究所細胞資源中心/國家生物醫學實驗細胞資源庫)。
1.1.2 試劑和試劑盒:無四環素的胎牛血清(Gibco公司);DMEM培養基(Corning公司);PCR引物(上海生工生物工程有限公司);載體測序(北 京 擎 科 生 物 科 技 有 限 公 司);RNA測序(北京諾禾致源生物技術有限公司);Doxycycline(Doxy)(Sigma-Aldrich公司);嘌呤霉素、Trizol?和ECL(Invitrogen 公司);SYBR(北京天根生化科技有限公司)。

TAD.transactive domain; PRD.proline-rich domain; DBD.DNA-binding domain; TD.tetramerization domain; A. schematic diagram of the functional domains of p53; B.structure of the lysine (K), acetylated lysine (Ac-K) or glutamine (Q)
1.2 方法
1.2.1 質粒的構建:克隆p53-WT和p53-6KQ全長cDNA,并與Flag標簽融合;插入到改造后的pTripz載體的AgeⅠ和XholⅠ位點,構建成pTripz-F-hp53-WT和pTripz-F-hp53-6KQ質粒。pTripz-F-hp53-WT和pTripz-F-hp53-6KQ質粒的上游引物:5′-AATAC CGGTGCCATGGATTATAAGGATGATGACGATAAAG AGGAGCCGCAGTCAGATCCTA-3′,下游引物:5′-A TTCTCGAGTCAGTCTGAGTCAGGCCCTTCT-3′。經34個循環的變性、退火、延伸的PCR 反應得到擴增產物,并連接進經雙酶切的pTripz載體中,在感受態大腸桿菌細胞中轉化克隆,提取質粒并對擴增片段進行測序分析。
1.2.2 細胞的培養及分組處理:將H1299細胞置于含有10%無四環素胎牛血清DMEM的10-cm培養皿中,培養于37 ℃,5% CO2細胞孵箱中。貼壁細胞達到90%后,接種到3.5 cm培養皿中,24 h后換液。之后將構建的pTripz-F-hp53-WT和pTripz-F-hp53-6KQ質粒各2 μg轉染到H1299細胞中,轉染6 h后換液,待48 h后用含2 μg/mL的嘌呤霉素(puromycin)的DMEM培養基進行抗性篩選。將篩選后的H1299 pTripz-F-hp53-WT和H1299 pTripz-F-hp53-6KQ單克隆細胞分別分為實驗組和對照組兩組,實驗組給予Doxy 1 μg/mL處理24 h,對照組不給予Doxy處理。
1.2.3 Western blot鑒定單克隆穩轉細胞株:分別收集對照組和實驗組的細胞至1.5 mL離心管,用NP40緩沖液提取蛋白。蛋白定量后,取適量蛋白95 ℃變性5 min。用聚丙烯酰胺凝膠電泳進行分離后轉入硝酸纖維素膜,封閉30 min后于4 ℃孵育一抗。用TBS-T緩沖液洗膜后室溫孵育二抗1 h,TBS-T緩沖液清洗后用ECL孵育膜并曝光。
1.2.4 RNA-sequencing樣品制備:分別用1 mL Trizol?試劑收集對照組和實驗組的細胞至無RNase的1.5 mL離心管,在室溫裂解后加入200 μL氯仿,快速混勻后于4 ℃離心。吸取400 μL上清液與400 μL的異丙醇混勻,在室溫放置10 min 后于4 ℃離心。RNA沉淀加入75%的乙醇清洗,于4 ℃離心后去除上清,在室溫靜置干燥后加入適量DEPC(diethylpyrocarbonate)水溶解RNA沉淀。
1.3 統計學分析
將RNA樣品進行全轉錄組測序,且用R語言(http://cran.r-project.org)的DESeq2、ggplot2、clusterProfiler軟件包對基因表達譜數據進行差異表達分析、GO 富集分析和 KEGG 通路分析。其中篩選閾值為P<0.05, |log2 Fold Change|>1。
2 結果
2.1 構建可誘導表達p53的質粒和穩轉細胞株
本研究將p53-WT或p53-6KQ的cDNA克隆到改造后的pTripz載體中(圖2A),測序結果表明成功構建了pTrip-F-hp53-WT和pTripz-F-hp53-6KQ質粒(圖2B)。將pTrip-F-hp53-WT或pTripz-F-hp53-6KQ質粒轉染到p53 表達缺失的H1299細胞中,并經過嘌呤霉素的篩選和克隆的分離,最終得到可誘導表達p53-WT或p53-6KQ的單克隆穩轉細胞株(圖2C)。在Doxy處理后,兩株細胞內p53蛋白的表達均被顯著誘導,且p53-6KQ的CTD乙酰化水平明顯高于p53-WT,表明細胞模型構建成功(圖2D)。

A. schematic diagram of a modified pTripz construct; B.sequencing results showing a substitution of the lysines with the glutamines in p53 CTD; C.workflow of generating a H1299 p53-inducible cell strain(p53 Ten-on); D.Western blot analysis of p53 and acetylated p53 in H1299 p53 Tet-on cell strain upon Doxy treatment
2.2 篩選CTD乙酰化修飾依賴的p53下游靶基因
對誘導表達p53-WT或p53-6KQ的H1299細胞進行全轉錄組測序并通過生物信息學分析進行篩選,在p53-WT組共篩選出2 439個Doxy處理前后差異表達的基因;在p53-6KQ組共篩選出1 473個Doxy處理前后差異表達的基因(圖3A, B)。進一步分析發現在p53-WT組有1 403個基因上調,1 036個基因下調;在p53-6KQ組有870個基因上調,603個基因下調(圖3C, D)。綜合分析兩組之間的差異表達基因后,篩選出1 167個受p53-WT和p53-6KQ共調控的基因、1 272個受p53-WT特異性調控的基因和306個受p53-6KQ特異性調控的基因(圖3B)。
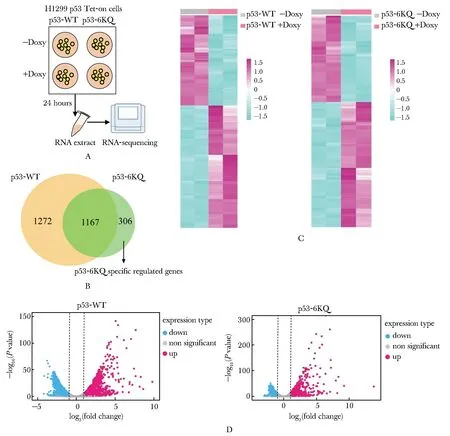
A.flow chart of sample preparation for RNA-sequencing; B,D.Venn diagram (B), heatmap (C) or volcano plots (D) showing differentially expressed genes regulated by p53-WT or p53-6KQ
2.3 CTD乙酰化依賴的p53下游靶基因的生物學功能分析
在GO富集分析中,306個p53-6KQ特異性調控的基因主要富集在細胞命運決定、基因轉錄調控、神經元發育、耳蝸發育、RNA聚合酶Ⅱ啟動子區的轉錄、內膜細胞分化、細胞或亞細胞成分的運動、負性調控上皮細胞的分化等生物學過程(圖4A)。在KEGG富集分析中,p53-6KQ特異性調控的基因主要富集在腫瘤壞死因子(TNF)信號通路、黏著斑、加壓素調節水的重吸收、百日咳、醛固酮合成和分泌、神經營養因子信號通路、細胞外基質(extracellular matrix, ECM)-受體相互作用、蛋白質消化吸收、多巴胺能突觸等信號通路(圖4B)。

A.GO analysis of the top 10 biologcial processes specifically regulated by p53-6KQ; B.KEGG analysis of the top 10 pathways specifically regulated by p53-6KQ
3 討論
本研究共篩選出p53 CTD乙酰化修飾特異性調控的基因306個,進行GO富集分析和KEGG富集分析發現這些基因參與多種生物學過程。富集的生物學通路中有一些與p53調控的細胞增殖、細胞凋亡和DNA損傷應答等生物學功能相關,包括:細胞命運決定基因PTCH2、GATA2、DLL1;正性調控轉錄的基因JUN、TFEB、MYB;腫瘤壞死因子信號通路基因MAPK10、JUNB、CREB5等。這些富集到的相關通路的基因生物學功能與文獻報道相一致。例如:GATA2編碼的GATA2作為一個轉錄因子,其參與早期造血細胞增殖和生存的生物學過程[11],還有研究發現GATA2調控TP53表達從而調節肝癌細胞凋亡[12]。TFEB編碼的TFEB蛋白是一個轉錄因子,在DNA損傷的情況下增強p53依賴的轉錄激活[13]。這些基因的發現表明p53 CTD乙酰化修飾具有增強p53抑癌功能的作用,也提示未乙酰化修飾的p53可能不足以激活某些具有抑癌功能的基因。因此,全面激活p53的腫瘤抑制功能,CTD乙酰化修飾是必不可少的。
此外,本研究還發現p53 CTD乙酰化修飾特異性調控參與神經元分化、耳蝸發育、內胚層細胞分化、垂體發育等生物學過程的基因表達,如神經元分化基因BARHL2、HDAC9;耳蝸發育基因RPGRIP1L、KCNK2;內胚層細胞分化基因COL11A1、LAMA3等。這一發現可歸類于p53參與調控的“非經典(non-canonical)”生物學過程,表明CTD乙酰化修飾豐富了p53依賴的轉錄調控網絡,為研究p53調控的生物學過程的內在聯系提供新的思路。
本研究發現腫瘤細胞中p53 CTD乙酰化修飾通過特異性調控相關基因表達從而參與多種生物學過程,為探索p53乙酰化修飾的生物學功能提供新的方向。但p53 CTD乙酰化修飾是如何在這些生物學過程的調控中發揮作用及其與疾病的聯系仍需進一步研究。

