長鏈非編碼RNA Pvt 1致癌基因在膠質瘤細胞增殖和上皮-間充質轉化過程中的作用研究△
楊安強,楊曉濱,李江濤,吳和剛,王曉軍,劉松,范莉
宜賓市第一人民醫院1神經外科,2中心實驗室,3病理科,4麻醉科,四川 宜賓 644000
膠質瘤是中樞神經系統最常見的惡性腫瘤之一,占顱內腫瘤的20%~60%。世界衛生組織(WHO)依其惡性程度分為4級:Ⅰ~Ⅱ級為低級別膠質瘤,惡性程度較低;Ⅲ級為間變性膠質瘤;Ⅳ級為膠質母細胞瘤。Ⅲ~Ⅳ級膠質瘤均為高度惡性膠質瘤,發病率為(5~8)/100 000,在35~55歲腫瘤患者死亡原因中居第四位,在≤34歲腫瘤患者死亡原因中居第二位。據統計,膠質瘤患者5年生存率為20%~30%,而膠質母細胞瘤僅為1%。目前,外科手術、放療和化療仍是臨床上治療惡性膠質瘤的主要手段,但一般預后較差。因此,從分子水平上研究膠質瘤的發病機制,對于預防和治療膠質瘤具有重要意義。長鏈非編碼RNA(1ong noncoding RNA,lncRNA)是一類不能編碼蛋白質的RNA,其轉錄副本超過200個核苷酸。長鏈非編碼RNA的表達與神經發育、神經退行性和免疫性疾病、精神疾病、原發性腦腫瘤、神經腫瘤等存在密切的聯系。Pvt1致癌基因(Pvt1 oncogene,PVT1)是由PVT1
基因編碼的一個lncRNA,是一種轉錄激活子。研究發現,PVT1參與多種生理學和病理學過程,與腫瘤的發生和發展高度相關,在肝細胞肝癌、乳腺癌、結腸癌、胃癌、腎癌等多種腫瘤中高表達。此外,已經得到公認的是腫瘤細胞發生上皮-間充質轉化(epithelial-mesenchymal transition,EMT)是其獲得侵襲和轉移能力的關鍵環節。然而,PVT1與膠質瘤進展中EMT過程的關系尚未有相關研究。因此,本研究擬通過研究PVT1在膠質瘤細胞增殖和EMT過程中的作用,完善膠質瘤發生和發展的機制,為膠質瘤的治療奠定實驗室基礎,提供全新的治療方向。1 資料與方法
1.1 一般資料
收集2018年1月至2020年1月宜賓市第一人民醫院神經外科收治的40例膠質瘤患者。納入標準:術中病理學檢查證實為原發性膠質瘤;術前未接受過任何放化療及免疫治療;病歷資料完整;自愿簽訂知情同意書。排除標準:合并內分泌系統疾病;伴有血液系統腫瘤;其他系統腫瘤伴腦轉移。取40例膠質瘤患者的膠質瘤組織。腫瘤分級:Ⅰ級5例,Ⅱ級5例,Ⅲ級15例,Ⅳ級15例。另選取5例顱腦外傷后腦腫脹致腦疝形成后進行顱內減壓手術患者的正常腦組織標本作為對照。所有標本采集后,迅速置于液氮中速凍,隨即轉移至-80℃貯存。
1.2 主要材料
胎牛血清和DMEM培養基均購自美國GIBCO公司;Lipofectamine 2000和Trizol均購自美國Invitrogen公司;抗 E-cadherin(ab1416)、抗 N-cadherin(ab76011)和抗Vimentin抗體(ab92547)均購自美國Abcam公司;總蛋白提取試劑盒和CCK-8試劑盒均購自上海碧云天公司。siRNA-PVT1
(正義鏈5'-UUAGUAUCCUGAAAUGUGC-3',反義鏈 5'-GCACAUUUCAGGAUACUAA-3')及其陰性對照siNC
(正義鏈5'-UUCUCCGAACGUGUCACGUTT-3',反義鏈 5'-ACGUGACACGUUCGGAGAATT-3')均由上海吉瑪基因公司合成。正常腦組織細胞HEB,膠質母細胞系U87MG、U251均購自上海細胞庫,培養于10%胎牛血清的DMEM高糖培養基中,37℃5%CO培養箱中。1.3 實驗方法
1.3.1 定量逆轉錄聚合酶鏈反應(quantitative reverse transcription-polymerase chain reaction ,qRT-PCR)檢測 正常腦組織樣本和臨床膠質瘤組織樣本經液氮研磨后,加入Trizol提取組織樣本總RNA(細胞樣本直接加入Trizol,無需液氮研磨)。以提取的總RNA為模板,逆轉cDNA。采用qRT-PCR試劑盒SYBR Green法步驟進行擴增,共擴增35個循環周期。每個樣本重復3次,以β-actin
基因作為內參。3次獨立實驗獲得的數據運用相對表達量2的方法進行分析。PVT1
引物序列為:5'-GGCCAGCCTTTAGAGAGGTC-3'和 5'-TCGGAAGGGCACACATTCAG-3'。1.3.2 細胞轉染 將U87MG和U251細胞按照2×10/孔接種于6孔培養板,各分為兩組,分別轉染siNC和siRNA-PVT1
。轉染48 h或72 h后,qRTPCR檢測轉染效果,進行后續研究。1.3.3 CCK- 8法檢測細胞增殖活性U87MG和U251細胞經轉染后,分為siNC組和siRNA-PVT1
組,將其分別接種于96孔板內,5×10/孔,5%CO37 ℃培養 0、1、2、3天,每個時間點5個復孔。培養結束時,加入10 μl CCK-8試劑,置于培養箱繼續孵育2 h,然后在酶標儀450 nm處測量各孔的光密度(optical density,OD)值,繪制細胞增殖活性曲線。1.3.4 Transwell法檢測細胞侵襲能力 取無血清培養基與BD基質膠按照3∶1的比例混勻,每孔40 μl加入到Transwell小室的上室中,37℃5%CO培養箱中凝固1 h。取轉染的細胞(siNC組和siRNA-PVT1
組),無血清培養基重懸計數,10個細胞加入Transwell小室上室,600 μl完全培養基加入到下室中。在37℃5%CO孵育48 h或72 h后,取出小室,擦去上室的細胞后置于4%多聚甲醛中固定15 min,磷酸鹽緩沖液(phosphate buffered solution,PBS)洗滌1次,結晶紫染色10 min,PBS洗滌1次,計數并拍照(10×10)穿過膜的細胞數量。1.3.5 蛋白質印跡(Western blot)法檢測 收集轉染后的細胞(siNC組和siRNA-PVT1
組),用蛋白裂解液提取細胞總蛋白并測定其濃度,取30 μg總蛋白進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis,SDS-PAGE),其參數為濃縮膠60 V電泳60 min,分離膠120 V電泳70 min;采用濕轉法轉膜,參數為100 V,60 min。然后,5%BSA溶液中封閉60 min,隨后分別加入抗E-cadherin、抗N-cadherin、抗Vimentin抗體(1∶1000)和二抗[抗鼠或抗兔免疫球蛋白G(immunoglobulin G,IgG),1∶5000]。超敏電化學發光(electrochemiluminescence,ECL)試劑A液和B液按體積1∶1混勻,加至水平放置的聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,移入暗室,取醫用X線片覆蓋,曝光1 min左右,依次進行顯影、定影。以GAPDH作為內參蛋白,以目的蛋白與內參蛋白灰密度的比值作為蛋白的相對表達量。1.4 統計學分析
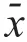
2 結果
2.1 PVT 1表達水平的比較
與正常腦組織相比,隨著膠質瘤分級的增加,PVT1
表達水平逐漸升高(P
<0.05)(表1)。膠質母細胞系U251和U87MG(相當于WHOⅣ級)的PVT1
表達水平均明顯高于正常HEB細胞系,差異均有統計學意義(P
<0.01)(表2)。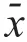
表1 正常腦組織及不同腫瘤分級的膠質瘤組織中PVT 1表達水平的比較(±s)
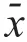
表2 HEB、 U87MG、 U251細胞系中PVT 1表達水平的比較(±s)
2.2 PVT 1對膠質母細胞增殖的影響
培養2、3天后,siRNA-PVT1
組U87MG和U251細胞OD值均低于siNC組,差異均有統計學意義(P
<0.05)。(表3)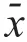
表3 siNC組和siRNA-PVT1組 U87MG和 U251細胞中OD值的比較(±s)
2.3 PVT 1對膠質母細胞侵襲的影響
與siNC組相比,siRNA-PVT1
組U87MG和U251細胞侵襲細胞數量均減少,差異均有統計學意義(P
<0.05)。(圖1、表4)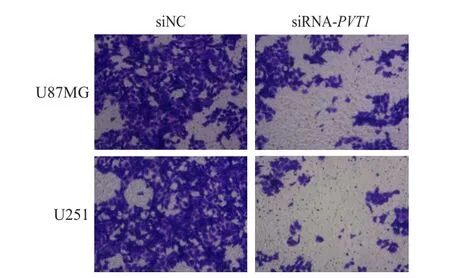
圖1 Transwell檢測siNC組和siRNA-PVT 1組 U87MG和U251細胞的侵襲情況(結晶紫染色,×100)

表4 siNC組和siRNA-PVT 1組 U87MG和 U251細胞系的細胞侵襲數目比較(x± s)
2.4 PVT 1對EMT相關蛋白表達的影響
siRNA-PVT1
組U87MG和U251細胞系中E-cadherin蛋白相對表達量均高于siNC組,N-cadherin和Vimentin蛋白相對表達量均低于siNC組,差異均有統計學意義(P
<0.05)。(圖2、表5)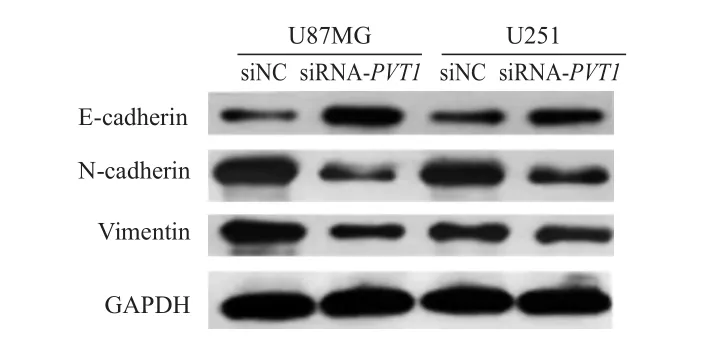
圖2 Western blot檢測siNC組和siRNA-PVT 1組 U87MG和U251細胞系中E-cadherin、N-cadherin和Vimentin蛋白表達情況
表5 siNC組和siRNA-PVT 1組 U87MG和 U251細胞系中E-cadherin、N-cadherin和Vimentin蛋白相對表達量的比較(±s)
3 討論
在成年原發性腦腫瘤患者中,膠質瘤的惡性程度最高,預后最差,特別是Ⅲ~Ⅳ級膠質瘤。在膠質瘤的進展中,lncRNA扮演著重要的角色。lncRNA與膠質瘤發病機制、轉移性、侵襲性及預后情況等均存在一定的關系,其相互關聯性已成為近年來膠質瘤研究的熱點和難點。比如,多個與免疫相關 的lncRNA (AC046143.1、AC021054.1、AC080112.1、MIR222HG和PRKCQ-AS1)與患者的生存能力密切相關,可以用作膠質母細胞瘤預后的潛在指標和潛在治療方法。PVT1在膠質瘤中的作用本課題組早已關注。先前的研究發現,PVT1通過調控Zeste
基因增強子同源物2(enhancer of Zeste homolog 2,EZH2)表達水平來調節膠質母細胞瘤的增殖、遷移和侵襲能力,最終影響膠質瘤患者的預后。臨床組織樣本的研究發現,膠質瘤的惡性程度越高,PVT1的表達水平越高,高水平的PVT1可能促進膠質瘤進程。那么,PVT1是否參與膠質母細胞瘤的EMT過程呢?EMT可使上皮細胞失去極性,成為具有活動能力、能在細胞基質自由移動的間質細胞。EMT發生時,上皮細胞標志物E-cadherin、α-catenin、β-catenin、黏蛋白等表達下調,間質表型標志物N-cadherin、Vimentin、基質金屬蛋白酶等表達上調。其中,E-cadherin
的缺失是EMT最重要的標志性變化,伴隨著腫瘤細胞間的黏附減弱和腫瘤細胞運動能力增強。因此,EMT發生后腫瘤細胞的侵襲能力明顯增強。膠質瘤作為神經上皮細胞來源的腫瘤,Ⅲ~Ⅳ級膠質瘤不僅具有較強的增殖潛能,極易形成大的腫塊,而且具備超強的侵襲性生長的特點,能夠持續侵犯正常腦組織。通過siRNAPVT1
細胞轉染,沉默U87MG和U251細胞中PVT1
水平發現,細胞增殖活性和侵襲能力顯著下降,而Western blot檢測顯示EMT上皮細胞標志物E-cadherin升高,間質表型標志物N-cadherin和Vimentin下調,EMT過程受到明顯抑制。因此,本研究推測PVT1參與了膠質母細胞瘤的EMT過程,進而調控了膠質母細胞瘤的侵襲,但其調控機制尚不清楚。綜上所述,lncRNA PVT1在膠質瘤中異常高表達,其表達水平與膠質瘤惡性程度有關;PVT1可能通過調節EMT過程進而影響膠質瘤細胞的侵襲能力;推測PVT1-EMT-侵襲調控過程可能為膠質瘤的基因療法提供了一個新方向和思路。

